circRNA信号通路在食管癌中的表达及对放化疗的影响
张正 朱林文 李旎 邵国丰
食管癌是常见的消化道恶性肿瘤。目前食管癌的发病率在肿瘤中排名第八,总体死亡率排名第六[1]。食管癌的组织学类型主要为食管鳞状细胞癌(esophageal cell carcinoma,ESCC)和食管腺癌(esophageal adenocacinoma,EAC),其中 90%为 ESCC[2]。在中国,食管癌的发病率和死亡率居高不下,许多患者确诊时已是晚期,手术治疗方案难以有效开展,所以食管癌的放化疗方案在当前我国的食管癌临床治疗中的作用尤为重要。环状RNA(circular RNA,circRNA)是近年来被发现的一种RNA。随着RNA测序技术的高速发展及临床上为寻求更完善的疾病诊疗方案,circRNA的特征和功能逐渐被研究人员发现与重视。本文就circRNA及其信号通路在食管癌中的表达及对放化疗的影响作一综述。
1 circRNA的特性
circRNA最早于1976年在病毒中被发现[3]。起初,研究人员将circRNA看作前体mRNA错误加工的产物[4]。它以共价闭合环结构存在,相比于传统的线性RNA,它没有5'端的帽子结构和3'端的poly(A)尾巴[5],且对核糖核酸酶降解的敏感性较低[6],这使得它能够在细胞活动中持续稳定表达。circRNA具有分子海绵、调节基因转录、转录翻译和蛋白质修饰等作用,这些使得它在细胞的生命活动中具有重要作用。
有研究显示,circRNA表达异常的患者发生食管癌的危险度是普通人群的3.92倍,而circRNA表达正常的患者比例仅占29%[7]。这表明circRNA在食管癌的发生和发展中具有特异性的表达,发挥致癌或抑癌的作用,而部分circRNA的这种致癌或抑癌作用则是通过进一步调节circRNA-微小RNA(micro mRNA,miRNA)-mRNA信号通路来实现的[8]。
2 circRNA相关生物学功能和信号通路
circRNA参与了生命活动的全过程,如细胞过程、生物过程、代谢过程等,肿瘤的发生和发展与这些过程密切相关。Su等[9]运用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库分析了circRNA可能参与的生物过程,如细胞过程、代谢过程等,最终发现了10条与circRNA上调相关的信号通路,包括嗅觉转导、剪接体、谷氨酸能突触和磷脂酰肌醇信号通路等;还有17条与circRNA下调相关的信号通路,包括神经营养因子信号通路、Wnt信号通路、微生物代谢和胰岛素信号通路等。
circRNA具有充当海绵吸附miRNA、调节基因表达以及修饰蛋白质的功能[10-11]。而在迄今发现的circRNA中,大多数是作为miRNA的海绵发挥生物学作用[12-14]。Jiang等[15]构建了由64个miRNA联系32个差异表达的circRNA和98个差异表达mRNA的竞争性内源性RNA(ceRNA)网络,探究了circRNA的miRNA信号通路,有助于了解食管癌中的circRNA相关机制。
circRNA的序列上具有miRNA结合位点,这是它作为miRNA海绵发挥功能的基础。circRNA的这一特性表明circRNA可以通过调节miRNA进一步来调节下游基因的表达[16]。circRNA和miRNA相互作用,调控疾病发生和进展。例如,circWDR77通过调节miR-124进一步促进心血管系统中血管平滑肌细胞的增殖和迁移[17]。circRNA-miRNA通路也已被证实在肿瘤的发生、发展中发挥重要作用。例如,circ-MMP9可以通过吸附miR-124来促进多形性胶质母细胞瘤细胞的增殖、迁移和侵袭[18];circRNA_001937在皮肤鳞状细胞癌中可能通过海绵miRNA-597-3p/FOSL2通路影响癌症进展[19];circRNA-0008717通过海绵化miR-203上调Bmi-1的表达,从而影响骨肉瘤的进展[20];circ_ABCB10与包括食管癌在内的多种癌症的增殖、侵袭、远处转移和预后等方面密切相关[21]。此外circRNA的调节范围还包括肺癌[22]、胰腺癌[23]、胃癌[24]等。上述研究不仅证实了许多circRNA可以与miRNA结合,在人类疾病中发挥不同的功能作用,并且同一circRNA能够通过不同的结合位点靶向结合多种miRNA执行各自的功能。例如,circRNA_001059可以通过结合几种特定的miRNA来作为miRNA的抑制剂,包括 miR-30c-1、miR-30c-2、miR-122、miR-139-3p、miR-339-5p和miR-1912[9];circ-ITCH分别可以通过miR-7/EGFR通路[25]以及miR-17/miR-224/p21/磷酸酶张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)通路[26]在不同的癌症中的细胞增殖、迁移、侵袭和转移进程中发挥作用。
尽管笔者尚未了解大多数circRNA的确切功能,但已有研究发现可以通过控制基因参与癌症的治疗。Wang等[27]研究发现circPTK2的过表达使其与miR-492和miR-200b-3p结合,通过控制TIF1γ基因来抑制TGF-β诱导的上皮细胞间质化和转移,这表明circRNA可能有阻碍癌症进展的作用。Du等[28]观察到circPRKCI参与了miR-545/miR-589和E2F7蛋白的调控轴,通过干扰circPRKCI转染可以影响肿瘤的大小和重量。这些研究暗示通过干预circRNA信号通路中各环节的表达,可以进一步挖掘包括食管癌在内的多种癌症的治疗潜力,开发新型治疗方案。
3 circRNA及其信号通路在食管癌中的表达
3.1 circRNA在食管癌中的表达 circRNA在肿瘤中的研究日益深入,其中就包括食管癌[29]。Shi等[30]通过比较食管癌与癌旁正常食管组织的circRNA表达水平,在食管癌组织中发现了469个上调的circRNA,275个下调的circRNA。其中,hsa_circRNA_103670上调最为明显,为癌旁正常食管组织的20.3倍;hsa_circRNA_030162下调最为明显,为癌旁正常食管组织的1/12.1。Li等[31]运用微阵列分析法分析了3例食管癌患者和3名健康对照者血液样本中的circRNA表达谱,共鉴定出食管癌患者和匹配的健康对照者之间有11 381个circRNA存在明显差异。对比其他25例ESCC患者血液样本中的circRNA表达情况,发现有5 705个circRNA(50.13%)上调,5 676个(49.87%)下调。在这项研究中,上调最为明显的前10个circRNA为hsa_circ_0000977、hsa_circ_0006220、hsa_circ_0043278、hsa_circ_0000691、hsa_circ_0000288、hsa_circ_0000367、hsa_circ_0021647、hsa_circ_0006440、hsa_circRNA_405571和hsa_circRNA_100790;而下调最为明显的前10个circRNA为hsa_circ_0008389、hsa_circ_0089763、hsa_circ_0089762、hsa_circ_0000102、hsa_circ_0001714、hsa_circ_0089761、hsa_circ_0007326、hsa_circ_0001549、hsa_circ_0005133和hsa_circRNA_405965。
Zhao等[32]通过细胞实验,验证了过表达的circ-BMI1抑制了实验裸鼠体内食管癌a109细胞的增殖、迁移,以及食管癌a109细胞的集落形成和肿瘤生长。另外有研究证实,circ_0000337在食管癌的细胞增殖和进展中作为致癌基因发挥关键作用[33]。在一项MTT实验中显示,过表达的hsa-circ_0001946显著降低了食管癌细胞的增殖能力[34]。Li等[31]发现提高ESCC中hsa_circ_0000977水平可以促进肿瘤细胞增殖、迁移,并且抑制肿瘤细胞凋亡,且hsa_circ_0000977的表达水平与ESCC患者的肿瘤病理分期(pT分期)和淋巴结数量有关。
3.2 circRNA调控食管癌的进展 circVRK1通过调节miR-624-3p/PTEN信号通路抑制食管癌的进展[35]。circRNA LPAR3通过海绵吸附miRNA-198上调MET基因表达,激活RAS/MAPK和PI3K/Akt通路,促进食管癌细胞的迁移、侵袭,并且circRNA LPAR3在食管癌组织中的表达与临床分期及淋巴结转移呈正相关,但与性别、年龄、肿瘤浸润深度或组织分化程度无关[36]。食管癌细胞中上调的hsa_circ_0000977通过充当miR-874-3p的海绵促进细胞增殖、迁移和抑制体外食管癌细胞的凋亡,而下游的靶向基因可能是TP53INP2或KMT2D[31]。食管癌细胞中circRNA-0008717充当miR-203的海绵,circRNA-0008717与miR-203结合以增加Slug表达,从而增强食管癌细胞的增殖、侵袭和迁移。流式细胞术证实,circ_ABCB10通过海绵化miR-203,增加了Slug的表达,从而促进了食管癌细胞的增殖、侵袭和迁移[37]。还有实验表明,circ_ABCB10还可以通过与miR-670-3p结合促进食管癌细胞的转移和增殖,但miR-670-3p的下游靶基因及其机制尚未明确[38]。总的来说,circRNA在食管癌中特异性表达,发挥致癌或抑癌的作用,并与食管癌的生长增殖、远处转移、分期等密切相关[39]。
4 circRNA及其信号通路的表达和食管癌治疗的关系
目前,尽管在食管癌的临床治疗中已经使用了放疗和化疗等新方法,但由于肿瘤细胞远处转移和治疗耐药性,食管癌患者的5年生存率低至20%左右[1]。先前的一项调查显示,在超过455 800例被诊断为食管癌的患者中有400 200例患者死于这种疾病[40]。对放疗和化疗中食管癌耐受性的circRNA的相关作用机制的进一步研究可能会有助于改进治疗方案,使得食管癌患者的治疗与预后情况得到改善。
4.1 circRNA及其信号通路对食管癌化疗的影响化疗是治疗晚期食管癌的重要手段。研究发现,部分circRNA可以通过干扰DNA损伤失调反应、糖酵解、细胞的上皮-间充质转化、细胞自噬、细胞凋亡过程,以及影响ABC转运蛋白、淋巴细胞和癌症干细胞来调节肿瘤的耐药性[41]。hsa_circ_0008078通过促进胞质多聚腺苷酸化元件结合蛋白4(cytoplasmic polyadenylation element binding protein 4,CPEB4)的泛素化和降解来抑制CPEB4介导的Mcl-1翻译以减轻顺铂耐药性[42]。此外还有部分circRNA比如circRNA_001275[43]、circ_0006168[44]、circPSMC3[45]、circGOT1[46]、circ_0000337[47]、Hsa_circ_0000277[48]、Hsa_circ_0007142[49]通过海绵化miRNA参与食管癌的化疗敏感性调节,见表1。
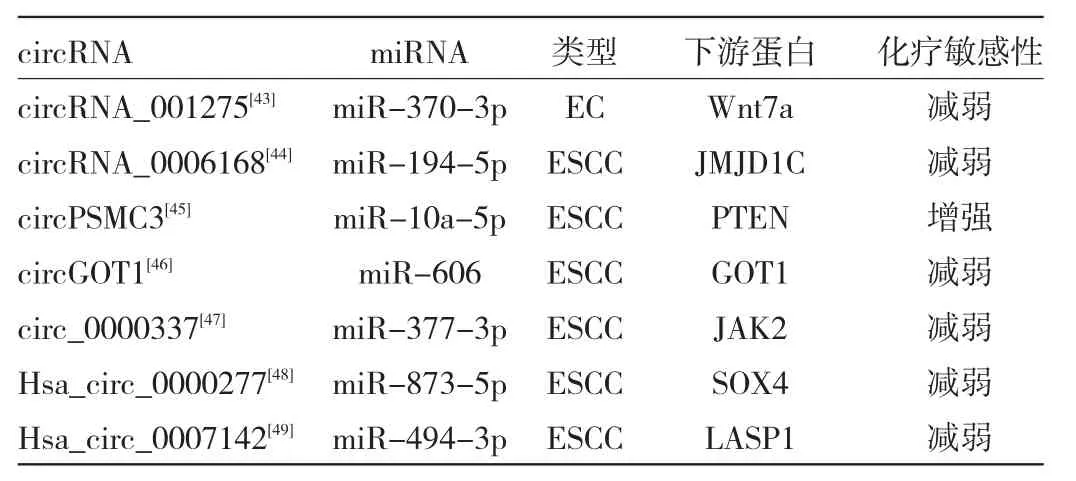
表1 circRNA信号通路对食管癌化疗敏感性的影响
4.2 circRNA及其信号通路对食管癌放疗的影响在肿瘤中,circRNA与辐射抗性和辐射敏感性有关。当接受辐射时,改变的circRNA通过激活信号通路和靶向基因来调节细胞的生物过程,如DNA损伤反应、上皮-间质转化、细胞凋亡、自噬、细胞分裂周期、细胞代谢[50]。放疗是临床上治疗食管癌的重要手段,但由于食管癌细胞存在放射抗性,因此有部分患者对于放疗的治疗效果不尽人意[51],说明目前的放疗方案还需要进一步的优化。已有研究表明放射耐药食管癌细胞与circRNA的异常调控有关。Su等[9]用miRanda软件,将人放射抗性食管癌细胞系KYSE-150R与亲代细胞系KYSE-150相比较,共鉴定出57个上调的circRNA调节120个miRNA的表达水平,并鉴定出12个下调的circRNA调节36个miRNA的表达水平。部分circRNA通过Wnt信号通路在食管癌放射抗性中发挥调控作用。circRNA_100367通过miR-217/Wnt3通路减弱了ESCC 的放射抗性[52]。此外 circVRK1[35]、circATIC[53]、circPRKCI[54]、hsa_circ_0014879[55]、circ_0000554[56]通过相应的miRNA通路调节食管癌的放射敏感性,见表2。上述研究表明,寻找受circRNA调控的下游miRNA/蛋白质,研究circRNA及其信号通路对于揭示circRNA介导食管癌辐射敏感性的潜在机制,提升食管癌的放疗敏感性可能有一定价值。
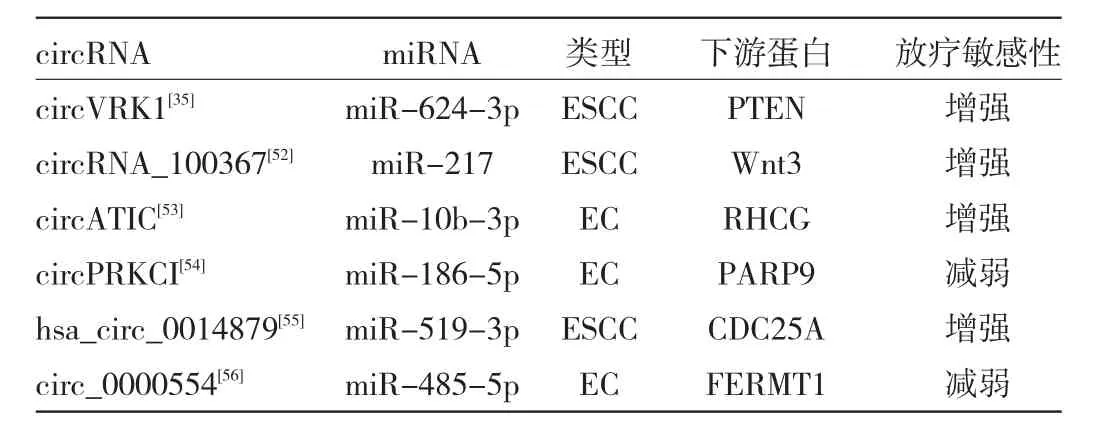
表2 circRNA信号通路对食管癌放疗敏感性的影响
5 小结与展望
化疗与放疗给食管癌,特别是晚期食管癌患者带来了手术治疗外的更多选择,但随之而来的放化疗耐受性问题需要解决。近年来circRNA被发现在疾病发展与治疗中发挥重要作用,这对食管癌的研究和治疗具有巨大的吸引力。机制和功能研究已经使circRNA从无用的剪接副产物转化为肿瘤诊断和治疗的潜在靶点。尽管目前对circRNA的生物学功能和机制的了解仍然有限,但持续的探索会使circRNA在肿瘤的治疗中发挥更大作用。进一步开展circRNA及其信号通路对食管癌患者放化疗耐受性影响相关机制的研究,有望为食管癌的治疗方案提供新的方向。
虽然circRNA在食管癌研究中已经取得了一定进展,但关于circRNA对食管癌放化疗影响的研究仍处于起步阶段,circRNA影响放化疗效果的一些具体机制尚不清楚。本综述主要着眼于circRNA及部分信号通路在食管癌中的相关表达,对通路下游的功能如蛋白质编码的研究有限。此外,食管癌的发生、发展与免疫调节密切相关,而在食管癌免疫领域的circRNA研究较少。进一步研究circRNA在食管癌放化疗中的表达情况和详细作用机制,可为了解circRNA如何影响食管癌的放化疗耐受性提供新的见解,促进临床上对食管癌放化疗方案的合理改进,从而改善食管癌患者的生存状况和生活水平。
综上所述,circRNA及其信号通路在食管癌的化疗与放疗方面具有潜力。相信通过研究人员的不断努力,circRNA将成为克服食管癌的一个强大的工具。

