基于网络药理学和分子对接探讨土茯苓-车前子干预尿酸性肾病作用机制
黄艺飞,尹延哲,邵忠林,张伟平,胡荣雪,佟颖,2
1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040
尿酸性肾病(uric acid nephropathy,UAN)是由高尿酸血症(hyperuricemia,HUA)导致尿酸盐结晶在肾脏沉积过多,引起肾脏受损的一类疾病[1]。UAN临床表现以蛋白尿、水肿、少尿、高血压、高尿酸等为特征[2]。HUA在全球的高发病率给社会带来巨大的健康和经济负担[1]。
中医治疗UAN在保护肾功能、改善肾损害方面有显著优势[3]。土茯苓有清热利湿、通利关节功效,可用于治疗湿热壅毒引起的疾病,其主要化学成分黄酮类可抑制黄嘌呤氧化酶活性,减少尿酸生成[4]。车前子具有清热、平肝、明目、利水功效,用于治疗尿频尿急、目赤肿痛、痛风等疾病[5]。研究显示,车前子能抑制嘌呤酶,减少尿酸生成[6]。土茯苓、车前子能下调高尿酸大鼠肾脏尿酸转运蛋白1 mRNA表达,促进尿酸排泄,从而改善HUA[7]。本研究通过网络药理学及分子对接方法,探究土茯苓-车前子干预UAN的可能机制,以期为中医治疗UAN提供理论依据。
1 资料与方法
1.1 土茯苓-车前子活性成分及靶点筛选
利用TCMSP(https://tcmsp-e.com/)分别检索土茯苓、车前子化学成分,根据口服生物利用度(OB)≥30%和类药性(DL)≥0.18为条件筛选活性成分,通过TCMSP检索活性成分对应靶点。
1.2 疾病靶点筛选
利用GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、TTD(http://db.idrblab.net/ttd/)数据库,以“uric acid nephropathy”为关键词检索疾病相关靶点,利用UniProt 数据库(https://www.uniprot.org)对药物靶点与疾病靶点名称进行校正并转化为基因名称。
1.3 交集靶点获取
利用WPS Office Execl 11.1将药物靶点与疾病靶点取交集,交集靶点即土茯苓-车前子干预UAN的潜在靶点。
1.4 蛋白相互作用网络构建
将交集靶点导入STRING11.0 数据库(https://string-db.org/),设定物种为“Homo sapiens”,置信度>0.4,隐藏网络中游离靶点,构建蛋白相互作用(PPI)网络,保存为tsv文件。利用Cytoscape3.7.2的CytoNCA 插件计算网络中各节点的拓扑参数,构建PPI核心网络。
1.5 活性成分-靶点网络构建
利用Cytoscape3.7.2软件绘制活性成分-靶点网络,利用CytoNCA插件对网络进行分析,得到干预UAN的主要活性成分及作用靶点。
1.6 GO功能和KEGG通路富集分析
将交集靶点导入DAVID6.8数据库(https://david.ncifcrf.gov/),进行GO功能和KEGG通路富集分析,以P<0.05为筛选条件,将结果导入R软件,进行可视化处理。
1.7 活性成分与核心靶点分子对接
利用PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库下载药物活性成分2D结构,再通过Chem3D软件把2D结构转化为3D结构。利用RCSB Protein Data Bank(https://www.rcsb.org/)下载核心靶点蛋白的3D结构,筛选条件:①蛋白结构来源于人;②构象分辨率<2.5 Å;③蛋白构象序列完整且有小分子配体;④结晶pH值接近人体生理范围。利用AMDock1.0软件对主要活性成分与核心靶点进行分子对接,使用PyMol软件对结果进行可视化。
2 结果
2.1 土茯苓-车前子活性成分及靶点获取
通过TCMSP检索获得土茯苓活性成分15个,车前子活性成分9个,二者共同成分2个,见表1。通过TCMSP 检索对应靶点,去除重复后共获得靶点309个。

表1 土茯苓-车前子活性成分信息
2.2 疾病靶点与交集靶点获取
通过GeneCards、OMIM、TTD数据库分别获得疾病靶点975、556、0个,剔除重复靶点后获得UAN相关靶点1 512个。
将土茯苓-车前子作用靶点与疾病靶点取交集,经UniProt校对后得到59个共有靶点,即土茯苓-车前子干预UAN的交集靶点。
2.3 蛋白相互作用网络
将59个交集靶点导入STRING11.0数据库构建PPI网络,见图1。该网络有56个靶点和427条边。筛选拓扑参数均大于中位数的靶点,将大于度值中位数2倍的靶点作为核心靶点,得到核心靶点7个,分别为IL6、TNF、PPARG、TP53、IL1B、PTGS2、NOS3,以此为基础建立PPI网络,见图2。

图1 土茯苓-车前子干预UAN交集靶点PPI网络
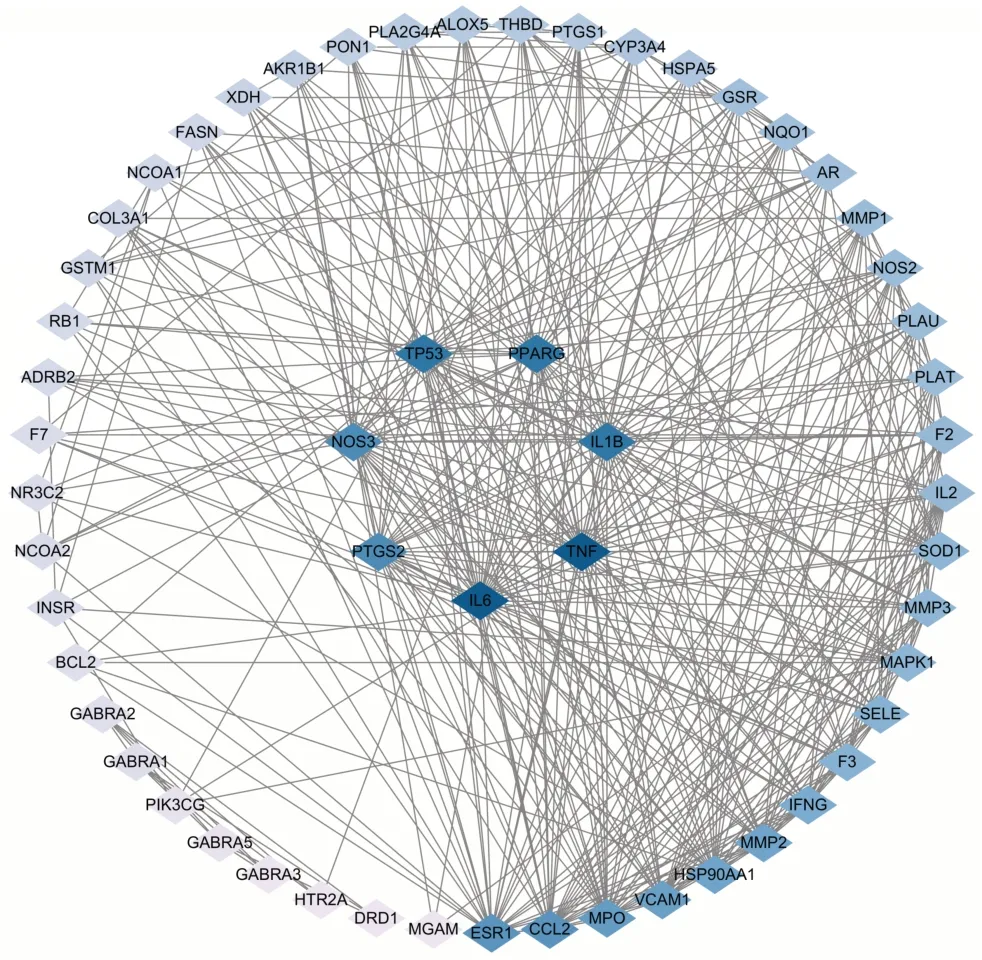
图2 土茯苓-车前子干预UAN核心靶点PPI网络
2.4 活性成分-靶点网络
利用Cytoscape3.7.2软件绘制土茯苓-车前子活性成分-靶点网络,该网络有78 个节点,包括槲皮素(quercetin)、β-谷甾醇(beta-sitosterol)、豆甾醇(stigmasterol)、柚皮素(naringenin)等19 个活性成分,前列腺素G/H合酶2(PTGS2)、前列腺素G/H合酶1(PTGS1)等59个靶点,通过139条边连接,见图3。通过CytoNCA插件计算,筛选出大于度值中位数2倍的6个活性成分,见表2。
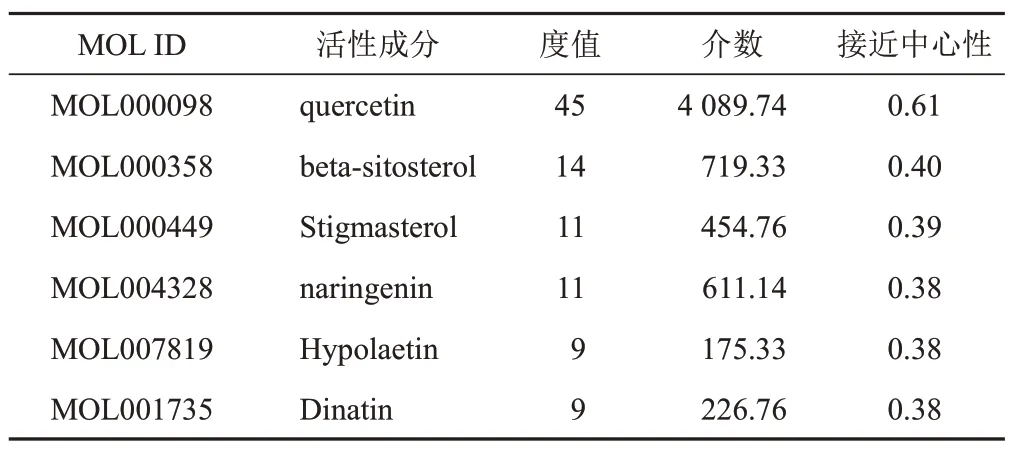
表2 土茯苓-车前子干预UAN主要活性成分拓扑分析

图3 土茯苓-车前子活性成分-靶点网络
2.5 GO功能和KEGG通路富集分析结果
对59个交集靶点进行GO功能分析,以P<0.05为筛选条件,得到生物过程(BP)238个,包括细胞因子介导的信号通路(cytokine-mediated signaling pathway)、基因表达的正调控(positive regulation of gene expression)、炎症反应(inflammatory response)、细胞迁移的正调控(positive regulation of cell migration)、老化(aging)等;细胞组分(CC)39个,包括质膜(plasma membrane)、细胞外间隙(extracellular space)、胞外区(extracellular region)、大分子复合物(macromolecular complex)、内质网内腔(endoplasmic reticulum lumen)等;分子功能(MF)46 个,包括相同蛋白结合(identical protein binding)、酶结合(enzyme binding)、丝氨酸型内肽酶活性(serine-type endopeptidase activity)、血红素结合(heme binding)、神经递质受体活性(neurotransmitter receptor activity)等。以P值升序排序,取各项前10位用R软件绘制气泡图,见图4~图6。
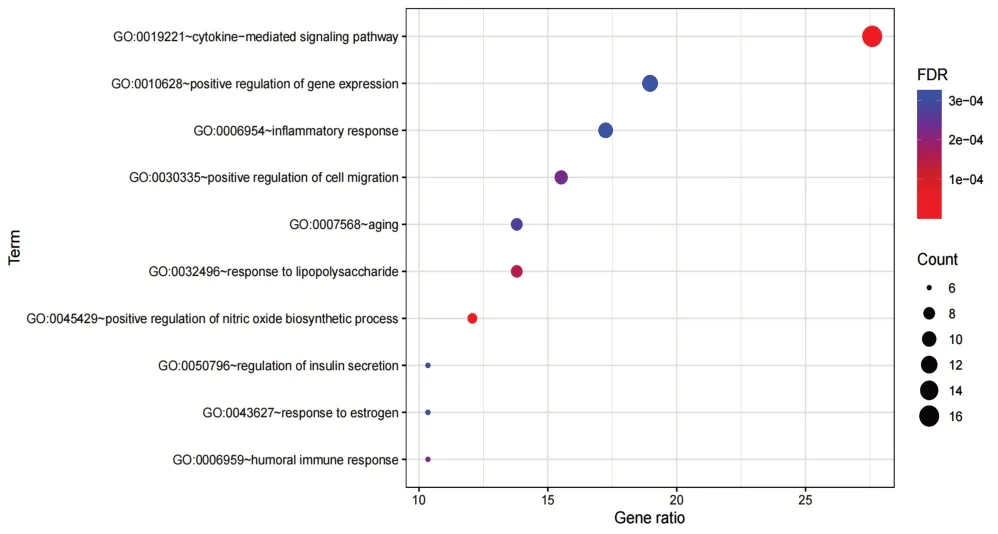
图4 土茯苓-车前子干预UAN靶点GO-BP富集分析
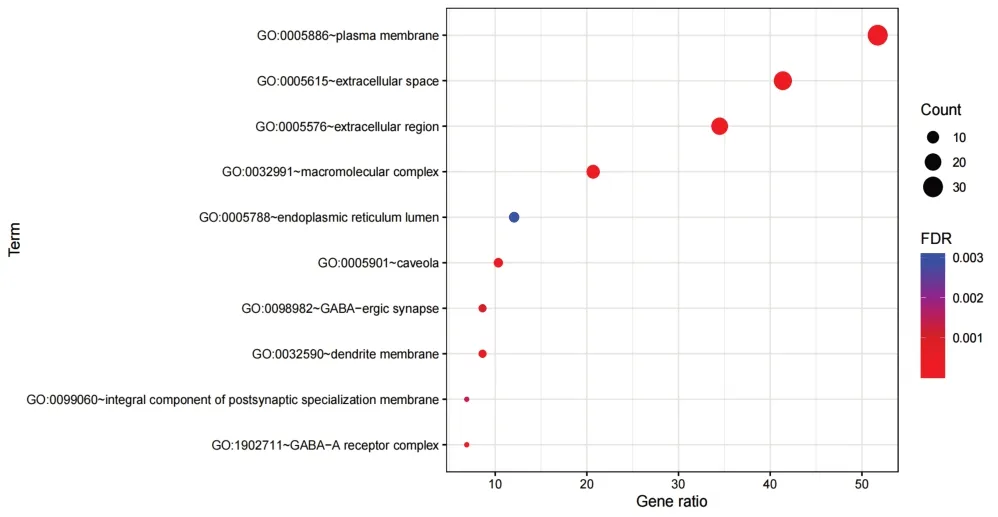
图5 土茯苓-车前子干预UAN靶点GO-CC富集分析

图6 土茯苓-车前子干预UAN靶点GO-MF富集分析
KEGG富集分析得到84个相关通路,以P值升序排列,取前10 位信号通路用R 软件绘制气泡图,见图7。主要作用于癌症通路(Pathways in cancer)、脂质与动脉粥样硬化(Lipid and atherosclerosis)、流体剪切应力与动脉粥样硬化(Fluid shear stress and atherosclerosis)、糖尿病并发症中的糖基化终末产物及其受体信号通路(AGE-RAGE signaling pathway in diabetic complications)等。

图7 土茯苓-车前子干预UAN靶点KEGG通路富集分析
2.6 分子对接结果
将主要活性成分槲皮素、β-谷甾醇、豆甾醇、柚皮素与4个核心靶点IL6、TNF、PPARG、TP53分别进行分子对接。一般认为,结合能<-5 kcal/mol表明成分与靶点有较强的结合活性,若<-7 kcal/mol则提示有强烈结合活性[8]。运用AMDock1.0软件进行分子对接,结果显示,各成分与靶点均具有较强结合活性,其中槲皮素、β-谷甾醇、豆甾醇、柚皮素与PPARG具有强烈结合活性,见表3。另外,选取槲皮素与4个靶点进行对接可视化分析,发现槲皮素与IL6 的ARG167、SER175、PRO64残基形成氢键,与TNF的GLN125、LEU93、ARG82 残基形成氢键,与PPARG 的CYS432、ILE268残基形成氢键,与TP53的GLN19、HIS73、LYS69残基形成氢键,见图8。
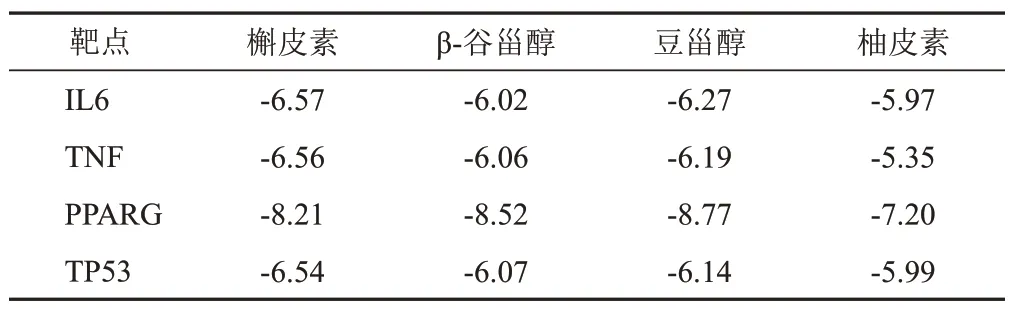
表3 核心靶点与主要活性成分分子对接平均结合能(kcal/mol)
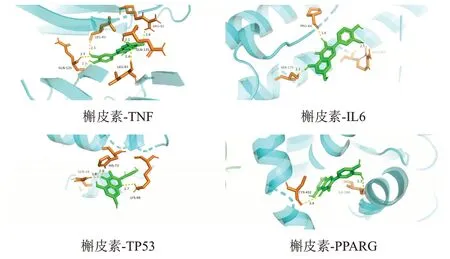
图8 槲皮素与核心靶点分子对接模式
3 讨论
根据临床症状,UAN 属中医学“痹证”“腰痛”“历节”等范畴。《素问·痹论篇》有“风寒湿三气杂至,合而为痹”,《灵枢·经脉》云:“足少阴之别……虚则腰痛。”UAN病机为正气亏虚,肝脾肾受损,湿、痰、瘀等邪久积体内,属本虚标实之证,病位在肾,与肺、肝、脾等脏有关。根据其基本病机,应以健脾益肾、利湿泄浊、活血化瘀为基本治法[3]。土茯苓味甘、淡,性平,归肝、胃经,可除湿解毒、通利关节。车前子味甘、性寒,入肾、膀胱经,可利水通淋、渗湿止泻。土茯苓、车前子能入肝肾,泄湿浊,符合UAN基本治法。
本研究运用网络药理学方法,从土茯苓-车前子中筛选出22个干预UAN的活性成分,其中槲皮素、β-谷甾醇、豆甾醇、柚皮素等可能在UAN发生发展过程中起重要作用。槲皮素可通过调节大鼠肾组织有机阴离子转运蛋白3、多药耐药相关蛋白4、乳腺癌耐药蛋白和多药及毒性化合物外排转运蛋白1水平,增加尿酸排泄,降低血尿酸水平,从而改善UAN 造成的肾损伤[9]。此外,槲皮素可调节转化生长因子-β1、环氧化酶-2、核因子-κB水平和半胱氨酸酶-3、Bcl-2表达,调节肝肾毒性,改善肝肾组织病理变化,恢复细胞抗氧化能力[10]。β-谷甾醇是植物甾醇类成分之一,能通过降低趋化因子和炎症因子表达发挥降低胆固醇、降血糖、抗氧化、抗炎、抑菌和抗癌等作用[11]。其抗炎机制主要是抑制TLR4/NF-κB、NLRP3、STAT 和MAPK等信号通路[12]。豆甾醇具有抗炎、抗肿瘤等生物活性,通过影响MAPK3和PRKACA调控细胞因子表达,起到抗炎作用[13]。Kishore等[14]发现,豆甾醇可能通过减少AGEs形成和改善氧化应激,影响糖尿病肾病进展。根据β-谷甾醇和豆甾醇在抗炎方面的作用,我们推测,其可能通过干预UAN引起的炎症反应,从而改善高尿酸引起的肾损害。柚皮素对促炎因子和抗炎因子都有一定调节作用,可降低血清丙氨酸氨基转移酶和天冬氨酸氨基转移酶水平,进而降低血尿素氮、血肌酐、血尿酸水平,改善四氯化碳诱导的大鼠肝肾损伤[15]。
PPI 网络分析发现,IL6、TNF、PPARG、TP53、IL1B、PTGS2、NOS3靶点可能在土茯苓-车前子干预UAN过程中起重要作用。白细胞介素(IL)-6是一种促炎因子,可激活其他细胞释放血管内皮因子,减少中性粒细胞明胶酶相关脂质运载蛋白分泌,抑制肾脏炎症和纤维化,从而改善慢性UAN肾损伤[16]。调节IL-6、IL-1β和肿瘤坏死因子(TNF)-α水平可改善肾脏损伤,对UAN起到保护作用[17]。PPAR-γ是一种转录因子,参与炎症反应和纤维化,PPAR-γ通路能调节内皮性一氧化氮合酶表达,保护缺血再灌注引起的急性肾损伤,减轻肾脏氧化应激、炎症和纤维化[18]。Awad等[19]发现,降低肾组织TP53表达可减缓肾脏纤维化,保护肾功能。Ye等[20]发现,调节PTGS2蛋白及mRNA表达可抑制炎症,从而减轻尿酸盐结晶引起的痛风性关节炎。
GO富集分析发现,土茯苓-车前子干预UAN的生物过程包括细胞因子介导的信号通路、基因表达的调控、炎症反应及细胞迁移等,分子功能主要涉及相同蛋白结合、丝氨酸型内肽酶活性及酶结合等。KEGG富集分析发现,AGE-RAGE、IL-17、TNF等信号通路排名靠前。AGE-RAGE/NF-κB通路激活与肾脏保护有关,且在肝脏与肾脏纤维化组织中更明显[21]。Li等[22]研究表明,激活IL-17信号通路可缓解白色念球菌诱导的BALB/c小鼠肾脏炎症。
综上,土茯苓-车前子可能通过调控IL6、TNF、PPARG、TP53、IL1B、PTGS2、NOS3等靶点及AGE-RAGE、IL-17、TNF等信号通路,影响肝、肾细胞生物活性,干预UAN。本研究为中医药治疗UAN提供理论依据,但网络药理学属于理论研究,一方面受限于数据库的时效性,另一方面需要更进一步的实验进行验证。

