基于网络药理学分析黄芪-附子治疗慢性心力衰竭的作用机制
李俊辉,李悦,朱灵妍,姚成增
1.上海中医药大学附属曙光医院,上海 200021;2.首都医科大学附属北京中医医院,北京 100010;3.上海市徐汇区中心医院,上海 200031
慢性心力衰竭(chronic heart failure,CHF)是多种原因引起心脏功能或结构异常,使心脏泵血量减少,不能满足组织器官代谢需求的临床综合征[1]。CHF是大多数心血管疾病的终末阶段,患病率和致死率逐年升高,给社会带来极大负担[2]。西医常用利尿剂、强心剂和β受体阻滞剂等改善CHF症状,但长期服药会出现不同程度的不良反应,整体疗效及安全性仍有待提高。中医药治疗CHF疗效确切、不良反应少,可明显改善患者症状,提高生活质量。中医认为,CHF病机为本虚标实,治疗应以温补阳气为主,兼活血、利水、行气[3],临床多用黄芪-附子等温补阳气药对为代表的方剂,疗效满意。但目前鲜有关于黄芪-附子治疗CHF机制的论述,本研究基于网络药理学方法分析黄芪-附子治疗CHF的潜在作用机制,以期为临床治疗CHF提供依据。
1 资料与方法
1.1 黄芪-附子活性成分筛选及靶点获取
在TCMSP(https://old.tcmsp-e.com/tcmsp.php)[4]数据库以“huangqi”“fuzi”为关键词进行检索,获取黄芪-附子活性成分,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为条件进一步筛选有效成分。通过TCMSP 数据库查询有效成分对应靶点,并导入UniProt(https://sparql.uniprot.org/)数据库对靶点名称进行标准化处理。
1.2 疾病靶点及交集靶点获取
在PharmGKB(https://www.pharmgkb.org/)[5]、TTD(http://db.idrblab.net/ttd/)、GeneCards(https://www.genecards.org/)[6]、OMIM(https://omim.org/)数据库以“chronic heart failure”为关键词检索CHF相关靶点,将疾病靶点与药物靶点取交集,交集靶点即黄芪-附子治疗CHF的潜在靶点。
1.3 蛋白相互作用网络构建
将交集靶点导入STRING(https://www.string-db.org/)[7]平台,绘制蛋白相互作用(PPI)网络,将PPI网络导入Cytoscape3.7.2软件进一步简化筛选,获取核心靶点网络。
1.4 GO功能和KEGG通路富集分析
利用R语言3.6.3软件相关数据包对交集靶点进行GO功能和KEGG富集分析,筛选qvalue<0.05的分析结果进行展示。
2 结果
2.1 药物活性成分与靶点
在TCMSP获取黄芪活性成分20个,附子活性成分21个,无共有成分。进一步获取活性成分对应的靶点,有19个活性成分无对应靶点,剩余22个活性成分(见表1)对应靶点492个,去除重复后得到靶点191个。将靶点导入UniProt数据库转化为UniProt ID,通过Cytoscape3.7.2 软件构建药物-活性成分-靶点网络(见图1),节点越大度值越大,节点间连线表示相互作用关系,活性成分平均度值为20.63,按度值由大到小排序,前10位活性成分见表2。

表2 黄芪-附子活性成分(度值前10位)
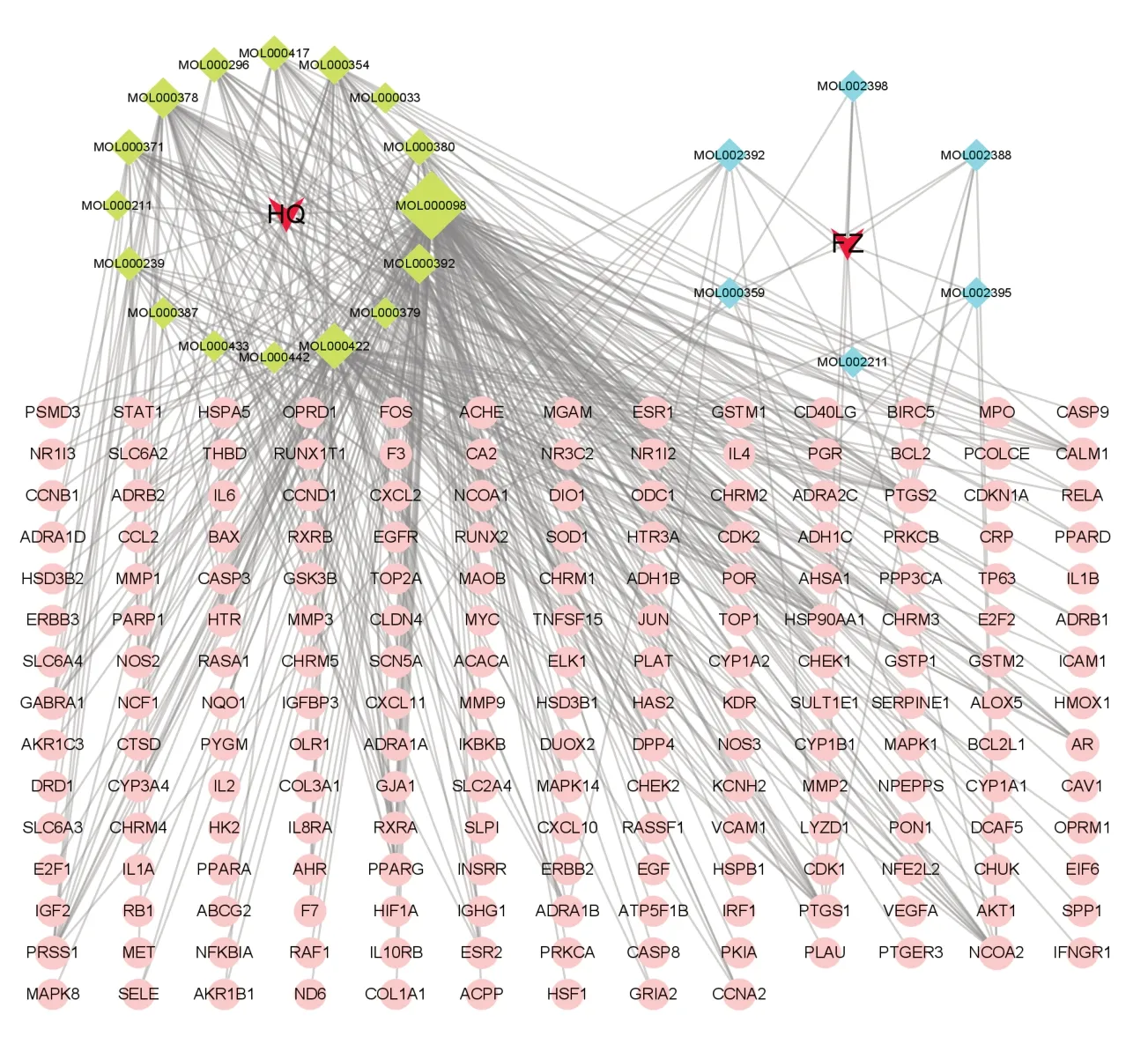
图1 黄芪-附子治疗CHF药物-活性成分-靶点网络

表1 黄芪-附子主要活性成分
2.2 疾病靶点及交集靶点
在PharmGKB、TTD、GeneCards、OMIM数据库分别得到CHF靶点16、13、10 531、153个,经去重后,共得到CHF相关靶点10 573个。利用Excel2016将疾病靶点和药物靶点取交集,得到交集靶点183个,Venn图见图2。
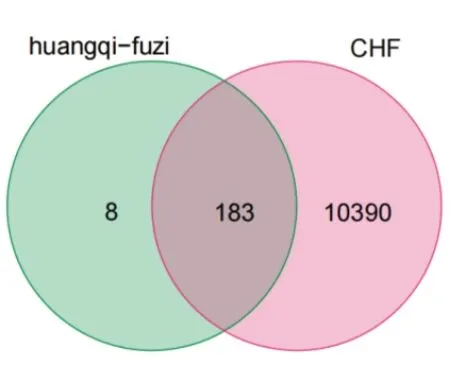
图2 黄芪-附子治疗CHF靶点Venn图
2.3 蛋白相互作用网络
将183个交集靶点导入STRING数据库,建立黄芪-附子治疗CHF 靶点PPI 网络,见图3。利用Cytoscape3.7.2软件对网络进行拓扑分析,筛选中介中心性(between centrality)≥19.565、紧密中心性(closeness centrality) ≥0.561、度中心性(degree centrality)≥10.5、特征向量中心性(eigenvector centrality)≥0.136、位置中心性(location centrality)≥4.558、邻域连通性(neighborhood connectivity)≥5.910的靶点,最终得到由14个核心靶点、108条边组成的核心靶点PPI网络,见图4。
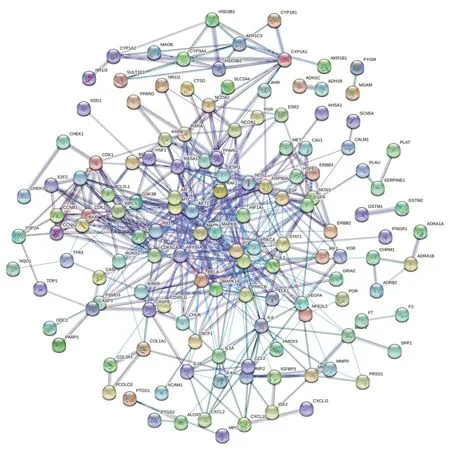
图3 黄芪-附子治疗CHF靶点PPI网络

图4 黄芪-附子治疗CHF核心靶点PPI网络
2.4 GO功能和KEGG通路富集分析结果
对交集靶点进行GO分析,得到2 625个条目,包括生物过程(BP)2 324 个、细胞组分(CC)88 个,分子功能(MF)213个,结果按qvalue从小到大排序,BP、CC、MF前10个条目见图5。BP主要涉及细胞对化学应激的反应(cellular response to chemical stress)、对药物的反应(response to drug)、对氧化应激的反应(response to oxidative stress)等;CC 主要涉及膜筏(membrane raft)、膜微区(membrane microdomain)、膜区(membrane region)等;MF主要涉及DNA/RNA转录因子活性、蛋白受体活性。KEGG通路富集分析筛选前30 条通路,主要包括AGE-RAGE 信号通路、PI3K-Akt信号通路、IL-17信号通路等,见图6。

图5 黄芪-附子治疗CHF靶点GO富集分析

图6 黄芪-附子治疗CHF靶点KEGG通路富集分析
3 讨论
现代医学认为,血脂、血糖、血压异常及吸烟、饮酒、饮食失节等不良生活习惯会影响或加快CHF进程,主要从增加心肌收缩力、抑制肾素-血管紧张素-醛固酮系统(RAAS)激活等角度治疗。古代文献有与CHF临床表现相似的描述,如《素问·举痛论篇》“劳则喘息汗出,外内皆越,故气耗矣”,《金匮要略》“心水者,其身重而少气,不得卧,烦而躁,其人阴肿”,《灵枢·胀论》“夫心胀者,烦心短气,卧不安”。CHF可属中医学“心水”“心胀”等范畴,病机为本虚标实,临床以气虚证为主。气虚无力推动血行而成瘀,故标实多以血瘀居多,治法多以温阳补气为主[8],兼以活血。黄芪性温,归脾、肺经,有补气升阳、行血通滞之功;附子性大热,归心、脾、肾经,有回阳救逆、补火助阳之功。二者相须使用则心气得温,心阳得补,心血得通,气虚之证得除。史君等[9]对近20年治疗CHF的方剂进行分析,结果显示,使用频率最高的中药为黄芪,附子排名第4位,可知黄芪-附子广泛应用于CHF治疗。
高血压、高血脂是心力衰竭的危险因素,心肌重构是心力衰竭发展的必然病理结果,炎症反应贯穿心力衰竭发生发展[10]。本文通过网络药理学方法,在TCMSP筛选黄芪-附子活性成分22个,在UniPort数据库获得相关靶点191个,药物-活性成分-靶点网络中度值较高的有槲皮素、 山柰酚、 7-Omethylisomucronulatol、异鼠李素、芒柄花素、3,9-di-O-methylnissolin、毛蕊异黄酮等。槲皮素、山柰酚、芒柄花素均为黄酮类化合物,槲皮素可通过多途径预防或延缓心力衰竭进程[11],通过抑制血管紧张素Ⅱ降低心肌纤维化和心肌肥大,从而改善心肌重构[12-13]。山柰酚可通过调节核因子E2相关因子、核因子-κB和PI3K/Akt/GSK-3β信号通路抑制心肌细胞凋亡,从而起到保护心脏作用[14]。芒柄花素可通过调节一氧化氮合成酶、5-羟色胺2A/1B受体和1-adrenoceptors表达降低血压[15],抑制脂肪生成[16]。此外,β-谷甾醇[17]、异鼠李素[18]、脱氧乌头碱[19]等活性成分也能从多角度发挥延缓心力衰竭的作用。黄芪-附子治疗CHF度值较高的有效成分,如槲皮素、山柰酚、芒柄花素等可关联到PPI网络中评分较高的靶点,并且可富集到与CHF有关的通路。因此,推测以槲皮素、山柰酚、芒柄花素为代表的活性成分可能在CHF治疗中发挥重要作用。
核心靶点PPI网络中共有14个靶点,其中AKT1是AKT家族的成员之一,有实验表明,敲除AKT1基因小鼠,其胎儿死亡率显著高于对照组[20],且存活小鼠心功能低于对照组。AKT1对心脏的影响主要表现为抑制心肌细胞凋亡,Kapustian等[21]研究表明,心力衰竭小鼠p-AKT1呈低表达,激活AKT1对CHF有一定治疗作用。MAPK14又称p38α,能被多种刺激因素激活,如白细胞介素(IL)-1、脂多糖、肿瘤坏死因子(TNF)-α、缺血、缺氧等[22-23],MAPK14激活会引起心肌细胞肥大、凋亡或收缩功能障碍,Kompa等[24]观察MAPK14抑制剂对心肌梗死小鼠心肌纤维化、心肌肥大的影响发现,MAPK14抑制剂能改善心功能,减少心肌梗死后心脏重构,防止其进一步发展为心力衰竭。IL-6是一种多功能的细胞因子,大部分研究表明,其在CHF发展过程中表现为促进炎症发展作用[25-26]。Kobara等[27]研究表明,给予心肌梗死后小鼠IL-6拮抗剂可以抑制炎症,改善左心室重构。KEGG通路富集分析主要集中在PI3K-Akt信号通路、AGE-RAGE信号通路、TNF信号通路,其中PI3K-Akt信号通路富集的基因最多。PI3K-Akt信号通路是生物体内关键的通路,通过激活细胞内各种信号蛋白表现其生物学功能,包括细胞凋亡、转移、分化、代谢、蛋白质合成、细胞运动及囊泡转移等[28-29],激活PI3Kα可促进TNF-β和miR-21表达,抑制心肌肥大[30],激活PI3Kγ会损害心功能,降低心肌收缩力[31]。PI3K-Akt信号通路的下游靶点mTOR、GSK3、FoxOs 等亦参与心力衰竭的过程,有研究表明,mTOR抑制剂可抑制转化生长因子-β诱导的心肌纤维化标志物α-平滑肌肌动蛋白表达[32],此外,RAGE能抑制PI3K-Akt信号通路,增加心肌细胞自噬,抑制RAGE对心肌细胞有保护作用[33]。由此推测,黄芪-附子治疗CHF可能与调控心肌细胞凋亡、改善心室重构有关,可能是以AKT1为靶点调控PI3KAkt信号通路改善心功能。
综上所述,黄芪-附子可能通过槲皮素、山柰酚、芒柄花素等活性成分,作用于AKT1、MAPK14等靶点,直接或间接调控PI3K-Akt、AGE-RAGE等多条信号通路,干预CHF的各个过程。体现了黄芪-附子通过多成分、多靶点、多通路治疗CHF的特点。

