工业煤气中H2S的湿法脱硫研究进展
张弦,刘刚,牛艳霞
(太原理工大学 化学化工学院,山西 太原 030024)
我国煤炭资源位居世界第三,是世界上最大的煤炭生产国和消费国。随着“一带一路”和“走出去”发展战略的实施,进一步拉动了焦炭、钢铁的需求量。根据国家统计局数据显示[1],2019年我国焦炭、生铁、粗钢的产量分别高达4.713亿t,8.094亿t,9.96亿t,而炼焦、炼钢、炼铁及生产铁合金时会副产大量工业煤气,按生产类别可将工业煤气分为焦炉煤气、高炉煤气、转炉煤气和铁合金煤气[2-4]。据统计,每生产1 t焦炭、生铁及钢,会副产400 m3焦炉煤气、1 500~1 600 m3高炉煤气[5]、60~110 m3转炉煤气[6],在2019年我国因炼焦、炼钢及炼铁产生的工业煤气高达14 438.6亿m3,工业上将这些煤气统称为工业煤气。
工业煤气成分较为复杂,除含有H2、甲烷、CO、CO2、O2、N2外,还含有少量杂质如H2S、CS2、硫醇、硫醚、噻吩等[7]。其中硫化物主要来源于煤中的有机硫和无机硫,如:硫化物、硫酸盐和单质硫,有机硫有二硫化物、硫醚、噻吩类杂环硫化物及硫醌化合物[8]。由于有机硫难以脱除,因此,先将有机硫通过加氢、水解等方法转化为H2S,然后再对H2S进行脱除[9]。
H2S是甲烷转化和甲醇合成过程中催化剂的永久性毒物;H2S的存在会降低钢材质量,腐蚀管道,燃烧后会产生SO2气体,污染环境,危害人们身体健康。其脱除技术一直是国内外研究的热点,近年来也有新的脱硫技术被提出,依据H2S的还原性和弱酸性,将脱硫方法分为两大类:干法脱硫和湿法脱硫[10]。本文主要对湿法脱硫进行综述。
1 湿法脱硫
湿法脱硫技术是以溶液或溶剂为吸收剂,使气液充分接触,将H2S气体转移至液相,使气体得到净化。湿法脱硫技术具有吸收剂可再生循环利用,操作性好,适用于处理硫化氢含量较高的气体、投资操作费用低等优点。根据吸收剂的不同,可将湿法脱硫分为液体吸收法和湿式催化氧化法,其具体分类见图1。

图1 湿法脱硫技术的分类Fig.1 Classification of wet desulfurization techniques
1.1 液体吸收法
国内外常用的吸收法有物理吸收法、化学吸收法及离子液体吸收法等。见表1。

表1 含H2S废气净化的液体吸收法脱硫技术Table 1 Liquid absorption desulfurization technology for purification of waste gas containing H2S
液体吸收法吸收能力大,选择性好,净化程度高,被广泛应用于工业煤气的净化,其中常用的有低温甲醇法、二乙醇胺法、氢氧化钠吸收法。这些方法在实际应用具有各自的优缺点。低温甲醇法在脱除H2S的同时还能脱除有机硫、CO2、HCN以及粗汽油、芳香烃等组分,操作条件常在-70~-30 ℃。相较于其他吸收剂,甲醇选择性好,对CO2、H2S及有机硫等物质的溶解度大。当温度为-40 ℃时,CO2在甲醇中的溶解度最大;当温度为-50~-40 ℃ 时,H2S在甲醇中的溶解度是CO2的6倍,可以选择性地从原料气中脱除H2S[25]。甲醇的沸点为64.7 ℃,再生容易且再生温度低。甲醇还具有较高的热稳定性和化学稳定性,不会被有机物、氰化物等杂质降解,在吸收过程中不起泡且不会腐蚀设备[25]。但该技术在实际操作中也存在一定的制约和不足,若再生塔效果不好,会使H2S释放不完全,导致循环甲醇中的H2S含量升高,脱硫率下降,进而导致总硫超标[26];该工艺还存在保冷效果差,再生塔容易沉积污垢等问题,这些问题既降低了脱硫率还给操作和维修增加了难度。
在工业上,最具代表性的化学吸收法是醇胺法,主要包括乙醇胺法和二异丙醇胺法,被广泛应用于天然气和炼厂气的净化。醇胺化合物中至少含有一个胺基或一个羟基,胺基可使醇胺化合物的水溶液呈碱性;羟基增加了化学溶剂在溶液中的溶解度,降低蒸汽压[15]。在醇胺溶液中,一乙醇胺碱性最强,化学反应活性最好,但一乙醇胺化学分子量小,性质不稳定,脱硫过程中会与CO2发生副反应,并能与COS和CS2发生可逆反应,造成溶剂浪费,生成的固体副产物积累在溶液中,降低脱硫效率。除此之外一乙醇胺再生时温度要求较高,大约为125 ℃,会使再生系统严重腐蚀[27]。二异丙醇胺对H2S具有较高的选择性,在脱除硫化氢的同时还能有效脱除羰基硫。此外,以二异丙醇胺为脱硫剂可以降低能耗,提高经济效益。但该溶液黏度较大且易发泡,设备换热效果差,操作时要控制溶液浓度在30%以下[28]。相较于一乙醇胺、二异丙醇胺,甲基二乙醇胺具有能耗低、化学稳定性和热稳定性好、抗降解能力强、对H2S的吸收具有选择性强等优点[16]。仅使用甲基二乙醇胺脱除硫化氢效果并不理想,因此工业上常将甲基二乙醇胺与其他碱性试剂混合来提高脱硫效率。Usman等[29]通过对各种新型水胺和非水胺(单乙二醇/三乙二醇)脱除硫化氢的研究,发现混合溶液中羟基和乙氧基增多,提高了脱硫效率。
近年来,采用氢氧化钠吸收H2S制取硫化钠技术受到行业的关注,原因主要是生成的产物硫化钠用途广泛,利润空间大[18]。本质上,该工艺酸碱反应机理简单、反应速度快,但是H2S与NaOH反应产物不止有Na2S还有NaHS,所以要想获得纯度较高的单一产品,必须严格控制H2S与NaOH之间的比值;其次,工业煤气中除H2S外,还有其他酸性气体如CO2、HCN等,在用NaOH溶液吸收的同时也会产生NaCO3、NaHCO3及NaCN等产物,所以该法的应用条件严苛,具有一定的局限性。工业上,用NaOH溶液吸收质量浓度为2 049.21 mg/m3的H2S时,将气体停留时间保持10.20 s,吸收温度<80 ℃,吸收塔塔内负压控制在2.6×103~6.6×103Pa,氢氧化钠起始浓度为380~420 g/L,当反应结束后,硫化钠浓度达到330~350 g/L[18]。
1.2 湿式催化氧化法
湿式催化氧化法是利用碱性溶液(NaCO3、氨等)吸收硫化氢,将硫化氢中的硫元素转化为S2-或HS-,再经催化剂(络合铁、钒物质、酞菁钴、对苯二酚、栲胶、杂多酸、锰化合物等)将S2-或HS-转化为单质硫(S)。然后催化剂通过氧气氧化再生。根据催化剂不同,湿式催化氧化法可分为砷基工艺、铁基工艺[30]、钒基工艺[31-33]、PDS法[34-37]、DDS法[36]、杂多酸法[38-41]、HPF法[42]等。
砷基工艺是以含砷的碱性溶液为吸收剂脱除H2S,在50年代被广泛应用,但由于砷是剧毒物质,该工艺已被其他工艺所取代。钒基工艺是20世纪50年代由英国公司开发[43],简称ADA法,该法的催化剂是五价钒,还原态钒的再生氧载体是ADA,但该法硫颗粒回收困难,容易堵塞。针对这一问题,在ADA法的基础上进行了改进:将酒石酸钠或钾添加在洗液中防止盐类生成,这一工艺称为改良ADA法;之后我国又自主研发了栲胶法并工业化,以醌态的栲胶氧化还原态钒,栲胶变为还原态,然后通过氧气使栲胶得以再生。络合铁法是铁基工艺中最典型的脱硫方法,以络合态的Fe3+为脱硫剂。因为在碱性溶液中铁离子不稳定,容易生成沉淀,所以必须选择合适的配体防止Fe3+与Fe2+生成沉淀,对于络合铁法的改良也有很多。如:福州大学开发的FD法[44]以氨水为吸收液,以磺酸基水杨酸作为铁离子的配体;华东理工大学开发的TEA法[45],将三乙醇胺(TEA)作为Fe3+的络合剂,将柠檬酸作为Fe2+的络合剂。目前络合铁法的改良大多集中于避免络合物的降解以及维持络合物的稳定性[46]。杂多酸法脱硫主要是以磷钼杂多化合物为吸收剂脱除硫化氢,杂多酸中的Mo(Ⅵ)被还原为Mo(Ⅴ)[38],杂多酸被还原为杂多蓝,然后杂多蓝通过Fe3+、Cl2和NO2再生[41]。杂多酸性质稳定,具有独特的催化活性和氧化还原性,脱硫效率高且硫磺回收率达95%以上[41]。但杂多酸再生速度缓慢,需要选择合适的催化剂,如钒酸盐类化合物能加快杂多酸在空气中的再生[40],该法主要面向天然气的净化但未见工业应用。目前,常用的湿式催化氧化法见表2。
在我国现有的1 000多个焦化厂中,采用较多的脱硫方法是湿式催化氧化法,尤以PDS法、HPF法及络合铁法多见。栲胶法和DDS法多见于化肥工业。分析表2中各工艺的反应机理可以发现,湿式催化氧化法脱硫的本质就是将气相中的硫化氢在氧气的作用下生成稳定的单质硫和水的反应过程,脱硫系统中的其他物质均可循环再生。实际工艺中,这几种脱硫工艺操作条件也相似,在不改变设备的基础上,几种工艺可以相互替代。原理上看,湿式催化氧化脱硫方法环保、消耗量少、产物无污染。但是事实上,该法需要每天投加一定量的脱硫原料、定期排放一定量的脱硫废液、产生的单质硫由于纯度低而无价值或是价值非常低。脱硫废液和纯度不高的硫膏处理成了焦化企业当前棘手的问题,同时也是制约湿式催化氧化脱硫法进一步发展的障碍。
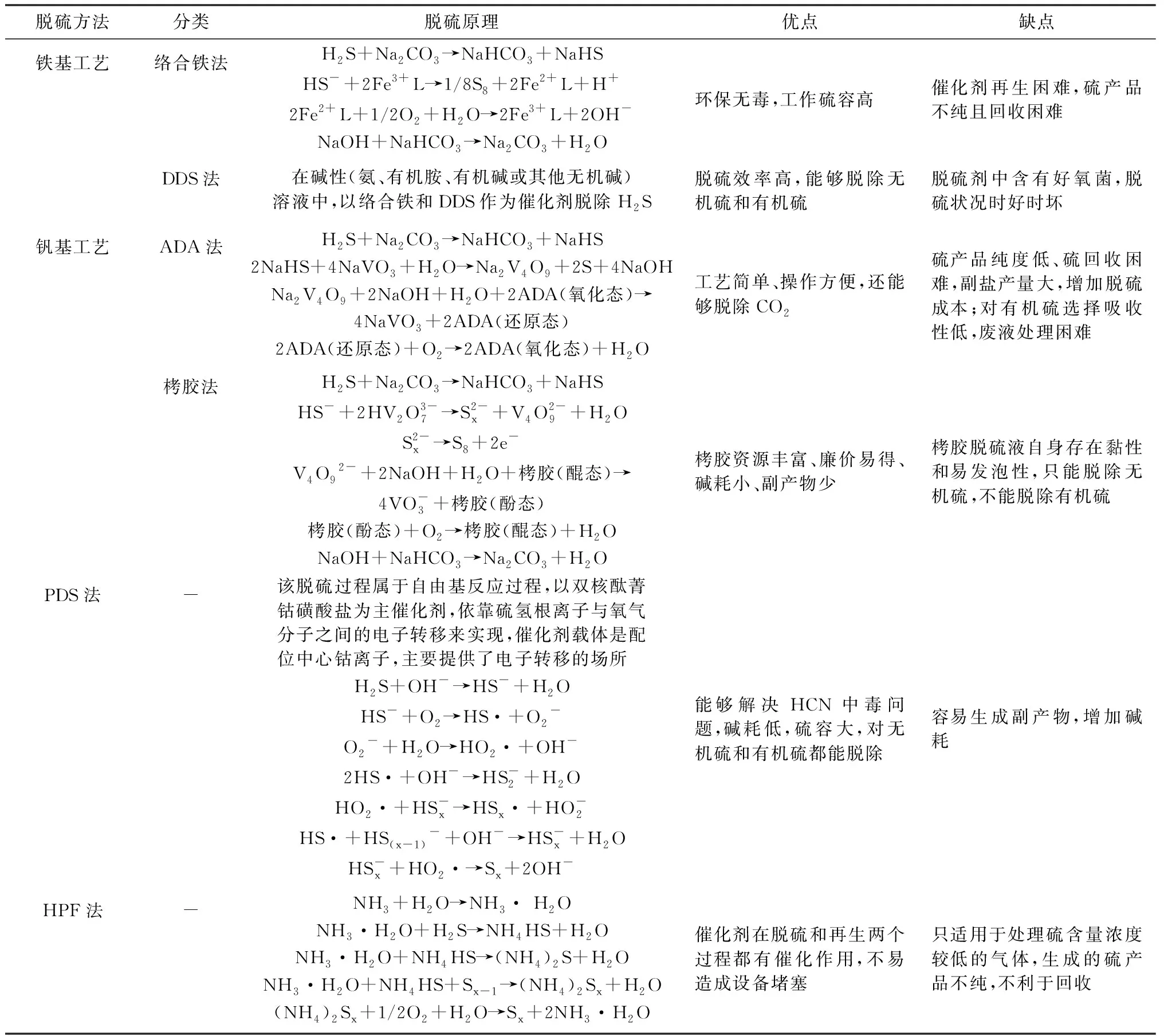
表2 常用的含H2S废气净化的湿式催化氧化法脱硫技术Table 2 The commonly used wet catalysis and oxidation desulfurization technology for H2S
近年来,本课题组对湿式催化氧化法脱硫中的硫迁移规律进行了较详细的研究,结果发现脱硫体系中存在图2的硫转化关系。
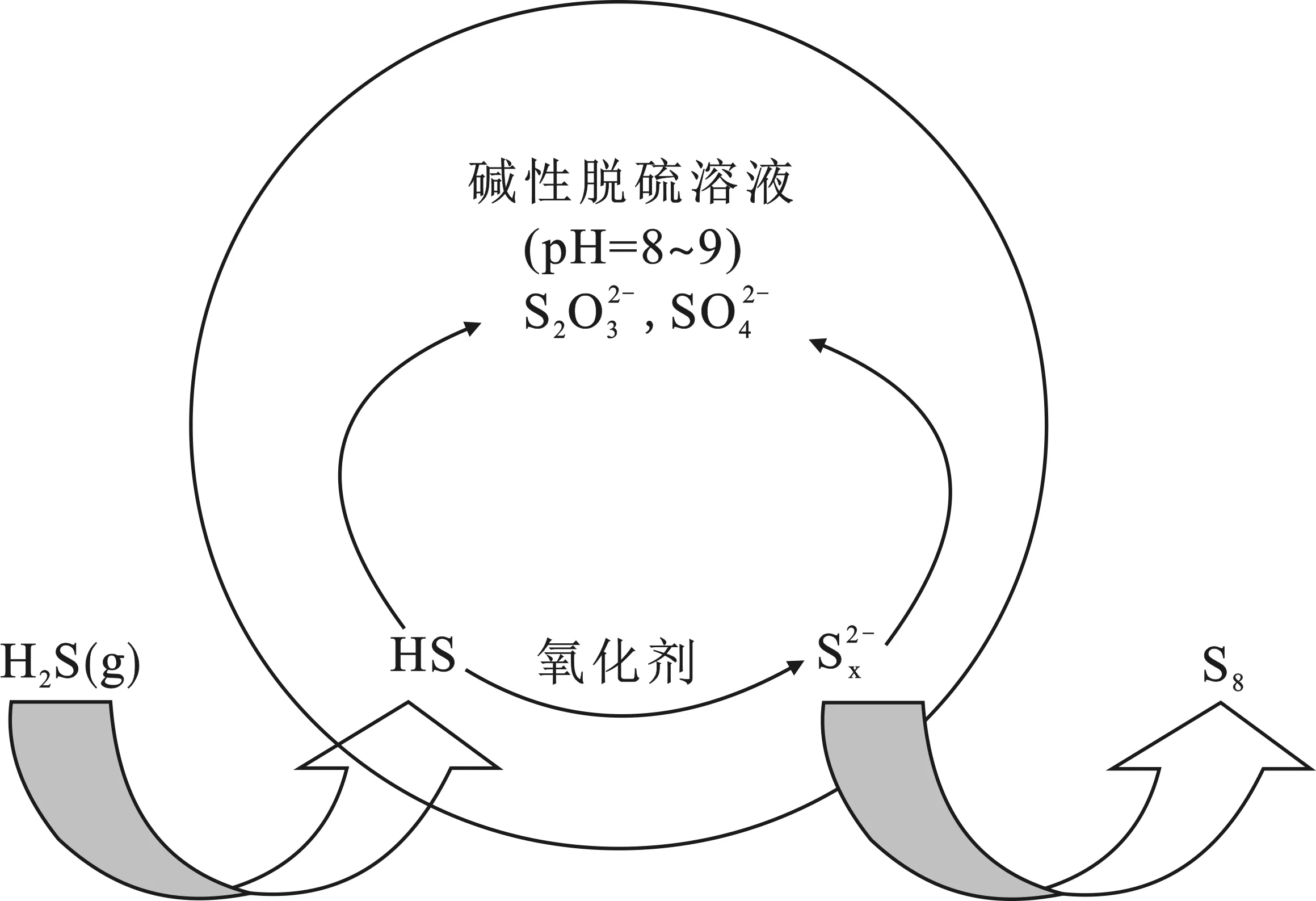
图2 湿式催化氧化脱硫体系中硫物质间的转化关系Fig.2 The relationship between sulfur substances in wet catalysis and oxidation desulfurization system
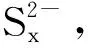
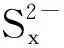
对于硫膏处理问题,目前行业中普遍采用熔硫釜装置,经熔硫处理后的单质硫纯度可以达到80%以上,但目前市场价格仅为几十元每吨,这与高耗能的熔硫装置极不协调。本课题组研究发现甲苯是单质硫提取的优良溶剂[47],其优点在于:①单质硫在甲苯中溶解度随温度变化显著,室温时溶解度为24.04 g/(L·K),而在99 ℃时为232.68 g/(L·K),溶解度差值较大,这一特性可将单质硫从硫膏中更多地提取出来;②低温时,单质硫在甲苯中的溶解度较小,因而无需对甲苯作进一步处理便可重复利用;③甲苯本身是焦化厂副产品,原料易得。硫膏经甲苯提取后纯度达95%以上。目前我国对于高纯度硫磺仍依赖于进口,因此对硫膏进行高纯度硫磺的制备仍值得探索。
建立在副盐处理和高纯度硫磺制备基础上的湿式催化氧化脱硫技术将会更具有竞争力。
1.3 其他脱硫方法
除了以上脱硫方法,近年来人们也不断开发新型脱硫技术,如等离子体降解法脱除H2S[52]。等离子体是一种呈宏观中性的电离气体,含有等量的正离子和电子,是良好的导电体,因受磁场的影响而与普通气体不同,是自然环境中除气、液、固广泛存在的第四种物质。由于其具有反应性高和选择性好等特点,被广泛应用于材料处理、燃料转化、废气降解等领域,尤其在脱除H2S废气取得了很大进展。
等离子体降解H2S的机理有两方面:①由于电子雪崩,等离子体会产生大量高能电子,若这些电子的能量高于S—H化学键的键能,这些电子就会与H2S分子直接作用,使H2S分子降解;②高能电子可以与O2、H2O、N2等气体作用,使这些气体分子被击穿活化产生高活性的·O、·OH、·N等自由基物质,这些物质与H2S分子反应,从而使H2S气体降解。
为了提高等离子体的脱硫效率,杨建涛等[53]采用低温等离子体活性炭纤维吸附两段式来提高脱硫率,该法是让H2S在低温等离子体反应器中降解,然后在活性炭纤维吸附器中吸附未降解的H2S。既能提高脱硫率也能使副产物(O3、SO2)再利用。
Narendranath等[54]使用间接电解法净化H2S生成单质硫和氢气也是一种新型的脱硫技术。采用间接电解法的原因是因为直接电解容易使阳极钝化,且间接电解耗能较低。间接电解法是先用碱性溶液(NaOH、KOH)吸收硫化氢,生成NaHS,再用间接电解法电解NaHS,生成单质硫和氢气。在包含阳极(石墨),阴极(石墨)和离子交换膜的两室电解槽中进行NaHS的电解,以NaOH和NaHS的等摩尔溶液作为阳极电解液,以NaOH(1 mol/L)作为阴极电解液。电解过程中,水从阳极到阴极隔着膜迁移,硫的形成导致阳离子(Na+)从阳极室穿过膜迁移到阴极室,以保持电荷中性。其脱硫原理如下。
H2S+NaOH = NaHS+H2O
阳极反应
NaHS+OH-→S+H2O+Na++e-
S2-→S+2e-
阴极反应
Na++H2O+e-→1/2H2+NaOH
通过测定不同条件(浓度、pH、温度)下硫回收的情况,发现当操作温度为80 ℃,pH为13,阳极电解液为4 mol/L的NaOH和NaHS时,回收硫最多(91.00%),脱硫率达到90.44%。目前该技术仍处于实验研究阶段。
2 结束语


