温阳益气活血方对慢性心力衰竭大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶的影响
吕李飞 ,魏孝钦 ,王梦歌 ,张贤儒 ,马晓贞 ,多杰卓玛 ,贾守宁 ,祁永福
1.青海大学,青海省糖脂代谢疾病防控中医药重点实验室,青海 西宁 810016;2.青海省中医院,青海 西宁 810012
慢性心力衰竭(chronic heart failure,CHF)是多种心脏疾病发展的终末阶段,具有较高的发病率和病死率,目前常规西药如沙库巴曲缬沙坦钠片、维利西呱,虽可稳定病情,但多数患者预后仍未达预期[1]。中医治疗慢性心系疾病经验颇丰,根据临床主要症状,CHF属中医学“心水”“怔忡”范畴,其基本病机为本虚标实,本虚为心之气血阴阳虚衰,脏腑功能失调,标实为痰浊、水饮、气滞、血瘀[2]。心气虚是病理基础,血瘀是中枢环节,水湿和痰饮是主要病理产物。基于此,治当温阳益气活血。温阳益气活血方由青海省中医院多位名老中医专家据芪附汤、桃仁红花煎等古方化裁拟定,全方有温阳益气、活血化瘀之功。前期研究显示,温阳益气活血方可通过Toll样受体/核因子κB信号通路、AMPK信号通路及Th17细胞分化等途径干预CHF,关键作用靶点有SMAD7、MYC、PCNA等[3]。
Na+-K+-ATP酶、Ca2+-ATP酶主要位于心肌细胞膜和线粒体膜上,二者表达水平可反映心肌细胞功能的完整性。当CHF发生时,心肌纤维过度收缩,打破心肌细胞内正常的氧化还原状态,引发物质与能量代谢异常,最终造成机体稳态失衡。因此,整合ATP酶表达与CHF病理变化的复杂调控网络,能发现并阐明CHF发病的能量代谢机制。本研究以CHF模型大鼠为研究对象,观察温阳益气活血方对模型大鼠心肌Na+-K+-ATP酶、Ca2+-ATP酶表达的影响,从能量代谢角度阐释其治疗CHF的作用机制,为中医治疗CHF提供实验依据。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠90只,6周龄,体质量(200±20)g,西安交通大学医学部实验动物中心提供,动物生产许可证号SCXK(陕)2018-001。饲养于青海大学医学院动物房,动物使用许可证号SYXK(青)2020-0001,温度23~25 ℃,湿度55%~70%,12 h光暗循环,适应性饲养1周后开始实验。本实验经青海省中医院伦理委员会审批(qhszyy1103201901)。
1.2 药物
温阳益气活血方(人参15 g,黄芪20 g,桂枝10 g,附子10 g,熟地黄12 g,当归 10g,白芍15 g,赤芍16 g,川芎10 g,桃仁10 g,红花10 g),饮片颗粒购于青海省中医院,按原药材用量计算后将颗粒混匀,加入纯净水溶解,配制成浓度分别为0.81、0.405、0.202 5 g/mL混悬液。盐酸异丙肾上腺素,上海源叶生物科技有限公司,货号S31064。卡托普利片,山西津华晖星制药有限公司,25 mg/片,批号200120。氢氯噻嗪片,天津力生制药有限公司,25 mg/片,批号2005008。螺内酯片,国药集团武汉中联四药药业有限公司,20 mg/片,批号200904。
1.3 主要试剂与仪器
大鼠脑钠肽(BNP)ELISA试剂盒(货号E-ELR0126c)、Na+-K+-ATP酶比色法试剂盒(货号E-BCK539-M)、Ca2+-ATP酶比色法试剂盒(货号E-BCK212-M),武汉伊莱瑞特生物科技有限公司;Servicebio®RT第一链cDNA合成试剂盒(货号G3330)、2×SYBR Green qPCR Master Mix(High ROX)(货号G3322)、Ca2+-ATP酶兔多克隆抗体(货号GB112371)、Na+-K+-ATP酶兔多克隆抗体(货号GB11400-1),武汉赛维尔生物科技有限公司;异氟烷(货号R510-22),瑞沃德生命科技有限公司。
Thermomixer C恒温混匀仪,德国艾本德股份公司;QL901漩涡振荡器,海门其林贝尔有限公司;ECLIPSE Ci-L正置白光拍照显微镜、E100显微镜、Nikon DS-U3成像系统,日本尼康公司;Pannoramic DESK全景切片扫描仪,匈牙利3DHISTECH公司;ZS3 Exp型小动物彩色多普勒超声仪,中国迈瑞公司;Illumina HiSeq/MiSeq PE250测序仪,美国因美纳公司;Chemray 800全自动生化分析仪,深圳雷杜生命科技有限公司;StepOne Plus荧光定量PCR仪、NanoDrop2000超微量分光光度计,赛默飞科技有限公司;H1650-W台式微量高速离心机,湖南湘仪实验室仪器开发有限公司;Epoch多功能酶标仪,美国伯腾仪器有限公司;R500IE小动物麻醉机,瑞沃德生命科技有限公司。
1.4 造模
90只大鼠按随机数字表法分为空白组15只、实验组75只,实验组采用4 mg/mL异丙肾上腺素皮下多点注射10 mg/kg诱导CHF模型,空白组注射等量生理盐水,连续14 d。造模期间观察并记录大鼠一般情况。造模结束后次日对所有大鼠行超声检测,检测前禁食水12 h,参考文献[4-5]标准,左室射血分数(LVEF)<60%表明CHF模型造模成功。
1.5 分组及干预
剔除死亡及未成模大鼠5只,将70只成模大鼠随机分为模型组、西药组和温阳益气活血方低、中、高剂量组(中药低、中、高剂量组),每组14只。参照人与动物体表面积折算的等效剂量换算大鼠给药量,中药高、中、低剂量组分别予温阳益气活血方混悬液8.1、4.05、2.025 g/kg灌胃(相当于临床成人用药剂量的2、1、1/2倍),西药组予卡托普利片5.3 mg/kg+氢氯噻嗪片2.6 mg/kg+螺内酯片2.6 mg/kg灌胃,空白组和模型组予等量生理盐水,灌胃体积10 mL/kg,每日1次,连续6周。
1.6 一般状况观察
实验过程中观察大鼠毛色、精神及饮食情况。
不一会儿周所长来到,陪着秦明月在广场转了一圈,秦明月说:“到达火车站共有三种方式,一是搭乘私家车或者租车;二是打的;三是乘公交车从广场东面步行过来。”
1.7 心脏超声检查
造模及给药结束后,脱毛膏去除大鼠左胸部毛发,异氟烷麻醉,彩色多普勒超声仪测量LVEF、左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD),连续测量3个心动周期,取平均值,计算左室短轴缩短率(LVFS)。LVFS(%)=(LVEDD-LVESD)÷LVEDD×100%。实验由同一名影像医师完成,操作过程中遵循盲法原则。
1.8 血清脑钠肽检测
末次给药后禁食不禁水12 h,次日20%乌来糖0.8 mL/100 g腹腔注射麻醉大鼠,仰卧固定于手术台上,腹主动脉采血,常温静置2 h,4 000 r/min离心10 min,取上层血清,按ELISA试剂盒操作步骤检测BNP含量。
1.9 心脏质量指数计算
末次给药前称量大鼠体质量,腹主动脉采血后分离大鼠心脏,预冷生理盐水冲洗,无菌纱布吸干水分,称量心脏质量,计算心脏质量指数(HMI,心脏质量/体质量)。
1.10 HE染色
取心肌组织,生理盐水冲洗,置于4%多聚甲醛溶液中固定,修剪,脱水,浸蜡,包埋,切片,行HE染色,封片,显微镜下观察心肌组织病理改变。
1.11 Na+-K+-ATP酶、Ca2+-ATP酶活性检测
取心肌组织,按质量/体积比为1∶9加入预冷生理盐水,充分匀浆,调整样本检测浓度,采用比色法试剂盒检测心肌Na+-K+-ATP酶、Ca2+-ATP酶活性,严格按试剂盒说明书操作。
1.12 RT-PCR检测
取心肌组织0.1 g,充分剪碎后置于匀浆管,加入Trizol,研磨仪充分研磨,12 000 r/min离心10 min,吸取上清液,加入250 μL三氯甲烷,颠倒混匀后,常温静置3 min,12 000 r/min离心10 min,吸取400 μL上清液置新EP管中,加入0.8倍体积异丙醇混匀,-20 ℃静置15 min,4 ℃、12 000 r/min离心10 min,用75%乙醇洗涤沉淀,4 ℃、12 000 r/min离心5 min,弃去上清液,沉淀干燥后,加入无酶水15 μL,55 ℃孵育5 min,采用NanoDrop2000超微量分光光度计测定RNA浓度及纯度。根据Servicebio®RT Enzyme Mix试剂盒说明书将RNA进行反转录合成cDNA,按2×SYBR Green qPCR Master Mix试剂盒说明书配制反应体系。反应条件:95 ℃预变性 10 min,95 ℃、15 s→60 ℃、30 s,共40个循环。采用2-ΔΔCt法计算目的基因相对表达量。引物由武汉赛维尔生物科技有限公司合成,引物序列见表1。

表1 各基因PCR引物序列
1.13 免疫组织染色
心脏组织修剪后石蜡包埋,制成3 μm切片,60 ℃烘烤2 h,经二甲苯Ⅰ、二甲苯Ⅱ脱蜡及梯度酒精水化,热修复抗原,3%H2O2阻断内源性过氧化物酶,血清封闭后,加Na+-K+-ATP酶、Ca2+-ATP酶一抗(1∶1 000),湿盒内4 ℃孵育过夜。加入二抗,室温孵育50 min,DAB显色,苏木素复染3 min,脱水封片。显微镜下观察,以棕黄色颗粒为阳性表达,采用Aipathwell软件分析细胞阳性表达率(阳性细胞数÷细胞总数×100%)。
1.14 统计学方法
采用SPSS17.0统计软件进行分析。符合正态分布数据以表示,两组间比较采用独立样本t检验,方差不齐用校正t检验;多组间比较采用单因素方差分析,方差齐用LSD法,方差不齐用Tamhane” s T2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 温阳益气活血方对模型大鼠一般状况的影响
模型组大鼠扎堆,活动少,体质量减轻,食少,毛发凌乱、黄脆易掉,胞睑下垂,无神呆滞,舌色瘀点,唇黯爪青,阴囊脱出,尿少,超声备皮前可见颈部青筋暴露,抓捕时易见甲掉出血,甚则全胸部触之如石、满胸积液,以上症状与CHF相符[6]。相应药物干预后,西药组及中药各剂量组大鼠一般情况均较模型组减轻,脱毛症状缓解,体质量、饮食量和活动量增加,中药高剂量组毛色光泽度优于其他给药组。
2.2 温阳益气活血方对模型大鼠心脏超声指标的影响
与空白组比较,模型组大鼠LVEF、LVFS显著降低(P<0.01);与模型组比较,西药组和中药各剂量组大鼠LVEF、LVFS显著升高(P<0.01);与西药组比较,中药高剂量组大鼠LVEF、LVFS显著升高(P<0.05)。见表2。
表2 各组大鼠心脏超声指标比较(,%)
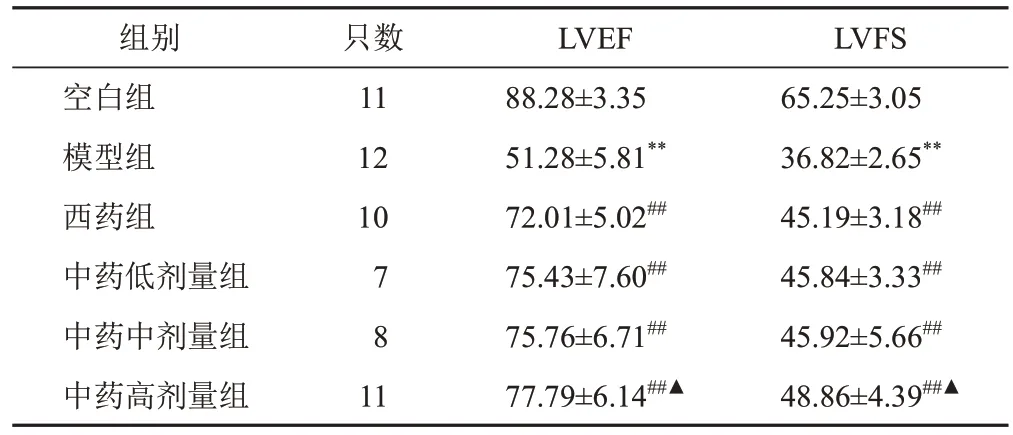
表2 各组大鼠心脏超声指标比较(,%)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与西药组比较,▲P<0.05
LVFS 65.25±3.05 36.82±2.65**45.19±3.18##45.84±3.33##45.92±5.66##48.86±4.39##▲组别空白组模型组西药组中药低剂量组中药中剂量组中药高剂量组只数11 12 10 7 8 1 1 LVEF 88.28±3.35 51.28±5.81**72.01±5.02##75.43±7.60##75.76±6.71##77.79±6.14##▲
2.3 温阳益气活血方对模型大鼠血清脑钠肽含量的影响
与空白组比较,模型组大鼠血清BNP含量显著增加(P<0.01);与模型组比较,西药组和中药高剂量组大鼠血清BNP含量显著减少(P<0.05);与中药高剂量组比较,中药低、中剂量组BNP含量显著增加(P<0.01)。中药高剂量组与西药组比较差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠血清BNP含量比较(,pg/mL)
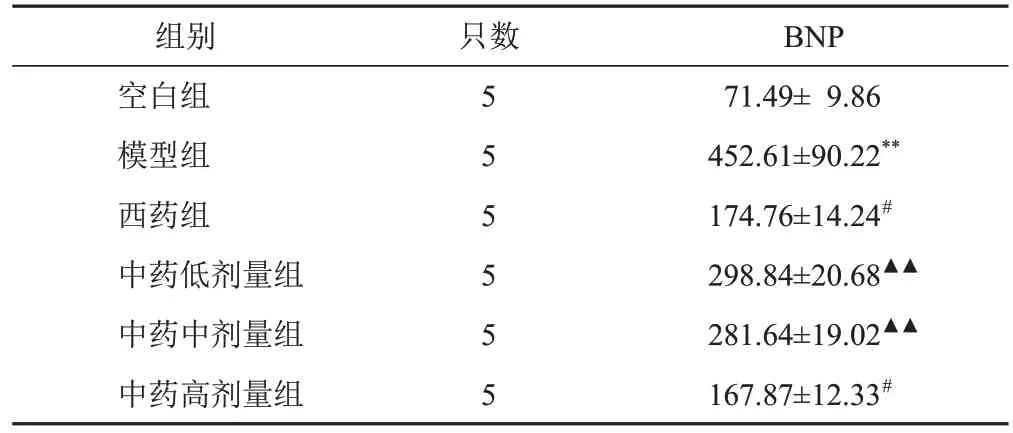
表3 各组大鼠血清BNP含量比较(,pg/mL)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05;与中药高剂量组比较,▲▲P<0.01
BNP 71.49± 9.86 452.61±90.22**174.76±14.24#298.84±20.68▲▲281.64±19.02▲▲167.87±12.33#组别空白组模型组西药组中药低剂量组中药中剂量组中药高剂量组只数5 5 5 5 5 5
2.4 温阳益气活血方对模型大鼠心脏质量指数的影响
与空白组比较,模型组大鼠HMI显著升高(P<0.01);与模型组比较,西药组及中药各剂量组大鼠HMI显著降低(P<0.01),中药高剂量组大鼠HMI降低最明显(P<0.01);与西药组比较,中药低、中剂量组大鼠HMI显著升高(P<0.01)。见表4。
表4 各组大鼠HMI比较(,mg/g)

表4 各组大鼠HMI比较(,mg/g)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与西药组比较,△△P<0.01;与中药高剂量组比较,▲▲P<0.01
HMI 2.26±0.12 2.84±0.09**2.37±0.03##2.72±0.10##△△▲▲2.65±0.07##△△▲▲2.36±0.03##组别空白组模型组西药组中药低剂量组中药中剂量组中药高剂量组只数11 12 10 7 8 1 1
2.5 温阳益气活血方对模型大鼠心肌组织病理变化的影响
空白组大鼠心肌纤维结构正常、分界清晰、排列规则,间质未见明显异常,无炎症浸润;模型组大鼠心肌组织大量纤维水肿,胞质疏松淡染,少量心肌细胞空泡变性,胞质内可见微小圆形空泡,组织边缘可见心肌纤维溶解,被增生的结缔组织取代,伴有少量淋巴细胞浸润;西药组可见少量心肌细胞空泡变性,胞质内有微小圆形空泡,心肌细胞肿胀,胞质疏松淡染,间质伴有少量结缔组织增生,并可见少量血管淤血扩张;中药各剂量组大鼠心肌细胞空泡变性减少,胞质内可见微小圆形空泡,纤维水肿、胞质疏松、炎症浸润及纤维溶解程度较模型组有所改善,以中药高剂量组改善最明显。见图1。

图1 各组大鼠心肌组织形态(HE染色,×200)
2.6 温阳益气活血方对模型大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶活性的影响
与空白组比较,模型组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶活性显著降低(P<0.01);与模型组比较,西药组和中药各剂量组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶活性显著升高(P<0.01)。见表5。
表5 各组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶活性比较()

表5 各组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶活性比较()
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01
组别Ca2+-ATP酶/(U/kg)只数Na+-K+-ATP酶/(μmol/mg)空白组模型组西药组中药低剂量组中药中剂量组中药高剂量组74.32±0.84 41.47±2.68**60.68±1.93##54.00±3.16##55.95±3.01##60.96±3.83##3 3 3 3 3 3 72.09±1.28 43.70±4.60**60.40±2.55##54.28±2.51##57.90±5.03##62.91±3.37##
2.7 温阳益气活血方对模型大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶mRNA表达的影响
与空白组比较,模型组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶mRNA表达显著降低(P<0.01);与模型组比较,西药组和中药中、高剂量组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶mRNA表达显著升高(P<0.01)。见表6。
表6 各组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶mRNA表达比较()
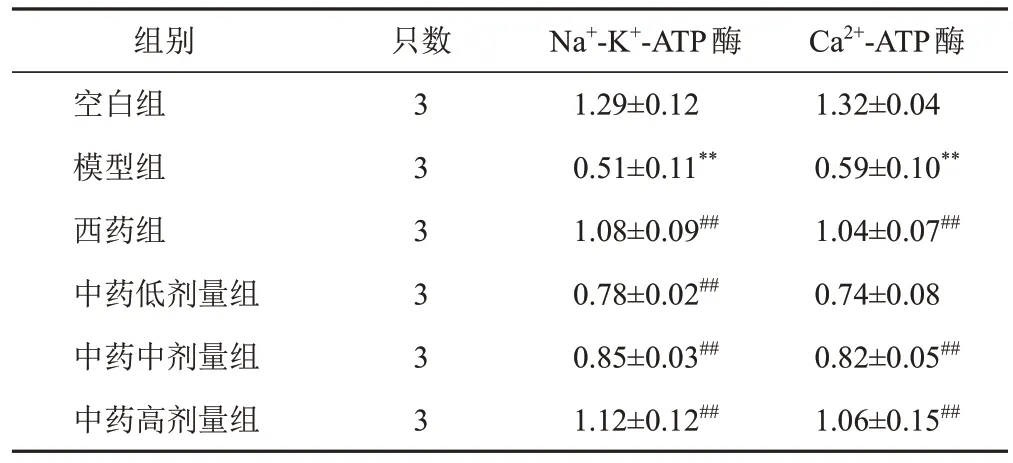
表6 各组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶mRNA表达比较()
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01
Ca2+-ATP酶1.32±0.04 0.59±0.10**1.04±0.07##0.74±0.08 0.82±0.05##1.06±0.15##组别空白组模型组西药组中药低剂量组中药中剂量组中药高剂量组只数3 3 3 3 3 3 Na+-K+-ATP酶1.29±0.12 0.51±0.11**1.08±0.09##0.78±0.02##0.85±0.03##1.12±0.12##
2.8 温阳益气活血方对模型大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶蛋白表达的影响
与空白组比较,模型组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶阳性表达显著降低(P<0.01);与模型组比较,西药组和中药各剂量组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶阳性表达显著升高(P<0.01)。见表7、图2、图3。

图2 各组大鼠心肌组织Na+-K+-ATP酶阳性表达(免疫组化染色)

图3 各组大鼠心肌组织Ca2+-ATP酶阳性表达(免疫组化染色)
表7 各组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶阳性表达比较(,%)

表7 各组大鼠心肌组织Na+-K+-ATP酶、Ca2+-ATP酶阳性表达比较(,%)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01
Ca2+-ATP酶0.96±0.03 0.37±0.07**0.76±0.08##0.54±0.06##0.65±0.02##0.81±0.06##组别空白组模型组西药组中药低剂量组中药中剂量组中药高剂量组只数3 3 3 3 3 3 Na+-K+-ATP酶0.89±0.04 0.30±0.03**0.69±0.04##0.49±0.05##0.63±0.04##0.75±0.03##
3 讨论
本实验采用皮下注射异丙肾上腺素制备CHF模型,可以模拟CHF神经过度激活,造模方法简便价廉,但由于异丙肾上腺素注射后对心脏产生严重的毒性和强兴奋性,且对心肌损害是一个慢性、蓄积性过程,因此可见造模大鼠精神萎靡、少倦懒动、进食减少、皮毛枯槁等症状,2周后开始出现死亡。与空白组比较,模型组大鼠心功能(LVEF、LVFS)显著下降,血清BNP含量显著增加,表明CHF模型造模成功。
BNP主要由心室细胞分泌,病理状态下,其代偿分泌增加,因此可作为评价心脏负荷的主要指标[7]。HMI能相对准确地反映左心室功能不全程度,CHF发生时,左室出现心肌肥厚,使心脏显著扩大。本研究结果显示,各给药组大鼠BNP、HMI较模型组减少,表明温阳益气活血方能改善模型大鼠的心功能不全症状。
Ca2+-ATP酶又称钙泵,约2/3的Ca2+运转由心肌肌浆网钙泵(SERCA)主导并参与[8],SERCA功能正常对维持心肌活动稳定有重要作用。Na+-K+-ATP酶又称钠泵或Na+-K+-依赖式ATP酶,是一种广泛分布于细胞膜上的特殊糖蛋白,对心肌细胞的生理稳态至关重要。2种ATP酶能完成心肌正常的Na+-K+、Na+-Ca2+交换,避免Ca2+超载和心肌舒张迟缓的发生,在一定程度上抑制神经-体液调节系统,减轻心脏负荷,稳定心率及心肌收缩[9-10]。但CHF由代偿期转向失代偿期时,会伴随心肌细胞炎症反应、心肌细胞非程序性死亡、心室重构等,这一转折期的关键机制可由氧化应激介导,心肌病理损伤后能释放大量ATP,其中一部分可用于激活氧化应激反应,加速促炎因子、氧化应激产物、炎性转录因子表达,而另一部分能触发NLRP3炎症小体,介导心肌细胞焦亡[11-12]。当ATP酶表达受阻时,相应的酶活性下降,进而响应细胞膜内的高Na+反应,迫使Ca2+内流,导致膜电位失衡,诱导心肌Ca2+超载损伤。线粒体能量代谢紊乱是CHF心肌肥厚的重要机制,心肌损伤后,线粒体产能降低及氧化反应失衡,诱导Ca2+超负荷和活性氧生成增加,产生细胞毒性,进而导致心肌细胞功能不全,引发心肌结构和能量代谢重构[13-16]。本实验研究发现,CHF心功能不全涉及能量代谢失衡,模型组大鼠心肌组织Na+-K+-ATP酶及Ca2+-ATP酶活性降低,mRNA和蛋白表达也降低,经温阳益气活血方干预后,各中药组大鼠心肌组织Na+-K+-ATP酶及Ca2+-ATP酶活性、mRNA和蛋白表达均有不同程度升高,推测可能是温阳益气活血方治疗CHF的机制之一。
温阳益气活血方以桂枝、附子为君,附子温走三焦,既能引火归元,又助桂枝入血分活血通滞;人参、黄芪、熟地黄为臣,人参不仅善培补元气,且能扶正祛邪,配伍黄芪共治气虚之证,且黄芪又可养血利水行滞,助桂枝、附子益气化瘀,熟地黄填补精髓,为助阳化气提供物质基础;当归补血行血,白芍养血柔肝,使肝气调畅,且兼酸甘化阴血之性,川芎活血行气,气行则血行,同白芍相配,无行伤耗血之虞,三药共为佐药;桃仁、红花、赤芍为使,桃仁性平,行血却不过极,同时佐助当归行润肠通便之功,红花、赤芍温凉适宜,互相制约,共奏活血之效。
综上所述,温阳益气活血方能改善CHF心功能不全,其机制与增强Na+-K+-ATP酶、Ca2+-ATP酶活性,上调其mRNA及蛋白表达,改善CHF能量代谢失调有关。后续课题组将从能量代谢角度进一步探究CHF的发病机制,筛选温阳益气活血方干预CHF的有效作用靶点,为临床CHF疗效评估及中医诊治提供实验依据。

