牦牛 SMAD1基因第1外显子SNPs检测及与生长性状的关联分析
周建强,司 思,祁增源,韩银仓,刘 秀,孙永刚
(1.甘肃农业大学 动物科学技术学院,甘肃省草食动物生物技术重点实验室,兰州 730070;2.青海省畜牧兽医科学院,西宁 810016)
牦牛主要分布在青藏高原及其毗邻的高山和亚高山地区,是典型的放牧家畜[1]。牦牛是中国稀有而珍贵的遗传资源,中国牦牛总量约1 500万头,占世界牦牛总量的95%以上[2]。牦牛生长缓慢、饲养条件粗放、生产性能低下,使得其经济效益和生产效率较低[3]。
SMAD蛋白家族是将转化生长因子-β(Transforming Growth Factor-β,TGF-β)超家族成员包括TGF-β1、TGF-β2、TGF-β3以及骨形态发生蛋白(Bone morphogenetic protein,BMP)、活化素等多个成员的信号传导至细胞核的介导蛋白[4]。TGF-β在调节细胞生长、增殖、分化、迁移和凋亡中起重要作用,可参与器官和组织的生长发育过程[5-6]。目前,SMAD蛋白已发现至少有8种(SMAD1~8),其中,SMAD1~3、SMAD5、SMAD8是受体激活型SMAD蛋白(Recepter Activated SMAD,R-SMADs)[7];SMAD4是通用调节型SMAD蛋白(Common mediator SMADs,C-SMAD)[8];SMAD6和SMAD7是抑制型SMAD蛋白(Inhibitory SMADs, I-SMADs)[9]。
研究表明,BMPs的生物学作用几乎涉及机体所有系统,其不只限于调控骨骼的形成和发育,并且在动物的生长发育过程中起着重要作用[10]。SMAD1、SMAD5、SMAD8能被BMP受体磷酸化,参与BMP信号的传导,进而调控动物的生长发育。研究发现,在鼠的骨骼肌细胞核中定位并敲除SMAD1、SMAD5、SMAD8基因后,其肌肉量减少。对鼠胚胎干细胞(ESCs)进行分析,发现SMAD1、SMAD4和SMAD5占据一组生长调节因子,而这组调节因子的功能是促进ESCs快速分化[11]。研究发现,BMP-SMAD1、SMAD5、SMAD8通路能与SMAD2、SMAD3通路竞争SMAD4,从而提高肌肉量及促进成肌分化过程[12]。同时,关于SMAD1基因的研究多集中在小鼠、大鼠、人类及其在一些疾病方面的作用,而SMAD1基因与牦牛生长发育及生长性状的关联性则鲜有报道。因此,本研究将牦牛SMAD1基因作为候选基因,采用DNA测序和单倍型分型技术,对青海牦牛SMAD1基因第1外显子进行SNPs检测,寻找与牦牛生长性状相关的SNPs位点,以期为牦牛分子育种以及SMAD1基因的功能研究提供理论基础。
1 材料与方法
1.1 试验材料
在青海省海北州祁连县野牛沟乡边麻梅龙掌合作社随机选择成年(3岁)健康高原型母牦牛440头,颈静脉采血10 mL,ACD抗凝(VACD∶V血液=1∶6),轻微摇动混匀样品后置于-80 ℃保存,备用。同时测量记录牦牛的体质量、体斜长、体高、胸围和管围5个体尺指标。
1.2 基因组DNA提取及检测
根据血液DNA提取试剂盒(天根,北京)的方法从血液中提取基因组DNA。用超微量分光光度计(NanoDrop one)检测DNA的浓度,用 8 g/L琼脂糖凝胶电泳检测DNA的完整性,-20 ℃保存,备用。
1.3 引物设计和PCR扩增
在NCBI中查询牦牛SMAD1(NW_005395284.1)的基因序列,设计PCR引物(用Primer 5.0软件)。引物信息见表1(由上海生工生物工程有限公司合成)。

表1 引物序列信息
PCR反应体系25.0 μL:上游、下游引物各0.7 μL(10 pmol/μL)、Mix 12.5 μL(内含TaqDNA聚合酶、10×Buffer、dNTPs等)、DNA模板1.0 μL(50 ng/μL),加ddH2O 10.1 μL。PCR反应参数:94 ℃预变性4 min;94 ℃变性30 s,58.6 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min;4 ℃保存。
1.4 SNPs检测
PCR扩增产物用8 g/L琼脂糖凝胶电泳检测。将扩增质量较好的PCR产物送至上海生工生物工程有限公司进行纯化测序。使用Seqman软件对测序结果进行对比分析,寻找SNPs位点。
1.5 数据统计分析
利用Excel 2010进行基因型统计,分析计算遗传多态性,包括基因型、等位基因频率、遗传杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC),并对SMAD1基因多态性位点在牦牛群体中的基因型分布进行卡方检验[13]。采用SPSS 23.0软件中一般线性模型分析SNPs位点与生长性状的关联性。对SMAD1基因5个SNPs位点进行连锁不平衡、单倍型分析(使用Haploview 3.32软件)。分析基因型效应对生长性状的影响。采用固定模型:
Yij=μ+Gi+Eij
式中,Yij为个体表型值;μ为群体均值;Gi为标记基因型效应;Eij为随机误差。
2 结果与分析
2.1 SMAD1基因SNPs的遗传特征分析
测序分析发现,牦牛SMAD1基因第1外显子存在5个SNPs位点(图1),分别是g.35084C>T、g.35111C>T、g.35171G>A、g.35312C>T和g.35333G>A;g.35084C>T和g.35111C>T均存在CC和CT 2 种基因型;g.35171G>A存在GG、GA和AA 3 种基因型;g.35312C>T存在CC、CT和TT 3 种基因型;g.35333G>A存在GG和GA 2 种基因型。
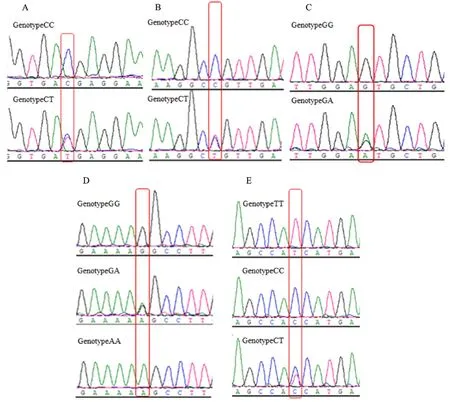
A.g.35084C>T; B.g.35111C>T; C.g.35333G>A ; D.g.35171G>A; E.g.35312C>T
牦牛SMAD1基因第1外显子遗传多态性分析结果见表2,在SMAD1上的g.35084C>T和g.35111C>T的优势基因型均是CC,优势等位基因均是C;g.35171G>A和g.35333G>A的优势基因型均是GG,优势等位基因均是G;g.35312C>T突变位点的优势基因型是CC,优势等位基因是C。卡方检验表明g.35084C>T、g.35111C>T和g.35312C>T 3个突变位点均处于Hardy Weinberg平衡状态(P>0.05),g.35171G>A和g.35333G>A处于极不平衡状态(P< 0.01);g.35084C>T、g.35111C>T和g.35333G>A处于低度多态水平(PIC<0.25),g.35171G>A和g.35312C>T处于中度多态水平(0.25
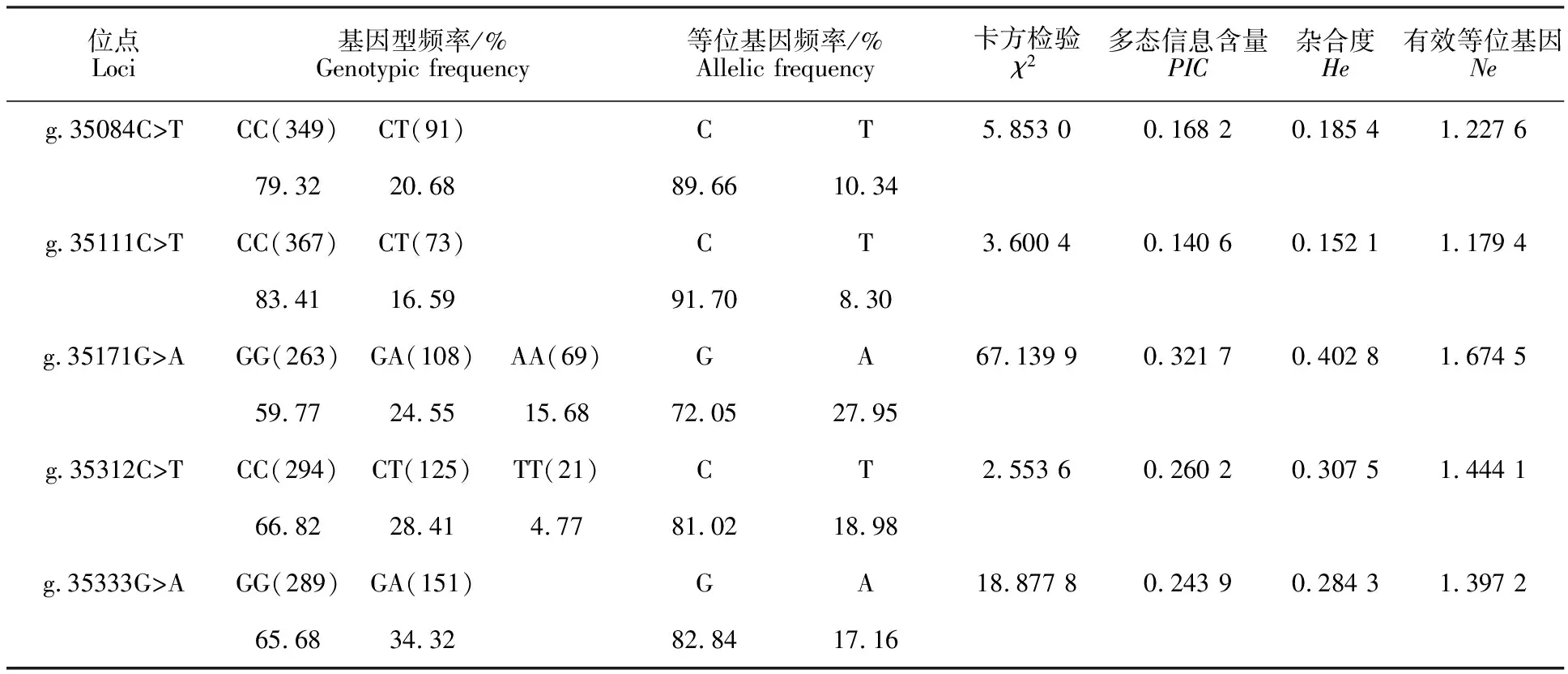
表2 牦牛 SMAD1基因遗传多态性分析
2.2 牦牛 SMAD1基因突变位点基因型对生长性状的影响
由表3可知,g.35084C>T位点与胸围显著相关,CT基因型个体的胸围极显著大于CC基因型个体(P<0.01),其他指标差异不显著(P> 0.05);g.35111C>T位点与体斜长、胸围显著相关,CT基因型个体的体斜长和胸围极显著大于CC基因型个体(P<0.01),其他指标差异不显著(P> 0.05);g.35171G>A和g.35312C>T位点与体质量、体高、体斜长和胸围显著相关,其中,g.35171G>A位点AA基因型和GA基因型个体的体质量、体高、体斜长和胸围均极显著大于GG基因型个体(P<0.01),g.35312C>T位点CT基因型个体的体质量、体高、体斜长和胸围均极显著大于CC基因型个体(P<0.01),其他指标差异不显著(P>0.05);g.35333G>A位点与胸围、体高显著相关,GA基因型个体的体高显著大于GG基因型个体(P<0.05),胸围极显著大于GG基因型个体(P<0.01),其他指标差异不显著(P>0.05)。
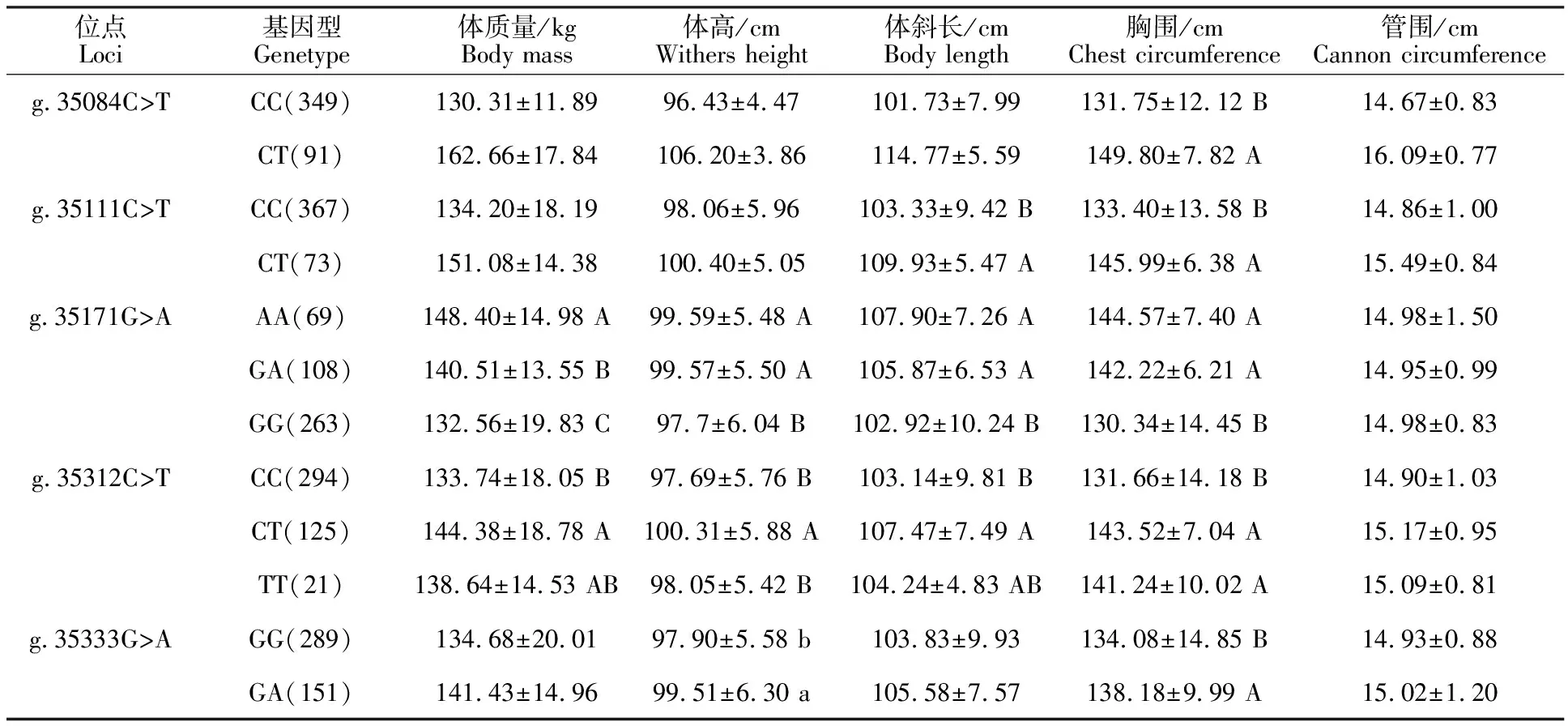
表3 SAMD1第1外显子5个突变位点与牦牛生长性状的关联性分析
2.3 SMAD1基因SNPs位点的单倍型和连锁不平衡分析
对SMAD1基因上5个SNPs位点进行单倍型分析,将发生频率低于5.00%的单倍型剔除,检测到6种单倍型,分别为Hap1~Hap6(表4)。其中单倍型Hap3的发生频率最高为0.425,是主要单倍型,单倍型Hap6的发生频率最低为 0.055。
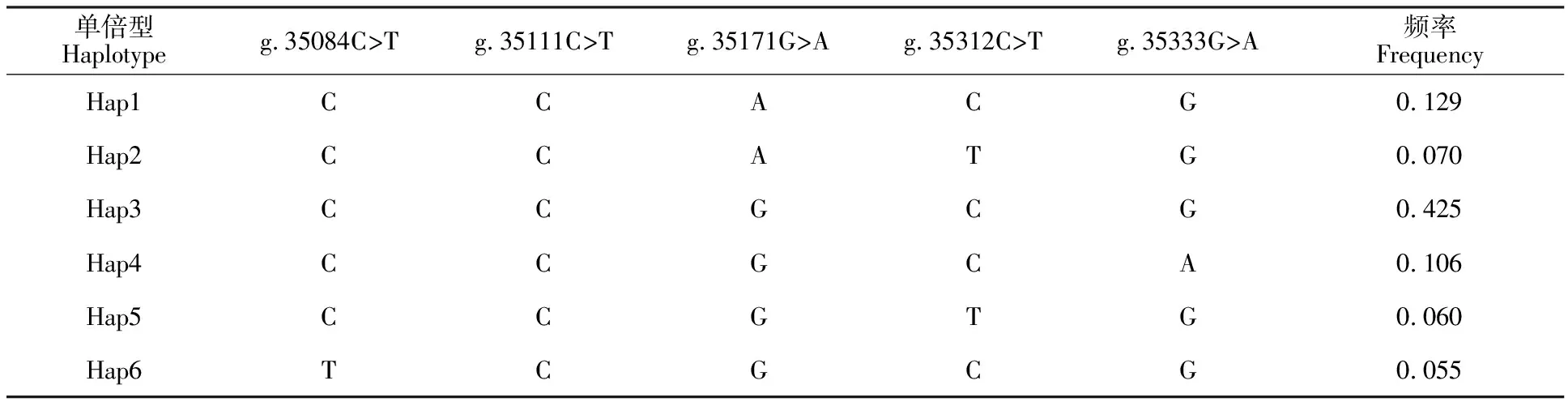
表4 牦牛 SMAD1基因突变位点单倍型分析
通过表5得出,SMAD1基因各个位点间不存在强的连锁不平衡效应,5个SNPs位点两两间的D′< 0.8,r2<0.33(D′>0.8,r2>0.33时为强连锁不平衡)。
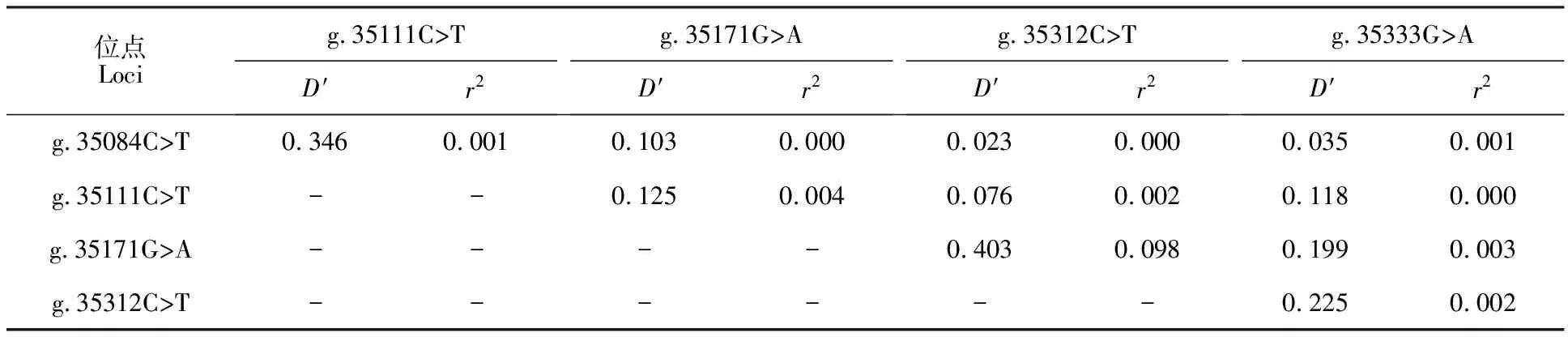
表5 牦牛 SMAD1基因突变位点连锁不平衡分析
2.4 SMAD1基因SNP位点组合单倍型对牦牛生长性状的影响
软件分析发现,SMAD1基因中5个SNPs位点共有9种组合单倍型,将发生频率低于 5.00%的5种组合单倍型定义为其他类型,并剔除,将其余的组合单倍型与牦牛的生长性状进行关联性分析。由表6得出,组合单倍型H3H6的个体均值在体质量、体高、体斜长、胸围和管围指标均极显著高于H3H2、H3H4和H3H3组合单倍型的个体均值(P<0.01)。综上可得,组合单倍型H3H6可能是影响牦牛生长性状的最优组合单倍型。
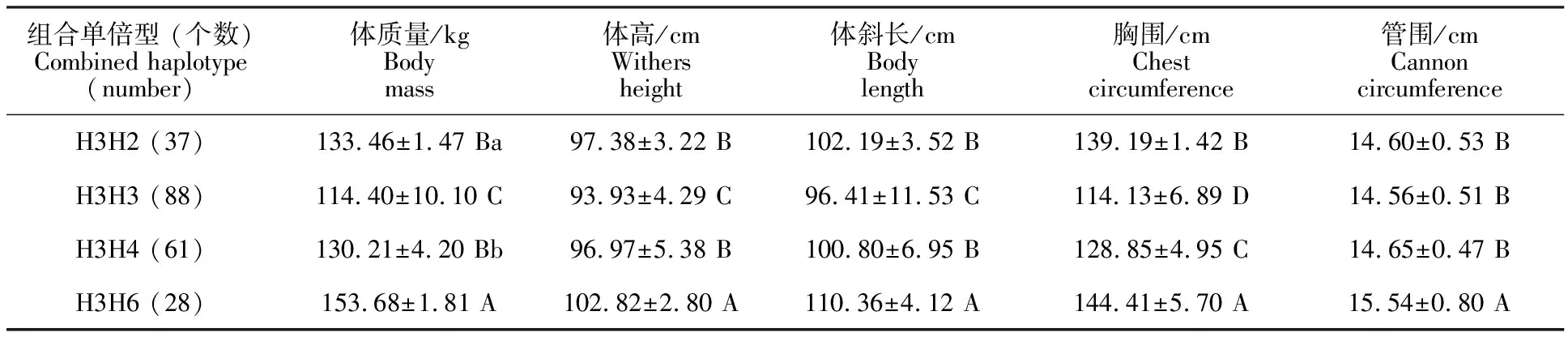
表6 SMAD1基因突变位点组合单倍型与牦牛生长性状关联性分析
3 讨 论
生长性状是衡量家畜个体生长发育和经济效益的一个重要指标,在育种学中具有重要的价值。将基因多态性与生长性状联系起来,选育出生长发育快的个体,可以有效缩短对生长性状的选育年限[14]。SMAD1不仅在促进骨骼形成方面有重要作用[15],且对激素分泌和生长也有重要作用[16]。研究表明,SMAD1参与BMP信号通路来调控成年肌肉量变化,并对成肌因子和分化过程有重要作用[12,17]。钟昕[18]和王鑫磊[19]发现BMP基因的多态性与黄牛的生长性状有较大的关联性。所以,推测SMAD1基因与生长性状有一定的关联。
SMAD1基因在家畜中的研究较少。宁越等[20]证实SMAD1基因可正向调控秦川牛原代成肌细胞分化。池秋蝶等[21]研究发现文蛤SMAD1基因多态性与文蛤的生长性状显著相关。本试验采用DNA直接测序法进行基因型分型,在牦牛SMAD1基因第1外显子上发现5个突变位点,根据卡方检验可看出g.35084C>T、g.35111C>T和g.35312C>T 3个突变位点均处于Hardy Weinberg平衡状态(P>0.05),可知,在有突变的情况下,经自然选择、人为选育的干扰,最终各种因素相互抵消,使得群体处于遗传动态平衡状态[22];g.35171G>A和g.35333G>A处于极不平衡状态(P<0.01),可能是环境或者人为因素影响。对于群体而言,多态信息含量高、杂合度大、有效等位基因数目多,则该位点的遗传变异性就高,说明其有较大的选择潜力[23]。g.35084C>T、g.35111C>T和g.35333G>A杂合度小,有效等位基因数目少且处于低度多态(PIC<0.25),说明这3个位点多态性较少且选择潜力较小;g.35171G>A和g.35312C>T杂合度大,有效等位基因数目多且处于中度多态(0.25 关联性分析得出,牦牛SMAD1基因的5个位点均与部分体尺指标显著相关,且均与胸围指标有显著相关,可能与SMAD1在促进骨骼形成方面有重要作用有关。此外,研究发现不仅单个SNPs会影响动物的表型,而且组合效应也会影响动物的表型[24]。李爱民等[25]研究发现ANGPTL6基因3个SNPs之间的组合均与鲁西牛生长性状显著相关。徐怀超等[26]研究发现CRTC3基因不同组合单倍型与秦川牛生长性状有显著关联。本试验将SMAD1基因中的4种组合单倍型与牦牛生长性状进行关联性分析得出,4种组合单倍型均与牦牛生长性状有着极显著和显著的关系,且组合单倍型H3H6可能是影响牦牛生长性状的最优组合单倍型。 SMAD1基因在牦牛中存在多态性,且发现的5个位点均与生长性状显著关联,优势单倍型组合是H3H6。所以,可以将SMAD1作为分子标记辅助选择的候选基因,应用在牦牛分子标记辅助育种中,缩短育种周期,加快牦牛产业的 发展。4 结 论

