沉香暴食害虫黄野螟性信息素分泌源EAG和GC-MS分析
苏浩然,王同飞,文 平*,王 刚,庄翔麟
(1.西南林业大学/云南省森林灾害预警与控制重点实验室,云南昆明 650051;2.中国科学院西双版纳热带植物园热带森林生态重点实验室,云南勐腊 666303)
昆虫通过雌、雄个体间释放与接收信息素来进行繁殖行为[1]。鳞翅目螟蛾总科成虫的性信息素腺体发达,在雌、雄个体间存在多种信息素来源腺体[2]。研究发现,螟蛾总科成虫的信息素腺体主要分布于雌虫腹部末端的腹节节间膜和雄虫翅腺上。如豆野螟(MarucatestulalisGeyer)[3]、麻楝蛀斑螟(Hypsipylarobusta)[4]以及竹织叶野螟(AlgedoniacoclesalisWalker)[5]的信息素分泌腺存在于腹部末节第8节与第9节的腹节节间膜上。烟草粉斑螟(Ephestiaelutella)[6-7]、印度谷螟(Plodiainterpunctella)[8]雄蛾的信息素腺体存在于其翅腺上。在对昆虫信息素的研究中,确认信息素释放腺体位置成为准确鉴定信息素重要前提基础。
沉香属(Aquilaria)植物是中药沉香的来源[9-10],为我国南方的重要经济林木树种。黄野螟(HeortiavitessoidesMoore)是土沉香(A.sinensis)等重要沉香种植园栽培苗木上的主要暴食性害虫。危害时常将沉香叶片啃食至仅剩叶脉,啃食完叶片后还会取食沉香小枝表皮,这直接影响了沉香生长,导致沉香结香量下降;甚至,防治不及时,经过2~3次暴食危害后,沉香苗木常成片呈火烧状枯死[11-12],造成经济损失和环境影响。要保护土沉香健康生长就必须对黄野螟进行有效防治。化学防治是目前防治黄野螟的主要手段[13],但因抗药性导致的用药过量又会影响药用沉香的农残水平和结香品质,同时杀伤黄野螟的天敌,并对环境造成污染[14]。因此迫切需要研究、开发黄野螟的绿色防控技术,其中性信息素具有较好应用前景[15]。使用性信息素对害虫进行防治具有高效绿色的优点,需要通过逐步鉴定来确认性信息素关键组分结构和比例后进行开发,而首先需要确认的是性信息素的产生或释放的部位。黄野螟的性信息素已经得到了关注,按照文献报道的常见螟蛾科性信息素腺体部位[2],研究者以黄野螟雌蛾腹部第8节与第9节的性腺为其性信息素提取部位进行提取[16-17],在黄野螟羽化高蜂期使用多头处女雌蛾的性腺提取物进行林间引诱,诱蛾量在几十只每天。但根据黄野螟的产卵量和暴发特性,林间成蛾数量可达成百上千,说明重捕率有限[18]。此外,直接使用腺体提取物进行检测中,从图谱上看,并没有发现很明显的性信息素主要成分[16]。所以推测黄野螟雌蛾腹末的第8、第9节并不是其分泌和释放信息素的主要部位,因此很有必要对其他可能释放性信息素的虫体部位进行细致的检测确认。
笔者以黄野螟为研究对象,将处于暗周期下的黄野螟雌蛾各部位进行分段解剖,放入滴管内制成味源管后,使用昆虫触角电生理系统(electroantennogram,EAG)分别检测对比雌蛾各部位分段气味对黄野螟雄蛾EAG响应,并与文献中所用的雌蛾腹部第8~9节提取物气味功能进行对比,以鉴定黄野螟雌蛾分泌气味对雄蛾产生特异性EAG活性成分的部位。随后使用固相微萃取顶空(solid phase microextraction,HP-SPME)对能产生强EAG响应的部位进行挥发物提取,并使用气相色谱-质谱联用仪(Gas chromatography-Mass Spectrometry,GC-MS)对所提挥发物进行离子流分析,以判定黄野螟雌蛾性信息素分泌腺体所在部位,从而为黄野螟性信息素准确鉴定提供腺体组织定位的工作基础。
1 材料与方法
1.1 供试昆虫供试黄野螟均采自中国科学院西双版纳热带植物园,在沉香苗圃中调查虫害后将带有卵块的沉香叶片采集并放入塑料盒(长14.0 cm、宽8.0 cm、高6.0 cm)内,在盒盖上开若干小孔以保持空气流通。卵表面变为深黄并带有黑点时,在卵上方放置一片健康的沉香顶部嫩叶,以保证幼虫孵化后有充足的食物。1~3龄幼虫每100头左右放置到一盒中,每日提供3 ~ 5片沉香嫩叶。3~5龄幼虫需每20头放置到一盒内饲养,每日提供10~20片成熟沉香叶片并清除盒内粪便,防止黄野螟染病死亡。将5龄以后、体表变为黄色且不继续取食叶片的黄野螟幼虫15头一盒放入化蛹盒内(化蛹盒为长14.0 cm、宽8.0 cm、高6.0 cm的塑料盒,在塑料盒内添加2.0 cm厚的江沙土,并使用去离子水保持盒内湿度50%。江沙土需先过10目筛,取细颗粒,再过60目筛,取粗颗粒,作为化蛹的土壤基质)。将刚羽化的黄野螟成虫单独放入直径3.0 cm、高11.0 cm的塑料离心管内,用棉签饲喂15%蔗糖溶液补充营养,成虫羽化后0~24 h视为1日龄,24~48 h为2日龄,依此类推。黄野螟培养条件为室温(20~28 ℃),湿度70%~80%,成虫光周期/暗周期为12 h/12 h。待测及待解剖的黄野螟在试验前喂食后放入黑暗环境中静置4 h以上,进入求偶行为活跃的暗周期,以保证性信息素正处于大量分泌阶段。取样后立即进行解剖,开展试验。
1.2 雌虫解剖物气味EAG测定参照文献[18],选择20头在黑暗环境中静置4 h以上的2日龄雌蛾,使用微型眼科剪刀将其腹末第8、9节剪下后放置样品瓶内使用50 μL重蒸正己烷将其淹没,在4 ℃浸提2 h,将粗提物转移至干净的样品瓶内,冷藏备用。
因为文献方法提取的雌蛾性腺样品对雄蛾触角电生理反应不明显,解剖雌蛾各部位作为样品,使用触角电位仪重新定位对雄蛾触角有强电生理活性反应的雌蛾信息素来源部位。解剖方法:使用镊子和解剖剪将雌蛾解剖为头部(H)、胸部(T)、腹部(AB)、翅(W)4个分段。将能引起雄蛾强电生理反应的雌蛾腹部进一步细分为腹部前段(AF)(腹部第1、第2节)、腹部中段(AM)(腹部第3、第4、第5节)、腹部后端(AH)(腹部第6、第7、第8、第9节)3个分段。
在2.0 mL滴管内放入洁净的小团脱脂棉,后将雌蛾各分段解剖物以及1头在黑暗环境中静置4 h以上的2日龄雌蛾分别放入滴管中。使用打孔器将滤纸打成小片状,使用重蒸正己烷润洗小纸片,在风干后的小纸片上滴加5.0 μL黄野螟雌蛾性腺粗提液,挥干溶剂后将其放入2.0 mL气味管内;以同样方法在风干的小纸片上滴加5.0 μL正己烷后将其放入2.0 mL滴管内作为对照(CK)。所有解剖物和完整雌蛾均分别放入滴管中,并做好标记。雄蛾在3组试验中分别测试52、48和48头;雌蛾在2组试验中分别测试36和24头。每3次测试,更换一次雌蛾解剖物及提取物。
对雄蛾触角进行的EAG试验中,共有使用CK、GE、H、T、AB、W、FM和CK、AF、AM、AH以及CK、GE、AM、AB的3组对照试验;而在对雄蛾触角进行的EAG试验中,仅进行了使用CK、GE、H、T、AB、W、FM和CK、AF、AM、AH的2组对照试验。
EAG系统包括:1台IDAC-4数据记录控制器(Syntech,德国)、2个GAIN 10X通用单端电极(Syntech,德国)以及1台CS-55刺激气流发生器(Syntech,德国)。在每一次测试中,都切下黄野螟的头部,将其连接至装有生理盐水的接地玻璃电极中,用虹膜剪剪开2个触角端部第一小节,并将其分别安装在2个同样装有生理盐水的玻璃记录电极内,用0.4 mm 的银丝将玻璃电极分别连接到2个探头输入端和1个接地之间,电极中充满生理盐水。背景气流使用超纯水加湿后,流经去除静电的接地铜网,调节流速使味管出口风速42.0 cm/s,刺激气流为补偿接入,切换气味时,总流量不变,无气流振动干扰。每次刺激2.0 s,每次刺激之间等待25.0 s更换气味源。使用GC-EAD V4.6软件(SYNTECH,德国)分别记录雌、雄蛾的触角电位响应值,以供分析。
1.3 活性腺体的 HS-SPME-GC-MS联用分析将有最强EAG反应的虫体分段组织样品,转入洁净的2.0 mL样品瓶(Agilent,美国)中,使用SPME在室温下顶空提取1.5 h后进行GC-MS热解析。同时还剪取雄虫腹部作对比,每个样品测试3次。
GC-MS仪器为HP 7890A-5975B GC-MS系统(Agilent,美国),所用色谱柱为HP-5ms(30 m × 250 μm × 0.25 μm,Agilent,美国),载气设置为1 mL/min(He气,纯度≥99.999%)。将SPME提取到的挥发气味以不分流的形式在进样口温度为250 ℃的条件下,注入到GC-MS的进样口中。设置柱箱的升温程序:以50 ℃的初始温度保留4 min,后以10 ℃/min升至280 ℃后保留15 min;EI源加热至230 ℃,电离能量为70 eV;MS四极杆加热到150 ℃;扫描质量范围为m/z 28.5 ~ 300,阈值为10。最后使用MSD ChemStation软件(Agilent,美国)来分析数据。
1.4 数据处理使用Origin软件对雌、雄蛾各样品的EAG响应数据进行重复测量方差分析(One-way ANOVA),样品间平均值的差异使用Sidak法检测(P<0.05)。对两性成虫各自最有活性的样品EAG活性差异进行T检验分析(P<0.001)。
2 结果与分析
2.1 触角电位
2.1.1黄野螟雄蛾EAG反应。黄野螟雄蛾触角对雌蛾各部位解剖样品的EAG反应结果见图1。当使用雌蛾不同解剖部位物气味刺激雄蛾触角,不同样品气味刺激对雄蛾产生的EAG响应有显著影响[ANOVA∶ F(1,51)=895.99 ,P<0.05],其中雄蛾对雌蛾腹部分段(AB)的响应最强(37.69±1.18)mV(图1A )。当使用雌蛾腹部不同分段解剖物气味刺激雄蛾触角时,分段样品气味刺激对雄蛾EAG响应有显著影响(ANOVA∶ F(1,47)= 1 621.63,P<0.005),其中雄蛾触角对雌蛾腹部中段(AM)的EAG反应最强[(36.33±1.26)mV](图1B);当使用前述2个分析中最有活性的2个样品(AB与AM)与文献中腺体提取物的气味(GE)[16]刺激雄蛾触角时,雄蛾对雌蛾腹部中段[(36.60±1.74)mV]和对整个腹部[(35.04±1.66)mV]的EAG响应值差异不显著(T检验,t=1.32,P>0.05),但均显著高于文献提到的雌蛾腺体提取物气味刺激雄蛾时产生的EAG响应值[GE:(15.70±1.15)mV](T检验,AM:GE,t=17.78,P<0.05;AB:GE,t=16.45,P<0.05)(图1C)。
2.1.2黄野螟雌蛾EAG反应。在测试雌蛾对其他雌蛾解剖物气味的EAG响应时,尽管雌蛾表现出同样的响应模式,即雌蛾不同解剖部位气味对雌蛾产生的EAG响应有显著影响[ANOVA:F(1,31)=320.14,P<0.05],其中对腹部分段的气味(AB)响应最强[(8.93±0.47)mV](图1D);雌虫腹部分段解剖物响应显著[ANOVA:F(1,27)=275.82,P<0.05],其中对腹部中段(AM)的响应最强[(8.12±0.48)mV](图1E)。雌(n=56)、雄(n=100) 两性成虫触角对最强活性样品(AM、AB)的EAG响应有明显的性二型(P<0.001)(图1F)。
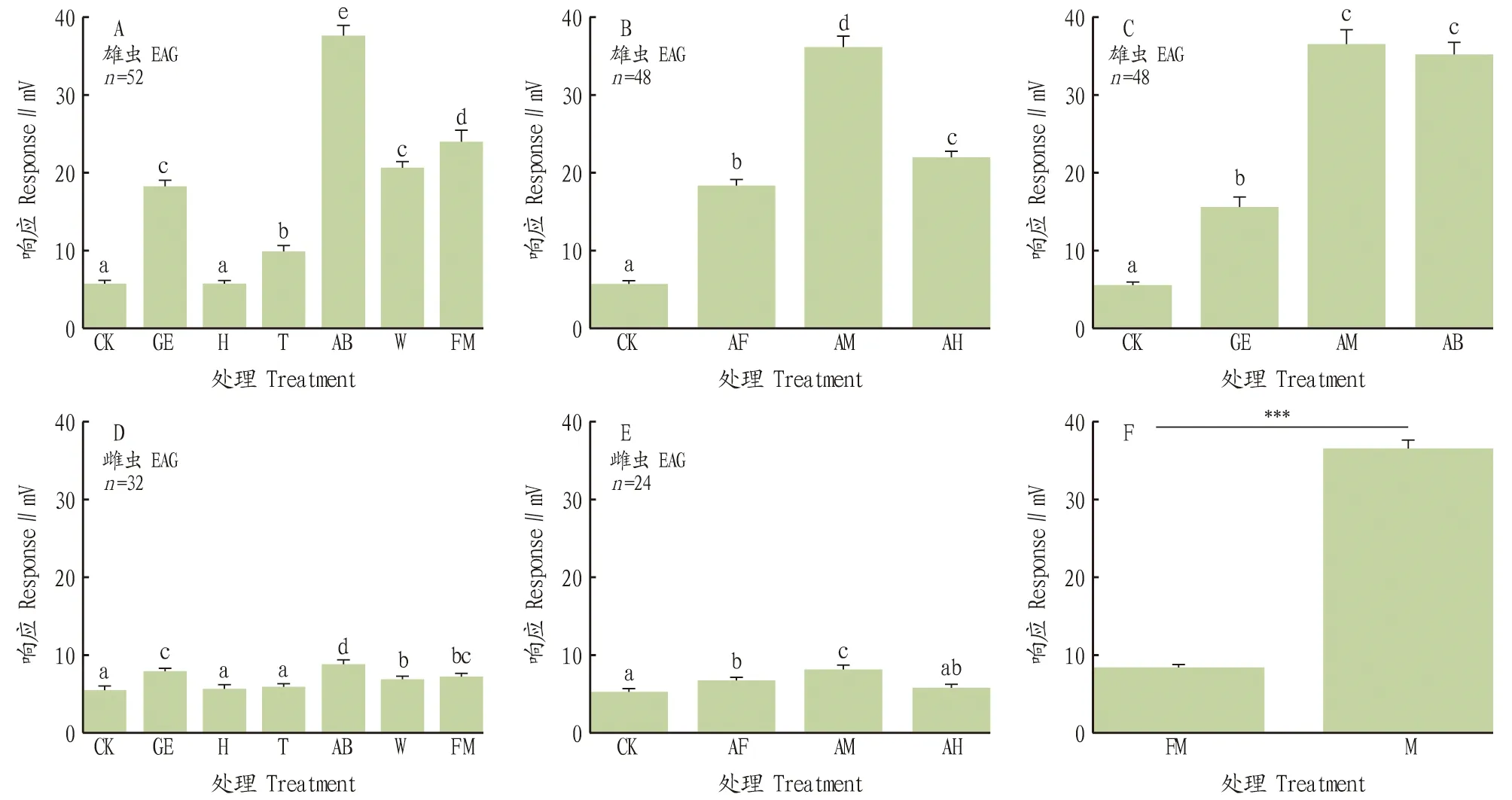
注:A.雄蛾对雌蛾各解剖分段气味的EAG响应;B.雄蛾对雌蛾腹部前、中、后3段气味的触角电生理响应;C.雄蛾对雌蛾性腺提取物、腹部中段、腹部的EAG反应;D.雌蛾对雌蛾各解剖分段气味的EAG响应;E.雌蛾对雌蛾腹部前、中、后3段气味的EAG响应;F.雌蛾、雄蛾对能产生强EAG响应的分段(AM、AB)气味的EAG反应。在图A、B、C、D、E中,CK代表对照组气味,GE代表雌蛾性腺提取物气味,H代表雌蛾头部气味,T代表雌蛾胸部气味,AB代表雌蛾腹部气味,W代表雌蛾翅气味,FM代表整个雌蛾的气味,AF代表雌蛾腹部前段的气味,AM代表雌蛾腹部中段的气味,AH代表雌蛾腹部后段的气味。图F中FM与M分别代表雌蛾与雄蛾。不同小写字母表示不同处理间差异显著(P< 0.05)。n表示样本量。图F中***表示具有极显著差异(P< 0.001)。 Note: A.Male EAG responses to female body dissections;B.Male EAG response to female dissected abdominal segments,AF,AM and AH;C.Males response to GE,AM and AB;D.Female EAG response to female body dissections;E.Male EAG response to female abdominal dissections;F.Comparison of male and female response to candidate pheromone resources (AM and AB).GE is the extract of gland ( tip segments of female abdomen ) reported in reference,H is the head,T is thorax,AB is whole abdomen,W is short for four wings,FM is short for female,AF is the forepart of abdomen,AM is the middle abdominal segments,AH is the hind-part of abdomen and M is short for males.Different lowercases indicated significant difference (P<0.05). n indicated number of sample.*** indicated significant difference (P<0.001).图1 黄野螟性信息素来源电生理活性鉴定Fig.1 Identification of electrophysiological active sex pheromone sources in Heortia vitessoides Moore
2.2 黄野螟雌、雄蛾腹部挥发物成分检测利用SPME分别顶空提取了雌蛾腹部各解剖分段以及雄蛾腹部的挥发物后,使用GC-MS来检测挥发物气味。结果表明,雌、雄蛾腹部挥发物成分有性二型差异(图2)。雌蛾的腹部中段样品中含有2个雌蛾特异的化合物(图2中以“*”标出),雌蛾腹部末段也含有这些特异活性化合物,但其含量较少,而雌蛾腹部前段及雄虫腹部均不含这些化合物。质谱检索结果分析表明2个成分为信息素类似物,但结构未知。
3 结论与讨论
该研究将雌性黄野螟不同部位进行解剖后使用不同部位分段对黄野螟雄蛾进行EAG试验,发现雌蛾腹部中段对雄蛾产生的触角电位响应最强,其活性高于文献报道的雌蛾腹部第8、9节的提取物[16]对黄野螟雄蛾所产生的触角电生理响应值,推测黄野螟性信息素主要富集于雌蛾腹部中段。使用SPME对雌蛾腹部3个分段进行了挥发物提取,用雄蛾腹部挥发物作为对比,通过GC-MS检测TIC发现了雌蛾腹部中段具有2种雌虫特异的活性化合物,这2种化合物在雌蛾腹部后端中也少量存在。这与腹部中段EAG响应最高,腹部后段EAG响应次高相对应。后续需要进一步开展气相色谱-触角电位联用(gas chromatography-electroantennographic detection,GC-EAD)技术进行化合物活性确认。
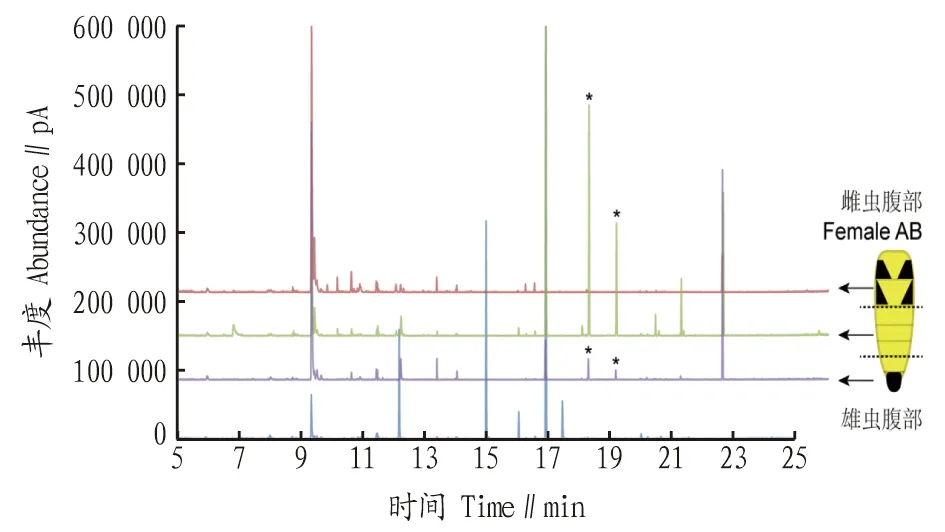
注:“*”标记了雌蛾腹部强活性段的特有成分。 Note:“*” Compounds specific to highly active female abdominal segments.图2 雌蛾腹部分段解剖挥发物与雄蛾腹部挥发物总离子流图比较Fig.2 TIC comparison for the volatile compounds from the female and male dissections
该研究结果发现黄野螟雌蛾腹部中段对雄蛾触角产生较强电生理响应,为含雌蛾特异性化合物最多的体段,在今后提取黄野螟雌蛾信息素的工作中,主要提取部位应是其腹部中段。而腹部末段对雄蛾触角产生的电生理响应为次强,且含有一定量的雌蛾特异性化合物。这也与文献报道的腹部末端行为特性及相应提取物的引诱活性相吻合,如对黄野螟的生殖行为节律的研究发现雌蛾在求偶时会将其腹部第8、第9节伸出腹部,从而吸引雄蛾前来进行交配[19];且最末端的腹节提取物能够在野外诱捕到适量的雄蛾[18]。这也提示第6~9腹节可能也具有信息素分泌结构。
在研究方法上,该研究也再次明确了鉴定性信息素来源作为关键环节在昆虫信息素鉴定研究中的重要性。东南亚热带森林昆虫具有特殊的昆虫区系,属于东洋区,许多昆虫的形态和生理特征与环境压力相适应,具有区域特点,需仔细区别验证。将来还需要进一步开展组织切片观察该研究所确认的分泌部位结构,确认腺体分泌组织是否存在于黄野螟成虫腹部中段的第3、4、5、6节中。

