肺癌免疫治疗的研究进展*
柳菁菁 张良 张爽 程颖
近年来,程序性细胞死亡受体1(programmed cell death-1,PD-1)及其配体1(programmed death-ligand 1,PD-L1)抑制剂为代表的免疫药物在肺癌治疗中被广泛研究和应用,成为无驱动基因晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的标准治疗选择,并实现了不可手术局部晚期NSCLC 巩固治疗、早期NSCLC 围术期新辅助和辅助治疗的全覆盖。在小细胞肺癌(small cell lung cancer,SCLC)领域免疫治疗也有优异的表现,免疫联合化疗成为广泛期SCLC(extensive-stage SCLC,ES-SCLC)的标准一线治疗方案。免疫药物在改变肺癌治疗形式的同时也展现出尚佳的长期生存获益,进一步奠定了其在肺癌治疗中的基石地位。在不断取得突破的同时,针对免疫治疗领域也在进行着更深层次的探索,不断调整和优化治疗策略,以期能够给患者带来更多的治疗选择和更大的疗效和生存获益,不同联合治疗的尝试、治疗模式的优化、新靶点药物的研发、生物标志物的探索等都是目前热门的研究方向,本文将对免疫治疗在肺癌领域的最新研究进展进行综述。
1 NSCLC 免疫治疗研究进展
1.1 可手术NSCLC 新辅助免疫治疗研究进展
近年来新辅助治疗成为一种有效的治疗方法,有效的新辅助治疗可以减少肿瘤体积、降低肿瘤分期、淋巴结转移,从而缩小手术范围,降低手术难度,提高手术的可行性和安全性,降低术后复发和转移的风险,对于临界可切除的NSCLC 患者更具有临床意义。既往研究提示新辅助化疗的病理学完全缓解(pathological complete response,pCR)为2%~15%,而联合放疗作为新辅助治疗并不能显著提高pCR[1]。随着免疫药物在临床中的广泛应用,新辅助免疫治疗研究备受关注,与辅助治疗相比,肿瘤切除前肿瘤抗原的存在可能产生更强、更持久的抗肿瘤T 细胞免疫反应,使其对微转移病灶更有效[2]。CheckMate159 研究[3]率先证实纳武利尤单抗用于Ⅰ~ⅢA 期NSCLC 新辅助治疗有良好的安全性和主要病理学缓解(major pathological response,MPR)获益,此后多项研究探索了免疫单药、双免联合及免疫联合化疗在可手术NSCLC 新辅助治疗的疗效(表1)。Ⅱ期单臂LCMC3 研究[11]进一步证实了免疫单药新辅助的可行性,ⅠB~ⅢA 期和经选择ⅢB 期NSCLC 接受阿替利珠单抗新辅助治疗2 周期后手术,术后阿替利珠单抗辅助治疗1 年,MPR 达21%,pCR 为7%,92%的患者完全切除,驱动基因阳性患者无MPR,提示该类患者不适于免疫新辅助治疗。Ⅱ期单臂研究NADIM[12]显示ⅢA 期NSCLC患者在术前给予免疫联合化疗新辅助治疗,术后行免疫单药辅助治疗的MPR 达82.9%,pCR 达63.4%;Ⅲ期研究CheckMate 816[6]进一步证实免疫联合化疗新辅助治疗ⅠB(≥4 cm)~ⅢA 期NSCLC 的获益,可降低疾病进展、复发或死亡风险达37%,pCR 率为24.0%,显著高于化疗组的2.2%,基于此结果纳武利尤单抗联合化疗成功获批新辅助治疗适应证。NADIM Ⅱ研究[14]再次验证纳武利尤单抗联合化疗对比化疗新辅助治疗ⅢA/B 期NSCLC 患者具有优势,pCR 分别为36.8%和6.9%。当下,免疫单药多为1~2 个周期,免疫联合多为2~4 个周期,给药周期数仍缺乏统一标准。Ⅱ期研究neoSCORE[15]比较了2 个周期和3 个周期信迪利单抗联合化疗新辅助治疗的疗效,结果显示3 个周期较2 个周期MPR 率增加14.5%,pCR 率增加4.9%,但该研究为单中心的小样本研究,结论还需验证。此外,新辅助治疗研究终点的选择尚存争议,pCR、MPR 和无事件生存(event-free survival,EFS)是主要的终点替代指标,但能否转化为总生存(overall survival,OS)获益仍有争议。上述NADIM研究中达到MPR 或pCR 患者的24 个月OS 率为100%,长期随访发现新辅助免疫联合化疗的pCR 与OS 密切相关。上述CheckMate 816 研究发现获得pCR 和MPR 的患者EFS 更长,未来还需临床研究提供更多的证据。在新辅助治疗获益人群的选择方面,CheckMate 816研究中ⅠB/Ⅱ期患者新辅助治疗后仍有12%未接受手术治疗,中位残存肿瘤细胞比例为28%,高于ⅢA期的8%,提示ⅢA 期可能更适合新辅助免疫治疗。此外,免疫新辅助加辅助治疗的全程模式也是目前的研究热点,多项Ⅲ期研究如CheckMate77T、KEYNOTE-617、IMpower030 和AEGEAN 正在进行当中。
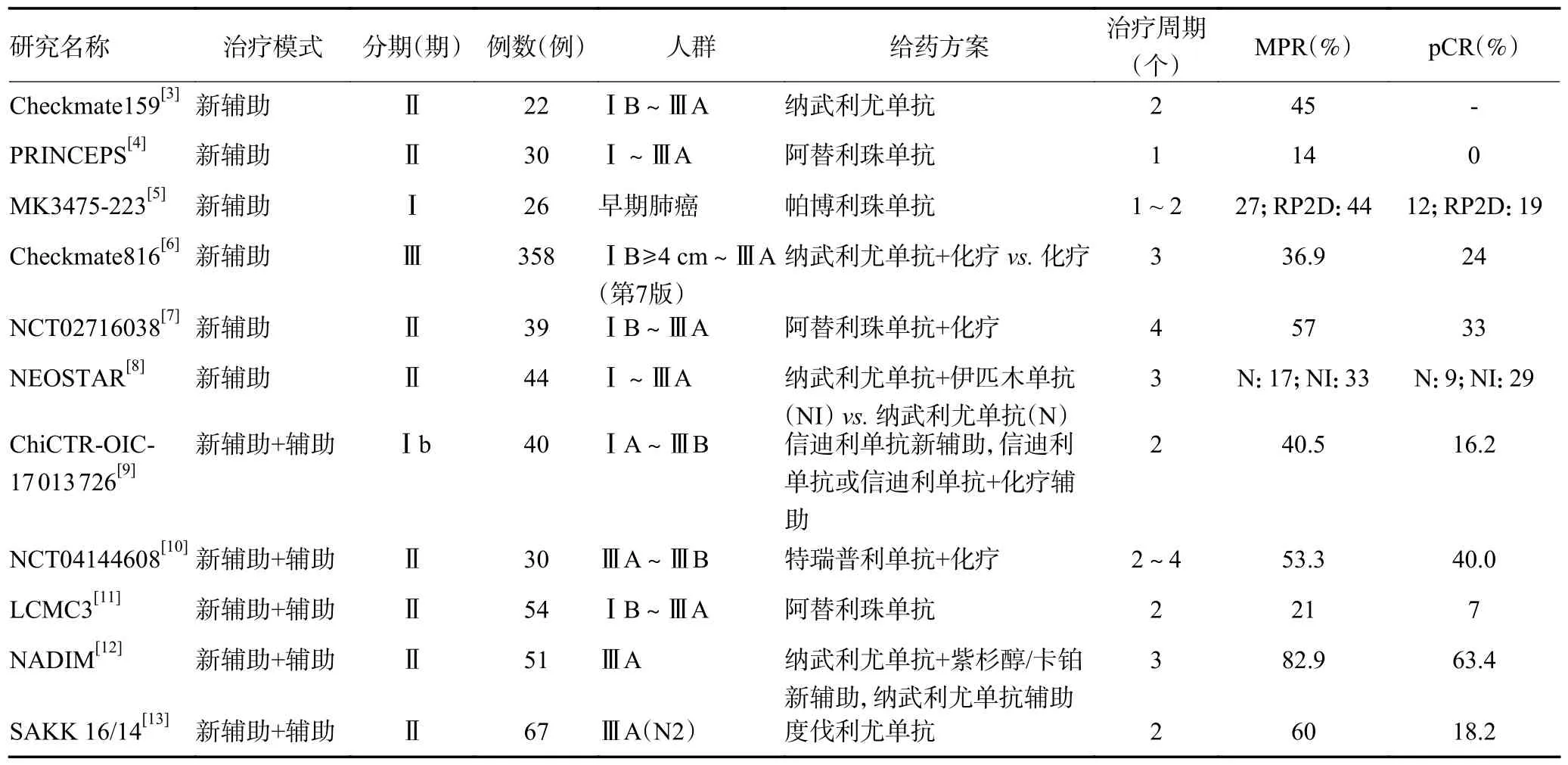
表1 部分已发表的NSCLC新辅助免疫治疗临床研究
1.2 可手术NSCLC 辅助免疫治疗研究进展
Ⅲ期研究IMpower010[16]报道,阿替利珠单抗可将主要研究人群Ⅱ~ⅢA 期患者的肿瘤复发或死亡风险降低34%,先后获得美国食品药品监督管理局(FDA)和中国国家药品监督管理局(NMPA)批准,用于治疗PD-L1≥1%的Ⅱ~ⅢA 期NSCLC 在手术和含铂辅助化疗后的辅助治疗适应证;2022 年公布了PD-L1≥1%亚组最新数据,阿替利珠单抗对比最佳支持治疗中位无病生存期(disease-free survival,DFS)的HR=0.43,且各关键亚组中几乎均观察到DFS 获益以及良好的安全性。此外,帕博利珠单抗对比安慰剂辅助治疗ⅠB(≥4 cm)~ⅢA 期可切除NSCLC 的Ⅲ期研究(KEYNOTE-091)在ITT 人群中也达到主要终点DFS,两组分别为53.6 个月和42.0 个月(HR=0.76,95%CI:0.63~0.91)。近期研究提示[17],无论是手术切除类型、淋巴结受累程度、肿瘤大小、辅助化疗的类型和周期,帕博利珠单抗均能改善DFS。但该研究另一个主要终点PD-L1≥50%人群的DFS 无显著差异,因为PD-L1 高表达人群不足30%,还需继续随访观察。目前,基于微小残留病灶的状态进行辅助免疫治疗的两项Ⅲ期研究MERMAID-1(NCT04385368)和MERMAID-2(NCT04642469)也在进行中,未来可能提供更加精准的辅助治疗模式。
1.3 不可手术局晚期NSCLC 免疫治疗进展
不可手术局晚期NSCLC 是异质性强、复杂度高的一组疾病,约占初诊患者的30%~40%,同步化放疗(concurrent chemoradiation therapy,cCRT)或序贯化放疗(sequential chemoradiation therapy,sCRT)是标准方案,但约30%患者会在治疗2 年内出现局部复发。2017 年PACIFIC 研究评估了度伐利尤单抗用于cCRT 后巩固治疗的疗效[18-19],5 年生存率达42.9%[20],较安慰剂组提升近10%。此后,多项研究针对免疫药物的应用进行探讨(表2),并在优化治疗模式等方面进行尝试。由于临床中cCRT 对患者身体状态要求较高且多数无法耐受,40%~70%的患者以sCRT 为主。GEMSTONE-301 研究[21]评估了cCRT 或sCRT 后舒格利单抗巩固治疗2 年对比安慰剂的疗效。结果显示,舒格利单抗在cCRT 或sCRT 亚组均显示一致的无进展生存(progression-free survival,PFS)获益,疾病复发或死亡风险降低36%。PACIFIC-6 研究[22]评估了sCRT 后给予度伐利尤单抗巩固治疗的疗效,证实sCRT 可从免疫巩固治疗获益。有研究尝试前移免疫药物的加入时机,如KEYNOTE-799 研究[23-24]采取免疫全程参与模式,在cCRT 前给予帕博利珠单抗联合化疗诱导治疗1 周期,随后cCRT 同步免疫治疗2 个周期,放疗结束后免疫维持治疗,NSCLC 组和非鳞癌组的客观缓解率(objective response rate,ORR)分别为70.5% 和70.6%,2 年OS 率分别为64.3%和71.2%。虽然免疫同步cCRT 的不良反应较PACIFIC 模式增加,但3 级以上肺炎发生率未超过设定阈值。KEYLYNK012、PACIFIC2、CheckMate 73L等免疫联合cCRT 的Ⅲ期研究也在进行中。免疫联合新靶点药物也是研究热点,COAST 研究[25]探讨度伐利尤单抗单药、联合抗CD73 抗体奥来鲁单抗和联合NKG2A 抗体莫那利珠单抗巩固治疗的疗效和安全性,3 组ORR 分别为17.9%、30.0% 和35.5%,PFS 分别为6.3 个月、NR 和15.1 个月,新靶点药物联合模式值得进一步验证,TIGIT 抗体的BGB-A317-A1217-301、PACIFIC8 等研究也在进行中。
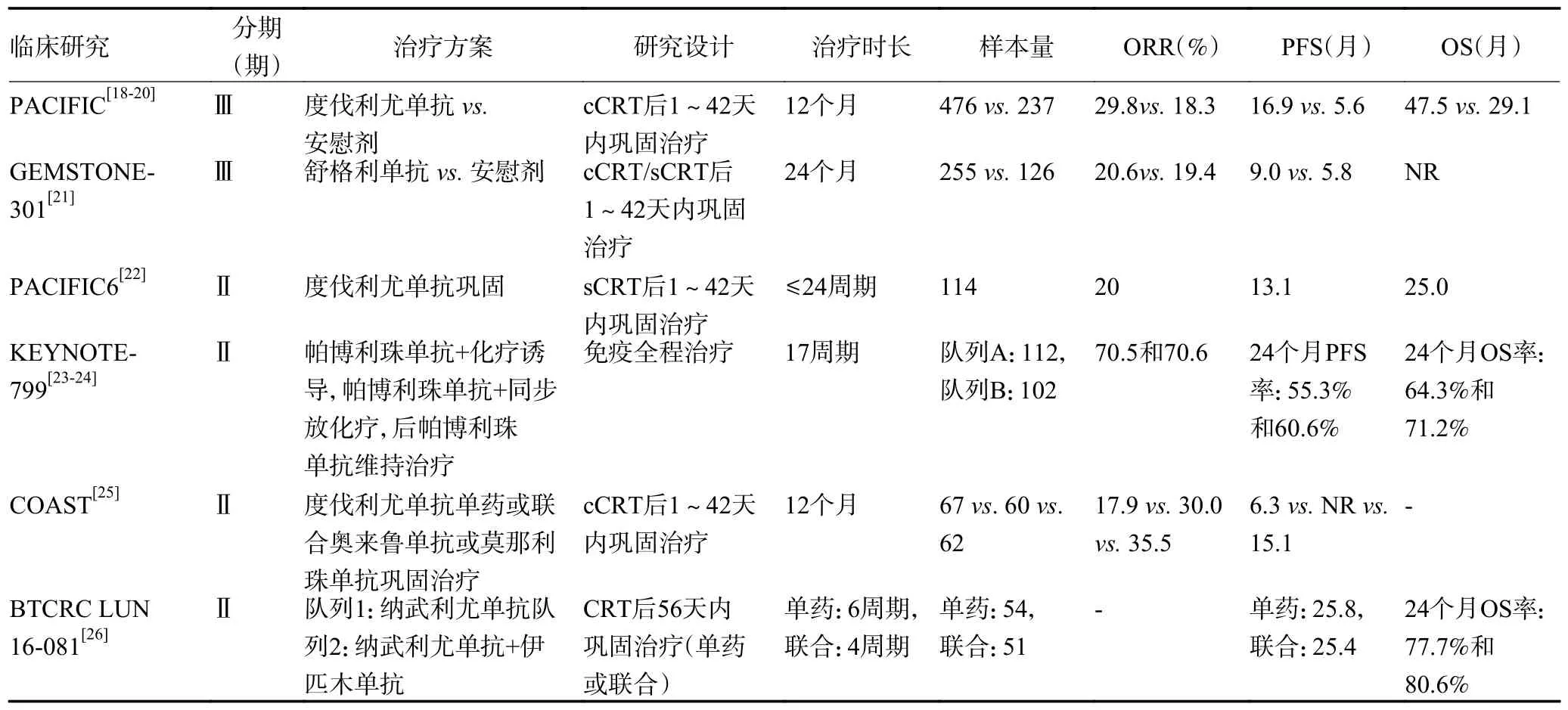
表2 部分不可手术局晚期NSCLC 免疫治疗临床研究
1.4 晚期NSCLC 免疫治疗进展
对于无驱动基因突变NSCLC,免疫治疗成功实现从后线到一线治疗的跨越,并在免疫单药、免疫联合化疗、双免联合等领域均取得阳性结果。KEYNOTE024 研究[27]率先证实PD-L1≥50%人群接受帕博利珠单抗单药一线治疗与化疗相比有显著OS 获益,并在多项研究[28-30]中得到了验证。KEYNOTE189、KEYNOTE407 和IMpower130 等研究[31-33]证明免疫联合化疗可用于晚期NSCLC 的一线治疗,将获益扩大到全人群。中国自主研发的PD-1/PD-L1 抑制剂,如卡瑞利珠单抗、信迪利单抗、替雷利珠单抗、舒格利单抗等已获批上市。首个获得阳性结果的双免治疗晚期NSCLC 的Ⅲ期研究CheckMate227[34]为一线免疫“去化疗”方案提供新的选择。CheckMate9LA[35]推进纳武利尤单抗联合伊匹木单抗及短疗程化疗一线治疗无驱动基因突变晚期NSCLC 的适应证。阿替利珠单抗联合贝伐单抗和化疗的IMpower150 研究[36]获得了PFS 和OS 的双获益,对肝转移和酪氨酸激酶抑制剂治疗失败的EGFR 敏感突变患者中观察到PFS和OS 的显著获益。目前,对于特殊人群和免疫耐药人群多种联合治疗模式的探索和优化,以及对免疫新靶点药物开发是目前研究热点。
1.4.1 PD-L1 高表达人群免疫治疗进展 多项研究证实PD-L1 高表达人群免疫单药和免疫联合化疗均是可选策略,但单药和联合方案哪种性价比更高、化疗的加入能否真正改善预后尚存争议。一项汇总了12 项临床研究的数据表明[37],免疫联合化疗组OS 有延长趋势(25.0 个月vs.20.9 个月,HR=0.82),但差异无统计学意义;中位PFS 分别为9.6 个月和7.1 个月(HR=0.69),ORR 联合治疗组高于单药治疗组(61%vs.43%),亚组分析提示75 岁以上老年患者接受免疫单药具有更好的OS 和PFS 获益。Ⅱ期研究WJOG10718L[38]评估了阿替利珠单抗联合贝伐珠单抗一线治疗PD-L1≥50%非鳞NSCLC 患者的疗效,ORR为64.1%,PFS 为15.9 个月,与免疫单药历史数据对比,免疫联合抗血管药物提高了疗效。可见大多数接受FDA 批准的免疫联合化疗治疗PD-L1 ≥50%NSCLC 患者的OS 和PFS 结果可能与单用免疫相当或更优,免疫联合抗血管药物也有提高疗效的趋势,临床应用时要综合评估患者因素、潜在获益和风险而决定是否采用联合治疗。
1.4.2 免疫耐药人群的治疗策略探索 免疫治疗耐药机制复杂,根据免疫应答反应耐药模式分为原发性耐药、适应性耐药和获得性耐药,耐药机制又包含肿瘤内生性耐药和肿瘤外源性耐药[39]。Kim 等[40]提出解肿瘤的适应性免疫抵抗机制(adaptive immune resistance,AIR)是指导未来药物研发的关键,并基于肿瘤免疫微环境PD-L1 表达和肿瘤浸润淋巴细胞(tumour-infiltrating lymphocytes,TILs)将肿瘤分为4 种类型:Ⅰ 型:PDL1-/TIL-、Ⅱ 型:PDL1+/TIL+、Ⅲ型:PDL1-/TIL+和Ⅳ型:PDL1+/TIL-,根据不同肿瘤类型可能潜在的AIR 机制决定如何采用联合治疗策略,同时提出改变肿瘤微环境、阻断免疫抑制机制、增强T细胞介导的免疫是未来联合策略的三个方向。如何克服和逆转耐药是当下研究热点,目前免疫联合治疗策略以及癌症疫苗是针对免疫耐药人群重要的探索方向。Lung-MAP 子研究S1800A[41]比较了雷莫西尤单抗联合帕博利珠单抗和标准方案治疗免疫和化疗失败患者的疗效,两组的中位OS 分别为14.5 个月和11.6 个月(HR=0.69),提示免疫联合抗血管的去化疗方案可能是克服耐药的一种潜在策略。卡博替尼是一种多靶点TKI 药物,COSMIC021 研究[42]评估了卡博替尼联合阿替利珠单抗治疗免疫耐药非鳞NSCLC 的疗效,ORR 为19%,中位OS 为13.8 个月。此外,癌症疫苗也在克服耐药人群进行了探索,OSE-2 101 是一种新抗原表位的癌症疫苗,适用于HLA-A2 阳性患者,能够刺激T 淋巴细胞识别和攻击癌细胞。Ⅲ期研究Atalante-1[43]显示在免疫耐药人群二线应用OSE-2 101和标准化疗的中位OS 分别为11.1 个月和7.5 个月(HR=0.59),FDA 已经授予其孤儿药资格。目前,免疫与靶向、化疗、癌症疫苗和其他靶点药物的联合多项研究正在进行中,有望为免疫耐药人群提供新的治疗策略。
1.4.3 免疫新靶点药物的研发 新型免疫靶点药物近年来不断被开发,例如靶向共抑制性受体(LAG3,TIM3,BTLA、TIGIT 等)、协同刺激分子(CD137、OX40、CD40、GITR 等)、肿瘤微环境中的免疫细胞(MDSCs、Tregs)的新药临床研究均在进行中。可溶性LAG-3 蛋白Eftilagimod alpha(Efti)可通过介导抗原呈递细胞和CD8T 细胞活化,与免疫药物具有协同作用。TACTI-002 研究[44-45]的队列B 结果显示efti联合帕博利珠单抗二线治疗免疫难治性NSCLC 的6个月OS 率为73%。队列A 数据显示efti 联合帕博利珠单抗一线治疗PD-L1 未经选择NSCLC 具有较好的疗效,ORR 为37.7%,中位PFS 为6.9 个月。此外,多种新型靶点药物处于早期研发阶段,值得期待。
2 SCLC 免疫治疗研究进展
免疫已经成为ES-SCLC 的一线标准治疗方案,但OS 获益仅为2 个月左右,SCLC 的临床实践中仍有很多未被满足的治疗需求,多个免疫药物相继在ESSCLC 一线治疗进行了探索。阿得贝利单抗是中国自主研发的PD-L1 抑制剂,在阿得贝利单抗联合化疗一线治疗中国广泛期SCLC 的Ⅲ期研究(CAPSTONE-1)中[46],阿得贝利单抗联合化疗OS 显著优于安慰剂联合化疗(15.3 个月vs.12.8 个月,HR=0.72,95%CI:0.58~0.90),在PFS,ORR,应答持续时间(duration of response,DOR)方面获得改善,同时具有良好的安全性。在中国自主研发的新型PD-1 抑制剂斯鲁利单抗联合化疗对比安慰剂联合化疗一线治疗ES-SCLC 的国际多中心Ⅲ期研究(ASTRUM-005)中[47],斯鲁利单抗联合化疗的OS 达到15.4 个月,比对照组为10.9 个月(HR=0.63,95%CI:0.49~0.82),两组的PFS 分别为5.7 个月和4.3 个月,斯鲁利单抗联合化疗在ORR(80.2%vs.70.4%)和DOR(5.6 个月vs.3.2 个月)方面同样具有优势。该研究首次证明PD-1 抑制剂也能够为ES-SCLC 带来生存获益,基于此结果斯鲁利单抗被FDA 授予SCLC 孤儿药的称号,斯鲁利单抗联合化疗的方案成为中国临床肿瘤学会(CSCO)小细胞肺癌诊疗指南(2022 版)中推荐的治疗选择。
针对SCLC 的治疗模式,研究者正在探索更多高效的治疗策略。TIGIT 抑制剂与PD-1/PD-L1 抑制剂联合发挥协同作用,在NSCLC 的Ⅱ期研究中取得初步疗效[48],但是在ES-SCLC 中TIGIT 抑制剂联合阿替利珠单抗的Ⅲ期研究中[49],并未在PFS 和OS 方面带来额外的获益。抗血管药物联合免疫治疗在多种实体瘤获得成功,多靶点抗血管药物安罗替尼联合PDL1 抑制剂TQB2450 和标准化疗一线治疗广泛期SCLC 的Ⅲ期研究已经完成入组,期待能为实现ESSCLC 一线治疗OS 新的突破。此外多项将胸部巩固放疗加入到免疫联合化疗治疗中的研究也正在进行。
获益人群也是SCLC 免疫治疗的重要探索方向。最近研究发现炎症型SCLC(Ⅰ亚型,不表达ASCL1、NEUROD1 和POU2F3 3 种转录因子)有更多的免疫细胞浸润,高表达免疫应答相关基因,基于IMpower-133 研究的回顾性分析中发现与其他亚型相比,Ⅰ亚型患者接受免疫治疗获益更显著(HR=0.566,95% CI:0.321~0.998)[50],CASPIAN 研究回顾性分析也获得了一致的结果[51],提示Ⅰ亚型可能是SCLC 免疫治疗获益的人群,但仍需要进行大样本的前瞻性研究进行验证。
3 结语
免疫治疗引领肺癌进入了长期生存时代,晚期NSCLC、不可手术局晚期NSCLC 和早期可手术NSCLC 的围术期治疗领域均取得成功并改变了临床实践指南,免疫联合治疗策略、新型免疫靶点药物的研发以及对生物标志物物的探索将进一步助力免疫治疗在NSCLC 的发展。在SCLC 领域,免疫治疗联合化疗成为ES-SCLC 新的治疗形式,中国自主研发的PD-1/PD-L1 抑制剂也为SCLC 免疫治疗增添新的证据。未来,肺癌免疫治疗研究将继续在生物标志物、优势人群、新靶点、耐药机制等方面进行更深层次的探索,为患者提供更多治疗选择,让肺癌真正地进入慢病时代。

