黄连解毒汤含药血清对Aβ诱导的海马神经元凋亡及GRP78/PERK/CHOP通路的影响
龙春频 林泉峰 欧阳坚 梁卉 袁晓兵
(萍乡卫生职业学院肿瘤研究实验室,江西 萍乡 337000)
阿尔茨海默病(AD)是一种神经退行性疾病,临床表现为认知障碍和记忆丧失等。老年斑是AD的主要病理变化之一,其主要分布在海马区及附近,由β-淀粉样蛋白(Aβ)沉积形成〔1〕。研究显示,Aβ能对神经细胞发挥毒性作用,诱导细胞凋亡,在对神经细胞的损伤过程中涉及氧化应激和线粒体凋亡〔2,3〕。黄连解毒汤成分为黄连、黄柏、黄芩、栀子,为清热解毒的代表方。研究报道,黄连解毒汤能够通过抗氧化应激,降低栀子导致的肝细胞凋亡〔4〕。黄连解毒汤还可以提高神经营养因子水平,减轻氧化应激对神经的毒性作用〔5〕。研究显示,细胞凋亡除含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)依赖途径外,与内质网应激(ERS)也有密切联系〔6〕。Gerakis等〔7〕报道,在AD患者的脑组织中,Aβ沉积可引起神经元发生ERS,导致神经元退变。目前对于黄连解毒汤含药血清对Aβ诱导的海马神经元凋亡的影响及其中涉及的机制尚不明确。本研究观察黄连解毒汤含药血清对Aβ诱导的海马神经元凋亡及葡萄糖调节蛋白(GRP)78/蛋白激酶R样内质网激酶(PERK)/CCAAT-增强子结合蛋白同源蛋白(CHOP)通路的影响,初步探讨黄连解毒汤含药血清对神经元的保护作用及机制。
1 材料与方法
1.1主要试剂与仪器 小鼠海马神经元细胞HT22购自青旗(上海)生物技术发展有限公司;Aβ25~35购自MCE公司;2月龄、体重(200±10)g SPF级雄性SD鼠20只购自广东省医学实验动物中心;DMEM培养基购自Gibco公司;6孔板、24孔板和96孔板购自赛默飞世尔科技(中国)有限公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)和0.2%胰蛋白酶溶液购自武汉普诺赛生命科技有限公司;TUNEL细胞凋亡(绿色荧光)检测试剂盒购自上海碧云天生物技术有限公司;蛋白提取试剂盒和蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;B细胞淋巴瘤(Bcl)-2抗体、Bcl-2相关X蛋白(Bax)抗体、Caspase-3抗体、GRP78抗体、PERK抗体和CHOP抗体均购自Abcam(中国)公司。生物安全柜购自广州涞泊锐科技股份有限公司;CO2恒温细胞培养箱购自赛默飞世尔科技(中国)有限公司;高速低温离心机购自SIGMA公司;电泳仪、凝胶成像仪、酶标仪均购自Bio-Rad公司。
1.2Aβ25~35溶液制备 将Aβ25~35溶于去离子水中,用0.22 μm滤膜进行过滤,37℃孵育7 d,-20℃避光保存。实验使用10 μmol/L Aβ25~35〔8〕作用于海马神经元细胞建立损伤模型。
1.3黄连解毒汤含药血清制备 黄连解毒汤处方:黄连9 g、黄柏6 g、黄芩6 g、栀子9 g,加蒸馏水煎煮浓缩至1∶2,待冷却后缓慢加入乙醇搅拌,使含醇量达50%后静置2 d,过滤取上清并回收乙醇,药剂使用前加蒸馏水稀释至所需浓度。将20只SD鼠随机分为空白组和黄连解毒汤低、中、高剂量组,每组5只,用药剂量按照动物体表面积比率换算等剂量法,黄连解毒汤低、中、高剂量组大鼠分别以2.7、5.4、8.1 g/kg灌胃给药,空白组给予蒸馏水灌胃,灌胃1次/d、2 ml/次,连续7 d。最后1次给药3 h后,对各组大鼠进行腹主动脉穿刺取血,离心取上清并除菌灭活,储于-20℃环境备用。
1.4细胞培养及分组 将HT22细胞随机分为5组,每组各设置10个平行对照:1、对照组:给予HT22细胞空白血清培养24 h;2、Aβ组:向HT22细胞中加入Aβ25~35(40 μmol/L)和空白血清,培养箱中培养24 h;3~5、黄连解毒汤低、中、高剂量组:向HT22细胞中加入Aβ25~35(40 μmol/L)1 h后再加入黄连解毒汤含药血清,培养24 h。
1.5MTT法检测海马神经元细胞活性 将HT22细胞以5×104个/ml的密度接种于96孔板中培养过夜,按照1.4中的分组进行处理。每孔加入20 μl MTT溶液,继续孵育4 h后,1 500 r/min离心10 min,弃去培养基,每孔加入150 μl DMSO,避光并用振荡器混匀,通过酶标仪测定每孔细胞的570 nm吸光度(A)值。细胞活性(%)=(A1~5-A空白组)/(A1-A空白组)×100%,空白组为150 μl的细胞培养基,用以排除培养板和培养基本底吸光值对实验的影响。
1.6TUNEL法检测海马神经元细胞凋亡 在24孔板中放入已消毒的盖玻片,加入密度为5×105个/ml的HT22细胞培养过夜,按照1.4中的分组进行处理,遵循TUNEL检测试剂盒说明书对取出的盖玻片进行固定、洗涤、孵育和显色,荧光显微镜下观察。用不含末端脱氧核苷酸转移酶的标记液代替TUNEL混合反应液作阴性对照,用阳性对照试剂盒为阳性对照。计算细胞凋亡指数=凋亡(阳性)细胞数/视野细胞总数×100%。
1.7Western印迹检测Bcl-2、Bax、Caspase-3、GRP78、PERK和CHOP蛋白蛋白表达水平 将HT22细胞以1×106个/ml的密度接种于6孔板中培养过夜,按照1.4中的分组进行处理。弃去培养基后用胰蛋白酶消化细胞,终止后低温1 500 r/min离心10 min,无菌磷酸盐缓冲液(PBS)洗涤细胞2次,再次离心弃上清,加入细胞裂解液,按照试剂盒说明书提取细胞总蛋白。蛋白定量后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),小心取出凝胶并使用电转仪进行聚偏氯乙烯(PVDF)转膜,在室温下用5%脱脂奶封闭1 h,加入稀释(1∶1 000)的对应一抗,4℃摇床孵育过夜,弃去一抗溶液并洗涤PVDF膜,加入稀释(1∶2 000)的二抗溶液,室温摇床1 h,洗膜3次,电化学发光(ECL)显色并用凝胶成像系统拍照。
1.8统计学分析 采用SPSS20.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1黄连解毒汤对Aβ诱导HT22细胞损伤的保护作用 对照组HT22细胞呈现多极形或锥形,细胞间突起相互连接成网,胞体折光性强。Aβ25~35处理细胞后,细胞突起收缩,胞间连接断裂,胞体折光性下降,可见部分胞体溶解死亡。黄连解毒汤含药血清干预细胞后,可明显改善Aβ对HT22细胞的形态学损伤,见图1。
2.2黄连解毒汤对Aβ损伤HT22细胞活性的影响 与对照组相比,Aβ组细胞活性显著降低(P<0.05);与Aβ组相比,黄连解毒汤各组的细胞活性显著升高(P<0.05),见表1。
2.3黄连解毒汤对Aβ诱导HT22细胞凋亡的影响 与对照组比较,Aβ组细胞凋亡指数显著升高(P<0.05);与Aβ组比较,黄连解毒汤各组的细胞凋亡指数显著降低(P<0.05),见表1、图2。

图1 黄连解毒汤对Aβ诱导HT22细胞损伤的保护作用(TUNEL染色,×400)
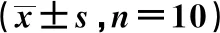
表1 黄连解毒汤对Aβ损伤HT22细胞活性、凋亡、Bcl-2、Bax、Caspase-3蛋白水平及GRP78、PERK和CHOP蛋白表达的影响

图2 黄连解毒汤对Aβ诱导HT22细胞凋亡的影响(TUNEL染色,×100)
2.4黄连解毒汤对Aβ损伤HT22细胞Bcl-2、Bax和Caspase-3蛋白水平的影响 与对照组相比,Aβ组细胞Bcl-2/Bax水平显著降低,cleaved-/pro-Caspase-3水平显著升高(均P<0.05);与Aβ组比较,黄连解毒汤各组细胞Bcl-2/Bax水平显著升高,cleaved-/pro-Caspase-3水平显著降低(均P<0.05),见表1、图3。
2.5黄连解毒汤对Aβ损伤HT22细胞GRP78、PERK和CHOP蛋白表达的影响 与对照组相比,GRP78、PERK和CHOP蛋白表达显著升高(均P<0.05);与Aβ组比较,黄连解毒汤各组细胞GRP78、PERK和CHOP蛋白表达显著降低(均P<0.05),见表1、图4。
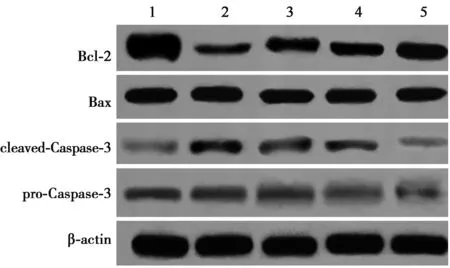
1~5:对照组,Aβ组,黄连解毒汤低剂量组,黄连解毒汤中剂量组,黄连解毒汤高剂量组;图4同
图4 黄连解毒汤对Aβ损伤HT22细胞GRP78、PERK和CHOP蛋白表达的影响
3 讨 论
AD属中枢神经系统疾病,严重威胁人类健康,患者在记忆、运动和语言等方面发生障碍,严重者丧失生活自理能力。AD患者神经系统病变主要包括:Aβ沉积形成的老年斑、细胞内异常磷酸化蛋白聚集形成的神经元纤维缠结和细胞凋亡造成的神经元突触连接丢失〔9〕。越来越多的研究显示,诱发AD的各种原因中均涉及Aβ积聚和沉积,它是AD发生的关键因素〔10~12〕。因此,如何解除Aβ引起的神经元损害,减轻中枢神经系统的损伤,成为AD治疗策略相关研究的一个焦点。
Bcl-2家族是细胞凋亡过程中涉及的一类调节因子,它的成员抗凋亡基因Bcl-2和促凋亡基因Bax是否平衡对细胞是否进入凋亡通路起重要作用。Bcl-2维持线粒体膜通透性,保护线粒体的完整性,减少细胞色素C的释放,抑制细胞凋亡;Bax则影响线粒体膜的渗透性,诱导细胞色素C从线粒体膜间隙进入胞浆,间接促进Caspase-3剪切激活,诱导细胞凋亡〔13,14〕。黄连解毒汤是经典的清热解毒方。有报道称,黄连解毒汤可通过清除或减少Aβ、抑制微管相关蛋白Tau过度磷酸化和抗感染等多种途径对AD起到治疗作用〔15〕。张茹兰等〔16〕研究报道,黄连解毒汤含药血清可通过抗氧化应激和抑制线粒体凋亡途径来减轻Aβ诱导HT22细胞毒性作用,降低细胞凋亡。本研究结果提示,黄连解毒汤能够逆转Aβ引起的海马神经元细胞活力降低,抑制细胞凋亡,可能通过抑制氧化应激及线粒体凋亡实现。
有研究报道,ERS与细胞凋亡有着密切的联系〔6〕。ERS由细胞内外环境改变导致,会引起内质网中未折叠或错误折叠的蛋白质发生聚集和钙流失导致的稳态失衡,内质网功能出现紊乱,大量促凋亡蛋白被激活,诱导ERS反应性细胞凋亡〔17〕。长时间持续的ERS会启动GRP78/PERK/CHOP凋亡通路,正常结合在GRP78上的PERK被解离下来并得到激活,促进其下游促凋亡基因CHOP的表达,诱导细胞凋亡〔18〕。Xu等〔19〕研究发现,静压引起大鼠髁突软骨细胞发生ERS,GRP78、PERK和CHOP表达上调,激活凋亡通路引起细胞凋亡。Yi等〔20〕在建立的神经元ERS模型中检测到PERK和CHOP蛋白表达上调可导致下丘脑神经损伤。本研究结果表明,黄连解毒汤可能抑制GRP78/PERK/CHOP通路的激活,提示黄连解毒汤还可能通过抑制ERS,抑制Aβ所诱导的海马神经元细胞凋亡,进一步丰富了黄连解毒汤的药理作用。
综上,黄连解毒汤含药血清可降低Aβ诱导的海马神经元细胞凋亡,抑制GRP78/PERK/CHOP通路激活,发挥对细胞的保护作用。但AD涉及的信号通路及作用机制较复杂,需要深入研究。

