三七总皂苷对人转化生长因子-β1诱导的伤口愈合及JAK2信号通路的影响
赵举辉,牛雪涛
汉中市中心医院医疗美容整形外科1、烧伤科2,陕西 汉中 723000
伤口愈合是人体再生表皮和真皮组织的自然生物学过程,包括止血、炎症、上皮再形成和组织重塑。由于各种原因无法通过正常而有序的修复过程达到完整状态的伤口被称为慢性伤口。慢性伤口不仅给临床治疗带来了巨大挑战,也给患者家庭和社会带来了经济负担[1]。重要的是,随着年龄的增长,慢性皮肤伤口无法治愈的风险会增加[2]。在皮肤伤口愈合过程中,上皮再形成在皮肤组织修复中起着至关重要的作用。上皮再形成是角质形成细胞从伤口边缘迁移到表面再形成的复杂过程[3]。因此,角质形成细胞的生理功能在伤口愈合过程中至关重要。上皮再生的过程受多种生长因子和细胞因子的调节,在这些细胞因子中,转化生长因子-β1(transforming growth factor-β1,TGF-β1)参与角质形成细胞增殖和迁移的调控[4-5]。大量研究显示,在伤口愈合过程中TGF-β1的表达显著升高,且角质形成细胞是TGF-β1作用的主要细胞[6-7]。三七是中草药中极有药用价值的植物,三七总皂苷是三七中的重要活性成分,在抗炎和抗氧化等领域具有许多应用价值[8-9]。据报道,三七皂苷能够抑制伤口炎症反应进而促进伤口愈合[10]。然而,三七总皂苷对伤口愈合的作用及机制尚不清楚。本实验采用TGF-β1刺激角质形成细胞HaCaT体外建立皮肤损伤模型,探究三七总皂苷对伤口愈合的影响及作用机制。
1 材料与方法
1.1 细胞和主要试剂 人永生化角质形成细胞株HaCaT购自美国ATCC细胞库;三七总皂苷标准品(纯度98%)购自中检所;AG490(JAK2信号通路抑制剂,纯度99.97%)购自美国MedChemExpress公司;DMEM培养基、胎牛血清购自美国Gibco公司;MTT检测试剂、TGF-β1购自美国Sigma公司;RNA提取试剂盒、逆转录试剂盒、实时荧光定量PCR试剂盒购自赛默飞世尔科技有限公司;JAK2和p-JAK2单克隆抗体和HRP标记的IgG二抗购自美国CST公司。
1.2 细胞培养和分组处理 HaCaT细胞培养在DMEM培养基中,内含10%胎牛血清,放置于37℃、5%CO2、饱和湿度的细胞培养箱中。当细胞生长汇合90%左右时传代培养,比例为1∶3。取对数期的HaCaT细胞接种到96孔板中,将细胞随机分为空白对照(Con)组、模型(TGF-β1)组、三七总皂苷处理(NT)组和NT+AG490组。其中Con组的HaCaT细胞以正常培养基进行培养,TGF-β1组的HaCaT细胞以5 ng/mL的TGF-β1处理24 h,NT组的HaCaT细胞以5 ng/mL的TGF-β1和100μg/mL三七总皂苷处理24 h。NT+AG490组的HaCaT细胞在三七总皂苷处理后加入25μmol/L的AG490处理24 h。
1.3 MTT检测细胞增殖 将HaCaT细胞接种到96孔板中,分组处理,分别在0、24 h、48 h和72 h时将10μL MTT试剂添加到每孔细胞中,并在5%CO2培养箱中于37℃孵育4 h,然后再向细胞中添加150μL二甲基亚砜,振荡孵育,使用酶标仪在570 nm处测定光密度值(OD值)。
1.4 平板克隆形成实验 各组HaCaT细胞接种于6孔板(500个/孔),将其置于培养箱内继续培养直至出现肉眼可见的细胞克隆团,随后弃培养基,并加入预冷磷酸盐缓冲液(PBS)洗涤,按照每孔500μL的密度将甲醇加入其中固定20 min(-20℃),弃甲醇后按照每孔400μL的密度将1%结晶紫染色液加入其中染色15 min(室温),采用蒸馏水洗涤后晾干,拍照并观察细胞克隆形成数。
1.5 流式细胞术检测细胞周期 对数期的HaCaT细胞以6×105/孔接种到6孔板中,分组处理24 h后加入胰蛋白酶消化并收集细胞,PBS洗涤数次,加入染色缓冲液500μL重悬细胞,向细胞中添加250μL PI染液和10μL RnaseA染液,在37℃下避光孵育30 min,使用流式细胞仪检测细胞周期分布。
1.6 划痕实验、Transwell小室实验检测细胞迁移能力 分组处理后的HaCaT细胞加入胰酶进行消化,收集各组HaCaT细胞,计数后在培养皿中接种约1×103个细胞,放置在37℃培养箱进行培养,待细胞单层汇合时,使用枪头做划痕,以PBS冲洗细胞及细胞碎片,拍照并记录此时细胞划痕距离,添加新的细胞培养液,培养48 h,拍照并记录此时细胞划痕距离,计算各组HaCaT细胞相对迁移率,相对迁移率=(0 h划痕距离-48 h划痕距离)/0 h划痕距离。Transwell小室实验:将各组HaCaT细胞用不含血清的培养基重悬(1×105个/mL),取100μL细胞悬液接到Transwell小室的上室中,下室加入600μL含10%胎牛血清的培养基,孵育48 h后取出Transwell小室,用棉签拭去上表面的细胞,4%多聚甲醛固定30 min后,0.1%结晶紫染色10 min,于显微镜下计数迁移细胞数量。
1.7 qRT-PCR实验检测PCNA、MMP-2和MMP-9基因表达 HaCaT细胞分组处理后,分别对各组HaCaT细胞进行RNA提取,测定RNA的纯度和浓度,使用逆转录试剂盒采用PCR仪进行反转录,以反转录获得的cDNA作为模板,使用Real time PCR仪行qRT-PCR检测,获取内参基因β-actin和目的基因PCNA、MMP-2和MMP-9的Ct值,使用相对定量2-ΔΔCt法计算目的基因的相对表达水平。
1.8 Western blot实验检测JAK2和p-JAK2蛋白表达 加入适量细胞裂解液分别提取各组HaCaT细胞中总蛋白,采用BCA法测定蛋白质样品浓度,取40μg蛋白加样,制备10%SDS-PAGE凝胶,进行电泳分离蛋白,随后电转至硝酸纤维素膜上,封阻,加入相应1∶800稀释的一抗,4℃进行过夜杂交,取出膜再加入HRP标记的IgG二抗,室温进行杂交2 h,在膜上滴加ECL化学发光显色液,显影、定影,采用GAPDH为内参,使用Image J软件分析条带灰度值,分别计算JAK2和p-JAK2蛋白相对表达水平。
1.9 统计学方法 以上实验均至少重复3次,采用SPSS20.0版软件分析数据。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间差异比较采用单因素方差分析,组间两两差异比较采用SNK-q检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 三七总皂苷对HaCaT细胞增殖活力及克隆形成的影响 与Con组比较,TGF-β1组HaCaT细胞的增殖活力降低,细胞克隆形成数减少,差异有统计学意义(P<0.05);与TGF-β1组比较,NT组HaCaT细胞的增殖活力升高,细胞克隆形成数增多,差异均有统计学意义(P<0.05),见表1和图1。
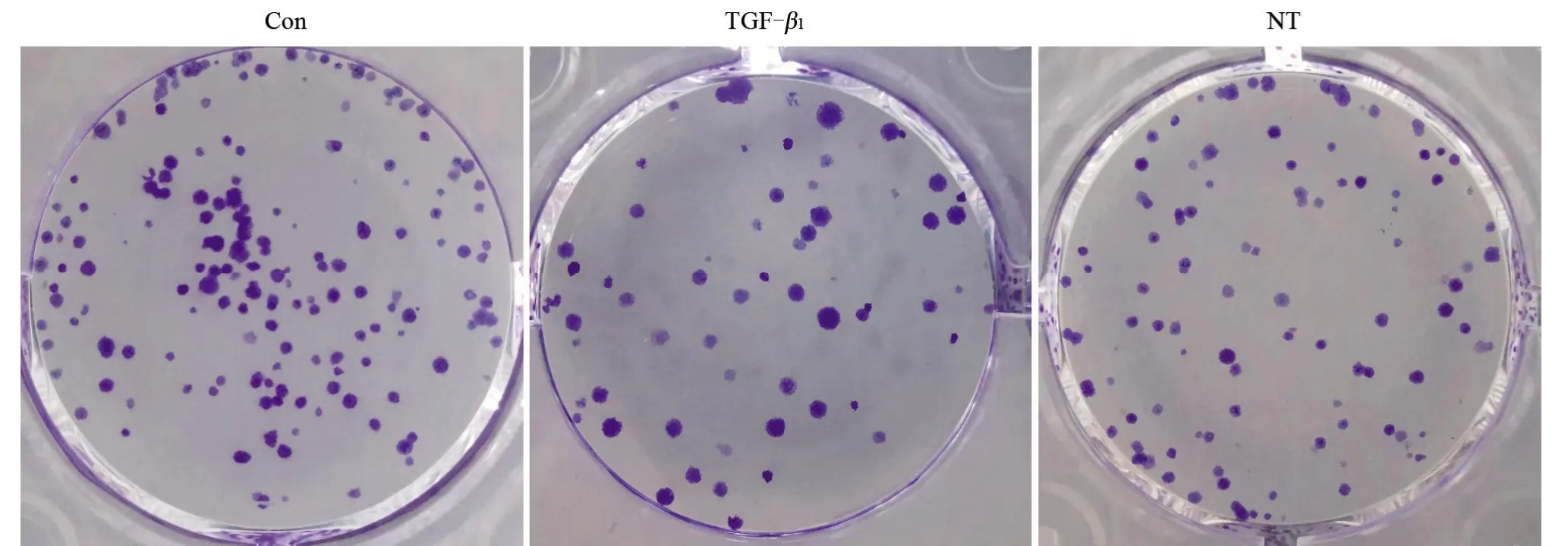
图1 三七总皂苷对HaCaT细胞克隆形成的影响Figure1 Effect of Panax notoginseng saponinson HaCaT cell cloneformation
表1 各组HaCaT细胞增殖活力(OD值)及克隆形成比较(±s,n=3)Table 1 Comparison of proliferation activity(OD value)and cloneformation of HaCaT cellsin each group(±s,n=3)

表1 各组HaCaT细胞增殖活力(OD值)及克隆形成比较(±s,n=3)Table 1 Comparison of proliferation activity(OD value)and cloneformation of HaCaT cellsin each group(±s,n=3)
注:与Con组比较,a P<0.05;与TGF-β1组比较,b P<0.05。Note:Compared with Con group,a P<0.05;Compared with TGF-β1 group,b P<0.05.
组别Con组TGF-β1组NT组F值P值0 h 0.23±0.02 0.22±0.02 0.22±0.01 0.333 0.729 24 h 0.46±0.04 0.29±0.02a 0.44±0.04b 21.583 0.002 48 h 0.72±0.07 0.46±0.04a 0.67±0.06b 16.960 0.003细胞克隆形成数(个)107.61±10.63 44.95±4.77a 89.24±7.97b 46.861 0.001 72 h 1.21±0.11 0.53±0.05a 1.15±0.10b 92.244 0.001细胞增殖活力
2.2 三七总皂苷对HaCaT细胞周期的影响 与Con组比较,TGF-β1组中G0/G1期细胞比例升高,S期和G2/M期细胞比例降低,差异有统计学意义(P<0.05),与TGF-β1组比较,NT组中G0/G1期细胞比例降低,S期和G2/M期细胞比例升高,差异均有统计学意义(P<0.05),见表2和图2。
表2 各组中G0/G1期、S期和G2/M期细胞比例比较(±s,n=3)Table 2 Comparison on the proportion of cells in G0/G1,S,and G2/M phasesin each group(±s,n=3)
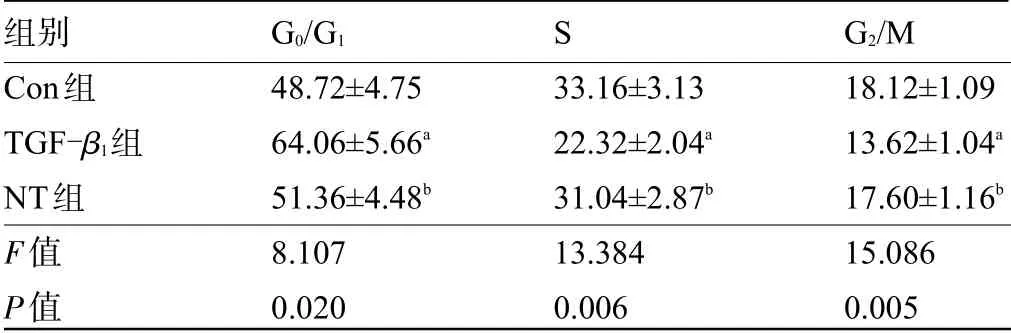
表2 各组中G0/G1期、S期和G2/M期细胞比例比较(±s,n=3)Table 2 Comparison on the proportion of cells in G0/G1,S,and G2/M phasesin each group(±s,n=3)
注:与Con组比较,a P<0.05;与TGF-β1组比较,b P<0.05。Note:Compared with thevalue in Con group,a P<0.05;Compared with the valuein TGF-β1 group,b P<0.05.
组别Con组TGF-β1组NT组F值P值G0/G1 48.72±4.75 64.06±5.66a 51.36±4.48b 8.107 0.020 S 33.16±3.13 22.32±2.04a 31.04±2.87b 13.384 0.006 G2/M 18.12±1.09 13.62±1.04a 17.60±1.16b 15.086 0.005

图2 三七总皂苷对HaCaT细胞周期的影响Figure 2 Effect of Panax notoginseng saponinson HaCaT cell cycle
2.3 三七总皂苷对HaCaT细胞迁移能力的影响 与Con组比较,TGF-β1组HaCaT细胞的相对迁移率、迁移细胞数降低,差异有统计学意义(P<0.05),与TGF-β1组比较,NT组HaCaT细胞的相对迁移率、迁移细胞数升高,差异均具有统计学意义(P<0.05),见图3和表3。
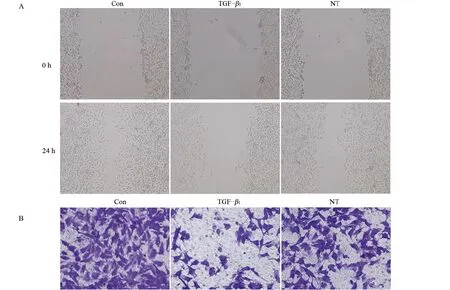
图3 三七总皂苷对TGF-β1刺激的HaCaT细胞迁移的影响Figure3 Effect of Panax notoginseng saponins on migration of HaCaT cellsstimulated by TGF-β1
表3 各组HaCaT细胞迁移能力比较(±s,n=3) Table 3 Comparison of migration ability of HaCaT cells in each group(±s,n=3)

表3 各组HaCaT细胞迁移能力比较(±s,n=3) Table 3 Comparison of migration ability of HaCaT cells in each group(±s,n=3)
注:与Con组比较,a P<0.05;与TGF-β1组比较,b P<0.05。Note:Compared with the value in Con group,a P<0.05;Compared with the valuein TGF-β1 group,b P<0.05.
组别Con组TGF-β1组NT组F值P值相对迁移率1.00±0.09 0.54±0.05a 0.87±0.09b 27.064 0.001迁移细胞数(个)127.76±11.86 54.16±5.04a 105.49±11.40b 43.313 0.001
2.4三七总皂苷对HaCaT细胞中PCNA、MMP-2和MMP-9基因表达的影响 与Con组比较,TGF-β1组HaCaT细胞中PCNA、MMP-2和MMP-9的表达量降低,差异有统计学意义(P<0.05),与TGF-β1组比较,NT组HaCaT细胞中PCNA、MMP-2和MMP-9的表达量升高,差异均有统计学意义(P<0.05),见表4。
表4 各组HaCaT细胞中PCNA、MMP-2和MMP-9表达量比较(±s,n=3)Table 4 Comparison of the expression levels of PCNA,MMP-2,and MMP-9 in HaCaT cellsof each group(±s,n=3)
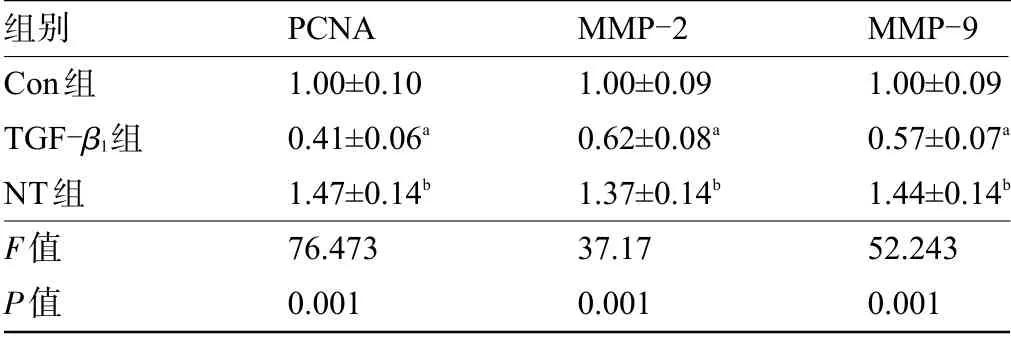
表4 各组HaCaT细胞中PCNA、MMP-2和MMP-9表达量比较(±s,n=3)Table 4 Comparison of the expression levels of PCNA,MMP-2,and MMP-9 in HaCaT cellsof each group(±s,n=3)
注:与Con组比较,a P<0.05;与TGF-β1组比较,b P<0.05。Note:Compared with the value in Con group,a P<0.05;Compared with the valuein TGF-β1 group,b P<0.05.
组别Con组TGF-β1组NT组F值P值PCNA 1.00±0.10 0.41±0.06a 1.47±0.14b 76.473 0.001 MMP-2 1.00±0.09 0.62±0.08a 1.37±0.14b 37.17 0.001 MMP-9 1.00±0.09 0.57±0.07a 1.44±0.14b 52.243 0.001
2.5 三七总皂苷对HaCaT细胞中JAK2信号通路激活的影响 与Con组比较,TGF-β1组HaCaT细胞中JAK2的磷酸化水平降低,差异有统计学意义(P<0.05),与TGF-β1组比较,NT组HaCaT细胞中JAK2的磷酸化水平升高,差异有统计学意义(P<0.05),见图4和表5。
表5 各组HaCaT细胞JAK2和p-JAK2的表达水平比较(±s,n=3)Table 5 Comparison of the expression levels of JAK2 and p-JAK2 in HaCaT cells of each group(±s,n=3)
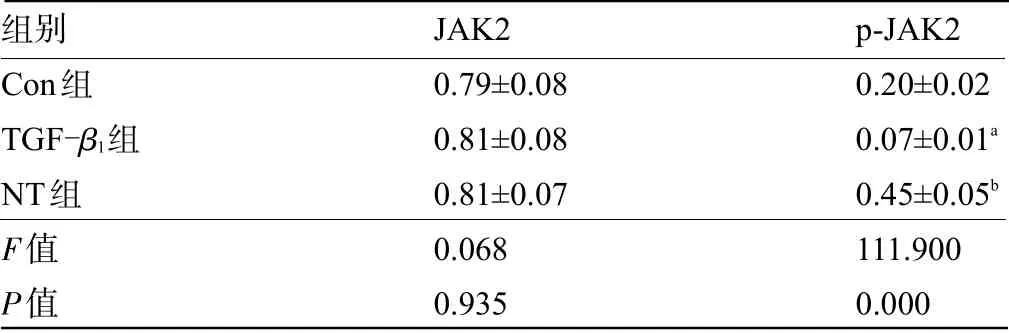
表5 各组HaCaT细胞JAK2和p-JAK2的表达水平比较(±s,n=3)Table 5 Comparison of the expression levels of JAK2 and p-JAK2 in HaCaT cells of each group(±s,n=3)
注:与Con组比较,a P<0.05;与TGF-β1组比较,b P<0.05。Note:Compared with the value in Con group,a P<0.05;Compared with the valuein TGF-β1 group,b P<0.05.
组别Con组TGF-β1组NT组F值P值JAK2 0.79±0.08 0.81±0.08 0.81±0.07 0.068 0.935 p-JAK2 0.20±0.02 0.07±0.01a 0.45±0.05b 111.900 0.000

图4 Western blot检测各组HaCaT细胞JAK2和p-JAK2的表达水平Figure 4 Expression levels of JAK2 and p-JAK2 in HaCaT cells of each group detected by Western blot
2.6 AG490减弱三七总皂苷对TGF-β1诱导的HaCaT细胞增殖、迁移的影响 与NT组比较,NT+AG490组细胞活力降低,细胞克隆形成数减少,G0/G1期比例升高,S期比例降低,相对迁移率降低,迁移细胞数减少,差异均有统计学意义(P<0.05),见图5和表6。
表6 AG490减弱三七总皂苷对TGF-β1诱导的HaCaT细胞增殖、周期和迁移的影响(±s,n=3)Table 6 AG490 attenuates the effects of Panax notoginseng saponins on proliferation,cycle,and migration of HaCaT cells induced by TGF-β1(±s,n=3)
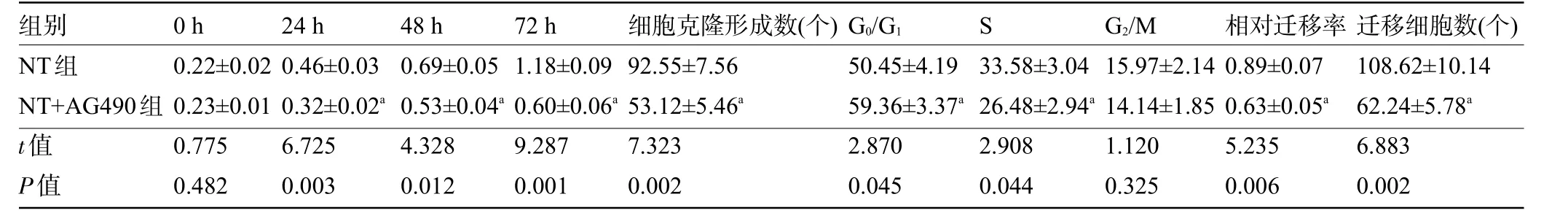
表6 AG490减弱三七总皂苷对TGF-β1诱导的HaCaT细胞增殖、周期和迁移的影响(±s,n=3)Table 6 AG490 attenuates the effects of Panax notoginseng saponins on proliferation,cycle,and migration of HaCaT cells induced by TGF-β1(±s,n=3)
注:与NT组比较,a P<0.05Note:Compared with thevaluein NT group,a P<0.05.
组别NT组NT+AG490组t值P值0 h 0.22±0.02 0.23±0.01 0.775 0.482 24 h 0.46±0.03 0.32±0.02a 6.725 0.003 48 h 0.69±0.05 0.53±0.04a 4.328 0.012 72 h 1.18±0.09 0.60±0.06a 9.287 0.001细胞克隆形成数(个)92.55±7.56 53.12±5.46a 7.323 0.002 G0/G1 50.45±4.19 59.36±3.37a 2.870 0.045 S 33.58±3.04 26.48±2.94a 2.908 0.044 G2/M 15.97±2.14 14.14±1.85 1.120 0.325相对迁移率0.89±0.07 0.63±0.05a 5.235 0.006迁移细胞数(个)108.62±10.14 62.24±5.78a 6.883 0.002

图5 AG490减弱三七总皂苷对TGF-β1诱导的HaCaT细胞增殖、周期和迁移的影响Figure5 AG490 attenuatestheeffects of Panax notoginseng saponinson proliferation,cycle,and migration of HaCaT cellsinduced by TGF-β1
3 讨论
皮肤伤口愈合障碍一直是严重的健康问题,它可能导致患者溃疡、复发、截肢甚至死亡[11]。皮肤伤口愈合是一个复杂且精确的调节过程,主要涉及以下四个阶段:止血,炎症,再上皮形成和组织重塑。再上皮化是用新的上皮使伤口重新表面化,角质形成细胞的增殖和迁移是再上皮形成过程中的关键步骤[12]。临床上通过药物、基因、细胞因子和手术作为治疗策略,在伤口愈合的管理方面取得了较大的进步[13]。
三七总皂苷是传统中药三七的有效活性成分,具有止血化瘀、抗炎消肿止痛等功效。以往研究显示,三七总皂苷能够有效促进创伤愈合,然而其作用机制尚不清楚[14-15]。本实验通过TGF-β1诱导HaCaT细胞来构建皮肤损伤模型来探究三七总皂苷在伤口愈合中的生物学功能及潜在机制。在前期预实验中,采用不同浓度的三七总皂苷刺激TGF-β1诱导HaCaT细胞,处理不同时间,最终筛选出三七总皂苷作用浓度为100μg/mL,作用时间为24 h。本实验采用100μg/mL的三七总皂苷干预TGF-β1诱导的HaCaT细胞损伤模型,结果发现,三七总皂苷能够有效提高TGF-β1诱导HaCaT细胞增殖活力,促进HaCaT细胞迁移。表明三七总皂苷具有促进创面再上皮化的潜力。PCNA是一种存在于细胞核中与DNA合成有关的蛋白质,只存在于增殖的细胞中,对启动细胞增殖至关重要,目前已将其作为反映细胞处于增殖状态的重要指标之一[16]。MMP-2和MMP-9均属于基质金属蛋白酶家族成员,两者编码的蛋白质能够有效降解细胞外基质蛋白,赋予细胞转移特性。因此,MMP-2和MMP-9表达水平的升高间接反映细胞具有较高的迁移能力[17]。在本实验中,三七总皂苷能上调TGF-β1诱导的HaCaT细胞中PCNA、MMP-2和MMP-9的表达。再次证实三七总皂苷能促进TGF-β1诱导HaCaT细胞增殖和迁移,具有促进创面再上皮化的潜力。
JAK2信号传导途径是一种经典的信号转导途径,在细胞增殖、迁移和凋亡中起着关键作用[18-19]。据报道,激活JAK2信号通路可促进兔胫骨骨折愈合[20];且激活JAK2信号通路可促进角质形成细胞增殖,这种促增殖作用可被AG490抑制[21]。为探究三七总皂苷的作用机制,本实验采用Western blot检测JAK2信号通路相关蛋白的表达,结果发现,三七总皂苷能够有效逆转TGF-β1诱导的HaCaT细胞中JAK2的磷酸化水平降低,提示三七总皂苷能够激活JAK2信号通路。此外,JAK2信号通路抑制剂AG490可明显减弱三七总皂苷对TGF-β1诱导的HaCaT细胞增殖和迁移的影响。以上实验结果提示,三七总皂苷可能通过激活JAK2信号通路提高TGF-β1干预的HaCaT细胞增殖和迁移能力来促进伤口愈合。
总之,三七总皂苷能有效促进TGF-β1刺激的HaCaT细胞增殖和迁移来促进伤口愈合,其作用机制可能与激活JAK2信号通路有关。本实验表明三七总皂苷可能具有潜在的促进伤口愈合功能,可用于开发新型伤口修复药物。但是,三七总皂苷促进伤口愈合的确切机制仍需要进一步研究来验证。

