钙对成釉细胞系ALC细胞生物学特性的影响
高 震,侯瑞凯,宋索成,4,阮建平
钙是人体的必需元素之一。牙釉质中,由钙离子组成的纳米磷酸钙含量高达90%[1]。钙离子不但可以作为第二信使调控细胞的正常功能,而且是釉质基质能够健康形成及矿化的保证。
钙离子可以促进成釉细胞的分化,减轻成釉细胞中内质网应激通路的影响,可以很好地介导成釉细胞稳态的维持[2]。目前有学者研究发现钠钙交换体广泛分布于细胞中,其双向转运作用可使细胞内外的钙离子快速精准调控,从而保证细胞的稳态[3]。李玲等[4]发现,成釉细胞中的钙离子转运是釉质形成不可或缺的条件,同样细胞内钙离子的稳定和矿化前沿钙离子的供应也离不开钙稳态调节蛋白。研究发现,人体钙摄入不足是导致釉质发育异常的重要原因之一,同时动物实验证明,血浆中长期的高浓度钙可以减轻大鼠氟中毒的表现,低钙摄入可导致大鼠的釉质矿化显著降低并导致氟中毒的进一步加重[5-6]。殷黎静等[7]发现,对于慢性氟中毒的大鼠,加钙拮抗组与对照组相比,大鼠的体重增长速度明显加快,中毒症状明显改善。Al-Ansari等[8-9]发现,当增加局部钙离子的质量浓度后,成釉细胞的功能发生了改善,同时可见钙离子促进了氟化基质的矿化。此外Wu等[10]研究发现纳米级的磷酸钙对革兰氏阳性菌可发挥有效抗菌作用,在pH>5.5的环境下,随pH的上升,钙离子可作为再矿化剂促进已发生脱矿的牙釉质再矿化[11]。然而,目前的大多数研究侧重于钙离子介导的理化改变对氟牙症的影响,但关于钙对成釉细胞分子生物学影响的研究鲜有报道,补钙对成釉细胞的安全性还有待研究。
本研究拟通过改变钙浓度来培养成釉细胞系ALC细胞,观察钙对成釉细胞形态、增殖、凋亡及细胞周期蛋白变化的影响,对未来进一步探究钙对拮抗氟牙症的作用有重要的意义。
1 材料与方法
1.1 实验试剂与仪器
本实验所用的成釉细胞样细胞系ALC细胞由西安交通大学口腔医院黄瑞哲教授课题组惠赠。其他实验用品如下:液氮罐(IKA,德国),电子天平(Thermo Fisher Scientific,美国),DMEM高糖培养基、双抗(青霉素、链霉素)、胰蛋白酶(Hyclone,美国),细胞培养皿、6孔板/96孔板、离心管(Corning,美国),微量加液器(Haier,中国),MDF-1156超低温冰箱(Sanyo,日本),荧光倒置显微镜(Nikon,日本),流式细胞仪(BD,中国),半干转印槽、垂直电泳槽(Bio-Rad,美国),水平电泳槽(北京六一仪器厂,中国),分析纯NaF、分析纯CaCl2(天津市天力化学试剂有限公司,中国),CCK-8(Biosharp生物科技有限公司,中国),胎牛血清(Gibco, 美国),PBS、无水乙醇(Heart,中国),碘化丙啶PI、Hoechst33342(Sigma,中国),兔抗兔Cyclin A多克隆抗体、兔抗兔Cyclin B多克隆抗体、兔抗兔Cyclin D多克隆抗体(CST,美国)。
1.2 实验方法
在维生素D3、甲状旁腺激素、降钙素、雌激素与睾酮等数种激素的联合调节作用下,人体内的血钙水平恒定地维持在约2.50 mmol/L(2.25~2.75 mmol/L)[12-14]。故本研究选择的钙浓度分别为0、2.0、2.5、3.0、3.5 mmol/L。
ALC细胞系是由Akira Nakata从新生小鼠牙胚中分离培养建立的成釉细胞系,调节成釉细胞特异性基因釉原蛋白、釉丛蛋白、釉蛋白的表达,用于体外研究成釉上皮细胞的分化和功能[15-16]。
1.2.1 细胞培养与传代
配制成釉细胞培养基(50 mL含10% FBS的高糖培养基):44 mL培养基中加入5 mL胎牛血清及1 mL双抗(100 U/mL青霉素和100 mg/mL链霉素),-20 ℃保存。氯化钙药品:分别称取0.022 0 g、0.027 5 g、0.033 0 g、0.038 5 g的无水氯化钙,在超净台中分别加入10 mL已配制好的培养基中,得到浓度分别为2.0、2.5、3.0、3.5 mmol/L的CaCl2药品,-20 ℃保存。
细胞复苏:37 ℃水浴复苏液氮冻存细胞,在超净台中将细胞转移至新的离心管,10 mL含10%胎牛血清的高糖培养基稀释冻存细胞中的DMSO,吹打混匀,按大约1×108个/L的密度接种细胞于培养皿中,于培养箱中培养。
细胞传代:显微镜下判断是否进行下一步传代培养,确定需要传代后在超净台中吸弃培养液,加入胰酶,待细胞呈点状后终止消化,将细胞转移至新的离心管,离心弃上清液,重新加入培养基,均分至3个新的培养皿继续培养。如此细胞至少传3代,待细胞状态稳定后,分别用不同浓度钙离子培养基分别处理培养24和48 h后,倒置显微镜下观察细胞形态并在标记好的培养皿的固定位置拍照记录。
1.2.2 钙对ALC细胞生长周期的影响
1.2.2.1 CCK-8检测细胞生存率 在96孔板中分别接种ALC细胞,接种的密度为每孔1.0×103~1.5×103个细胞,待细胞贴壁稳定后吸出原培养基,在各个孔中加入含不同浓度钙离子的培养液100 μL(0、2.0、2.5、3.0、3.5 mmol/L)分别培养ALC细胞24和48 h后,每孔加入10 μL CCK-8试剂,轻微振荡混匀后把培养板放培养箱内4 h后取出,放入酶标仪测定每孔的OD值。
1.2.2.2 Hoechst33342染色 将成釉细胞消化后分别接种于六孔板中,细胞稳定贴壁后,吸弃培养基加入含有不同药物浓度钙离子的新培养基每孔2 mL后放入37 ℃、5%二氧化碳培养箱培养,分别在24和48 h时吸弃培养基,加入浓度为10 μg/L的荧光染料1 mL,放入细胞培养箱中避光染色,吸弃染料用4%多聚甲醛固定,15 min后吸弃固定液,在荧光显微镜下观察并拍照。
1.2.2.3 ALC细胞周期的检测 将本实验ALC成釉细胞在6孔板中培养并用相应浓度的钙离子处理24 h和48 h后,消化离心并重悬于1 mL固定液(0.2 mL PBS+0.8 mL 70%乙醇),振荡混匀后封口膜封口4 ℃过夜。使用流式细胞仪检测前1 000 r/min离心10 min后弃乙醇上清并用预冷PBS洗两次后加入200 μL PBS将细胞吹散,加20 μL RNA酶(50 μg/mL)和20 μL PI染料(50 μg/mL)混合后室温避光染色30 min后离心并弃上清液,加200 μL PBS重悬,经过滤后流式细胞仪分析检测细胞的DNA含量变化,记录细胞周期各时相的比例。
1.2.2.4 细胞周期蛋白的检测 (1)细胞蛋白提取:ALC细胞处理培养24和48 h时进行下一步实验所需的蛋白提取。首先吸弃培养基,用4 ℃预冷的PBS洗细胞2次,向6孔板每孔加200 μL RIPA全蛋白裂解液后将六孔板置于冰上并轻轻转动,直至细胞裂解。将裂解物移入1.5 mL的EP管,置于冰上裂解至少10 min,反复振荡,加速细胞裂解。低温离心机13 000 r/min下离心25 min。根据液体体积加入稀释后的Loading-Buffer。最后将蛋白在100 ℃的金属加热器中煮15 min使其变性后在-80 ℃冰箱保存。(2)蛋白加样电泳:用微量上样器上完样品和蛋白Marker后,恒压80 V持续电泳。(3)转膜:根据Marker指示,当判断出现所需要的目标条带后停止电泳跑胶。随后取出凝胶,去掉不需要的分离胶部分,然后制作滤纸-膜-胶-滤纸的类似“三明治”转膜结构,用玻璃棒赶尽气泡。恒流80 mA,半干转膜1.5 h,转膜完成后用浓度5%牛奶封闭2 h。(4)抗体的孵育及显色:由实验所需目的蛋白的分子质量及Marker来切膜。将膜放入抗体孵育盒后加入各蛋白相应的抗体(一抗1∶500稀释)即抗兔Cyclin A多克隆抗体、抗兔Cyclin B多克隆抗体、抗兔Cyclin D多克隆抗体、抗鼠GAPDH抗体,4 ℃缓慢摇动孵育过夜。次日TBST洗膜3次,每次15 min,根据不同种属的一抗加入相对应二抗,室温条件下在摇床缓慢摇动孵育1.5 h。然后TBST洗膜3次,每次10 min。最后用滤纸吸干PVDF膜上残余的TBST,然后将膜放入ECL显色液中显色,并用化学发光显色仪(天能,中国上海)检测蛋白的表达。
1.3 统计学分析
采用SPSS 25.0软件,方差分析,P<0.05为差异有显著性。
2 结 果
2.1 不同浓度钙离子干预下的细胞形态变化
利用倒置显微镜下分别观察24和48 h后发现0 mmol/L CaCl2组ALC细胞形态呈卵圆或多边形,细胞间连接紧密呈铺路石样生长(图1a、f)。随着时间增加,细胞密度增加,细胞相互交织,当细胞相互接触后形态稍变圆。加药24和48 h在倒置显微镜下观察,各实验组ALC细胞形态未见明显改变(图1b、c、d、e、g、h、i、j)。24和48 h组相比较,48 h组细胞数目增加,但细胞形态未见明显改变,半定量光谱分析后,各实验组间的变化差异无统计学意义(图1~2)。
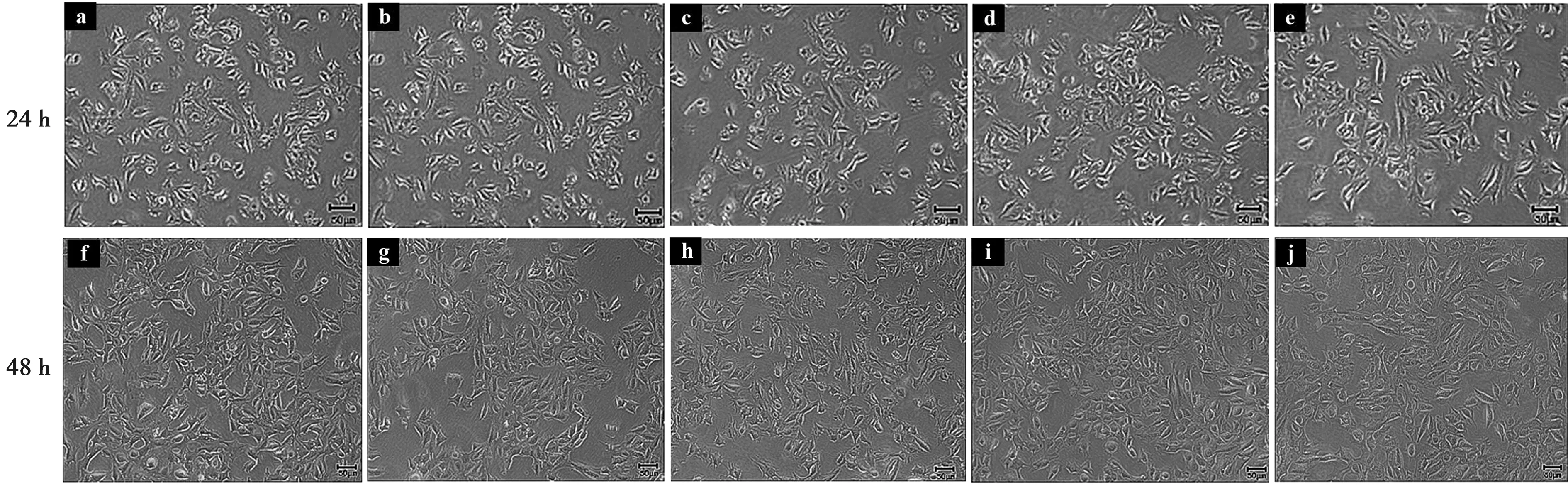
a:0 mmol/L CaCl2;b:2.0 mmol/L CaCl2;c:2.5 mmol/L CaCl2;d:3.0 mmol/L CaCl2;e:3.5 mmol/L CaCl2;f:0 mmol/L CaCl2;g:2.0 mmol/L CaCl2;h:2.5 mmol/L CaCl2;i:3.0 mmol/L CaCl2;j:3.5 mmol/L CaCl2
2.2 CCK-8结果
钙分别干预ALC细胞24 h和48 h后,与对照组相比,实验组ALC细胞的生存率略呈下降趋势,但此趋势无统计学意义(P>0.05)(图3)。
2.3 Hoechst33342染色观察细胞凋亡
在荧光显微镜下观察,已发生凋亡的细胞由于染料进入了细胞核,与DNA相结合被染为蓝绿色,在荧光下这种蓝绿色呈明显高亮状态。观察荧光染色发现,ALC细胞加钙分别干预24 h和48 h后,半定量光谱分析发现,与对照组(图4a、f)相比,干预24 h实验组(图4b、c、d、e、g、h、i、j)各组间ALC细胞中的凋亡细胞差异有显著性,干预48 h,除2.0 mmol/L组,其余各组无显著性差异(图5)。
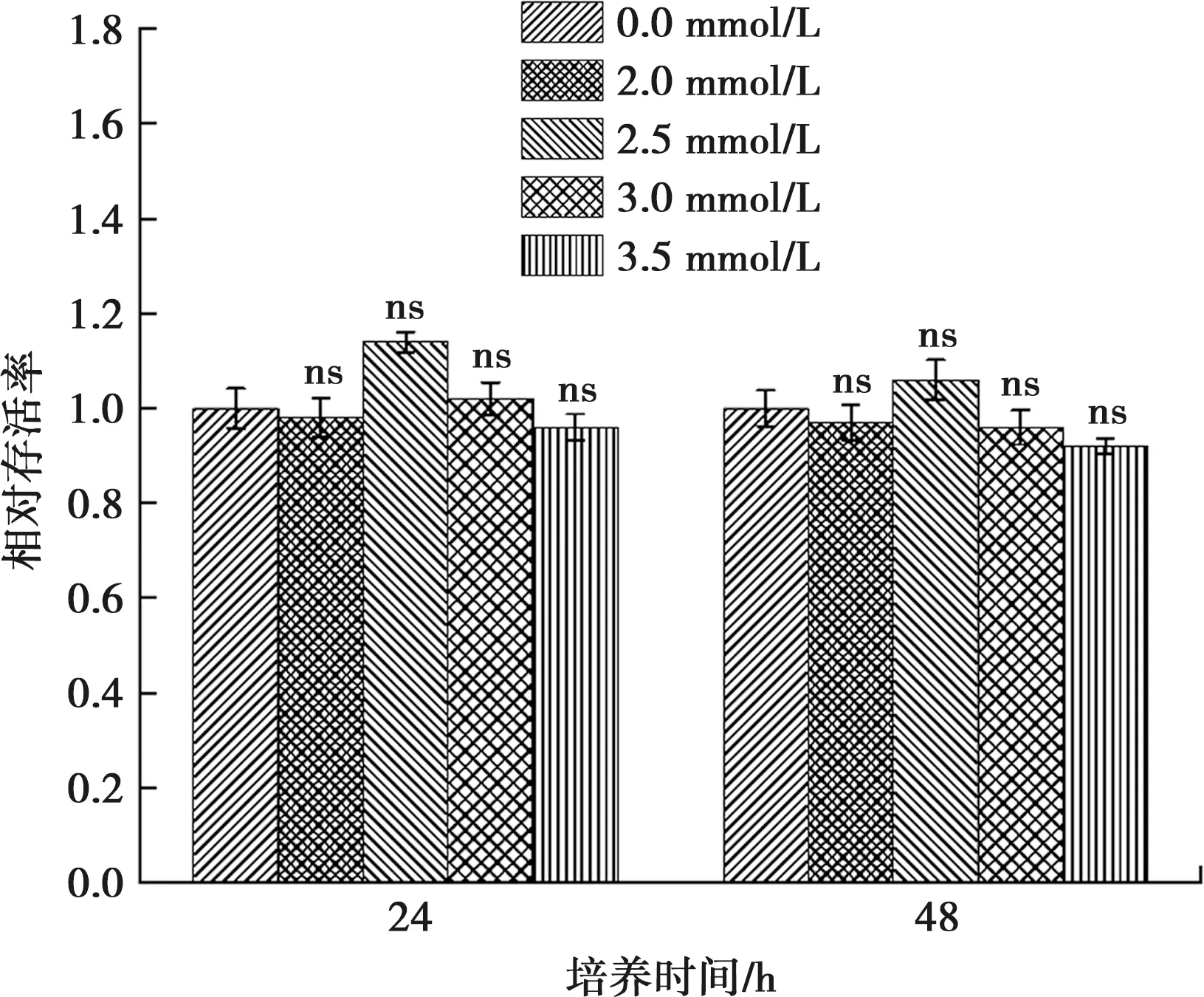
与0 mmol/L Ca2+浓度相比, ns:差异无统计学意义
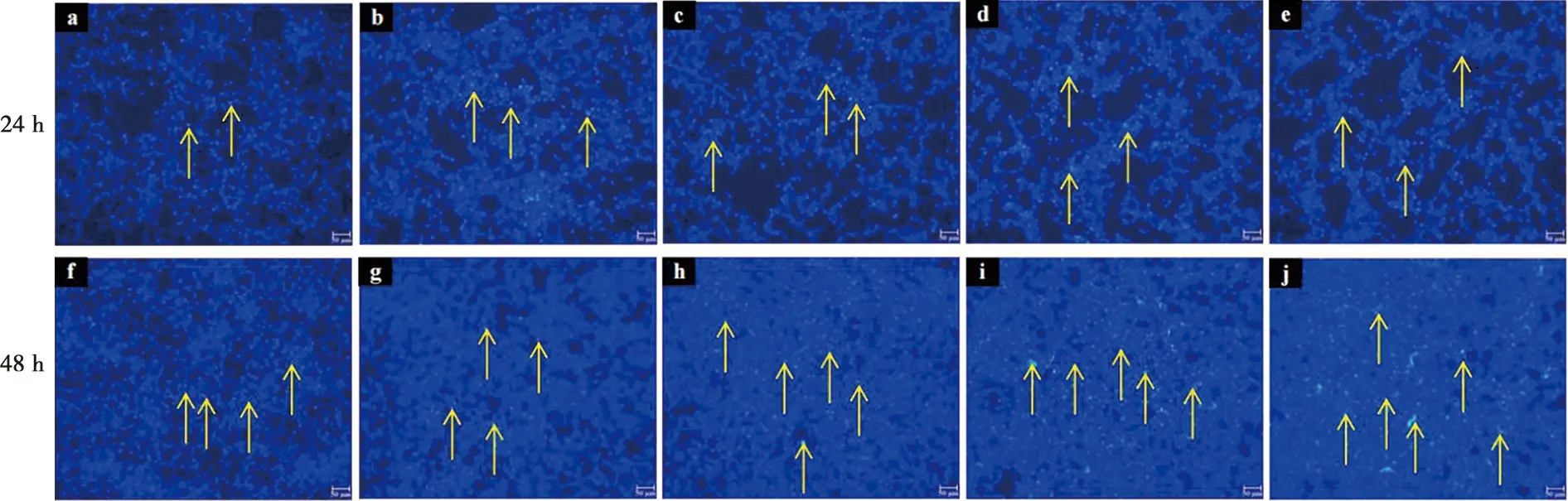
a:0 mmol/L CaCl2;b:2.0 mmol/L CaCl2;c:2.5 mmol/L CaCl2;d:3.0 mmol/L CaCl2;e:3.5 mmol/L CaCl2;f:0 mmol/L CaCl2;g:2.0 mmol/L CaCl2;h:2.5 mmol/L CaCl2;i:3.0 mmol/L CaCl2;j:3.5 mmol/L CaCl2;箭头:凋亡细胞
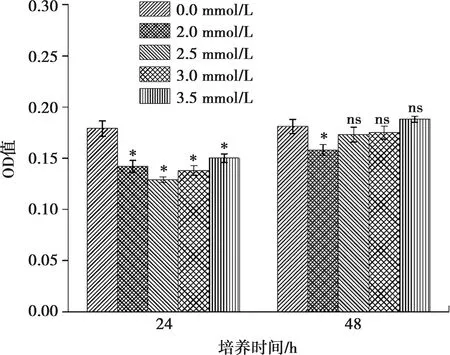
与0 mmol/L Ca2+浓度相比,*:P<0.01, ns:差异无统计学意义
2.4 细胞周期的检测分析
流式细胞仪结果显示:钙离子分别干预ALC细胞24 h和48 h后,随着钙浓度的增加,S期的细胞比例增加,G1期,G2期的细胞比例有所下降(图6~7)。
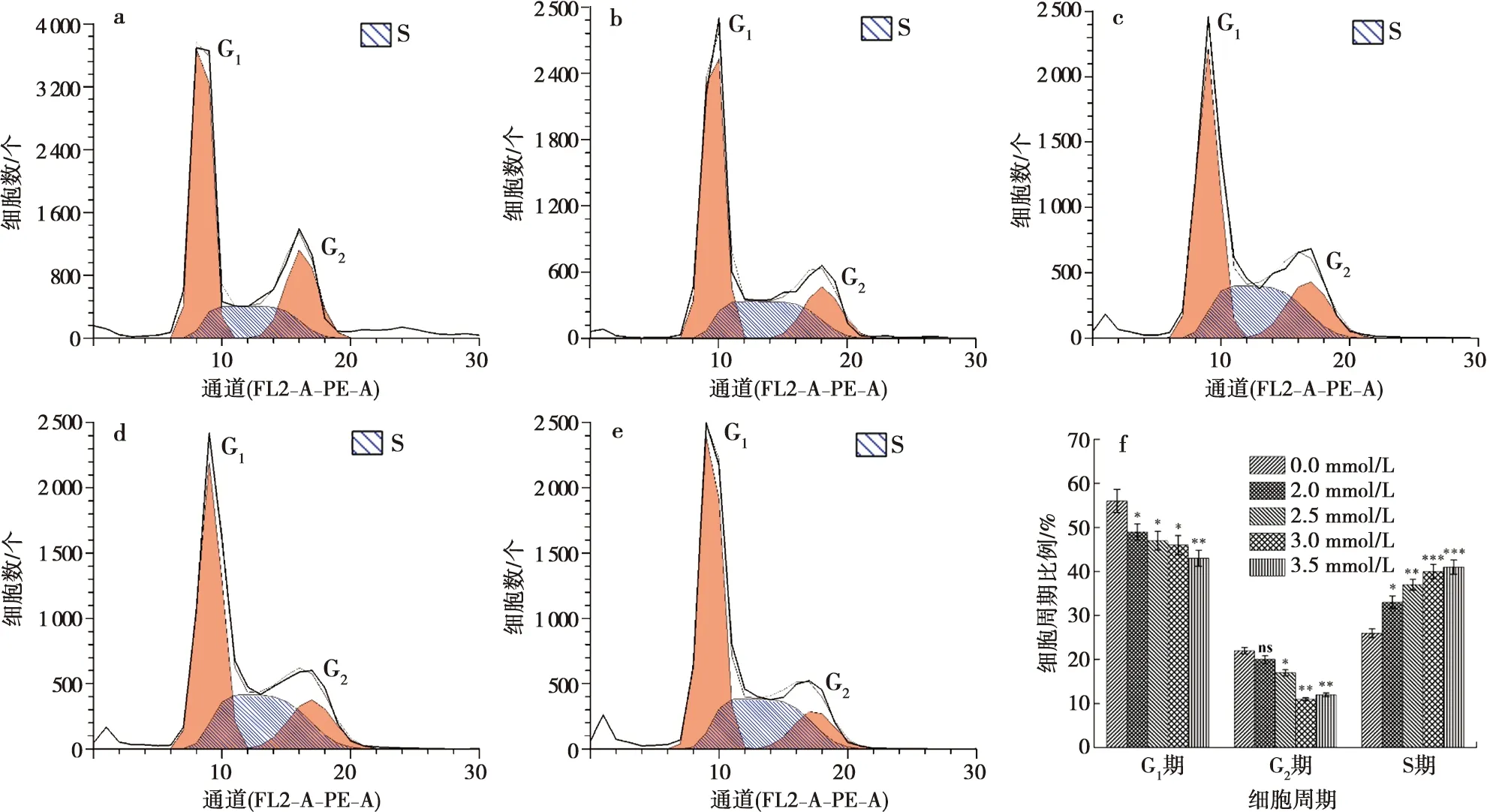
a:0 mmol/L CaCl2;b:2.0 mmol/L CaCl2;c:2.5 mmol/L CaCl2;d:3.0 mmol/L CaCl2;e:3.5 mmol/L CaCl2;f:定量分析;与0 mmol/L Ca2+浓度相比,*:P<0.01, **:P<0.001, ***:P<0.000 1, ns:差异无统计学意义
a:0 mmol/L CaCl2;b:2.0 mmol/L CaCl2;c:2.5 mmol/L CaCl2;d:3.0 mmol/L CaCl2;e:3.5 mmol/L CaCl2;f:定量分析;与0 mmol/L Ca2+浓度相比,*:P<0.01, **:P<0.001,ns:差异无统计学意义
2.5 与细胞生长周期相关蛋白的表达变化
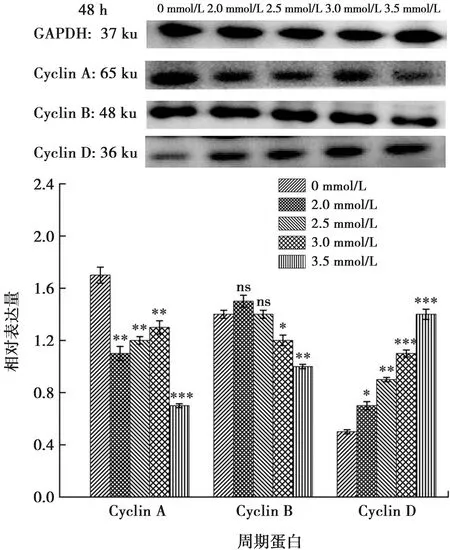
本研究Western blot检测加钙干预ALC细胞24 h和48 h后,实验组的细胞周期蛋白Cyclin A与Cyclin B表达下调,Cyclin D的表达上调(P<0.05)(图8~9)。
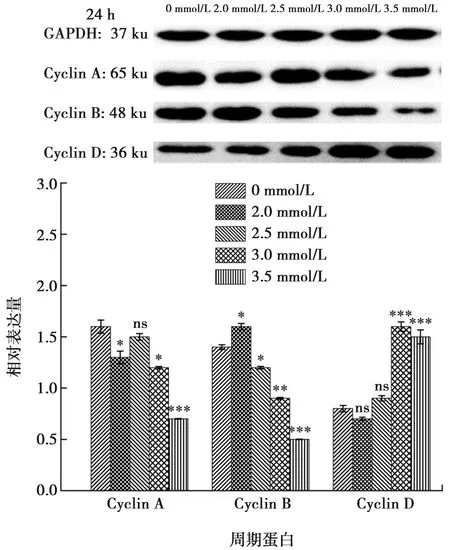
与0 mmol/L Ca2+浓度相比,*:P<0.01, **:P<0.001, ***:P<0.000 1, ns:差异无统计学意义
3 讨 论
ALC细胞在不同的钙离子浓度分别干预24和48 h后,细胞增殖未受明显影响,细胞形态未见明显变化。不同浓度的钙离子组间细胞生长速度及细胞形态肉眼未见明显的差异,表明本实验所选的钙离子浓度对ALC细胞的增殖及形态无明显影响。基于此,为下一步的实验继续使用该实验组钙离子浓度提供了基础。
CCK-8实验结果显示随着钙离子浓度的升高和作用时间的增长,ALC细胞的生存率略呈下降趋势,但下降趋势微弱,各组间差异无统计学意义(P>0.05)。Chen等[17]对原代人成釉细胞进行钙干预,发现钙浓度从0.05 mmol/L增加到0.30 mmol/L时细胞的排列和细胞形态学发生变化。本研究中细胞形态和排列未见明显改变,这可能是由于Chen所研究的是人的原代成釉细胞,而本研究应用的是永生化的成釉细胞,永生化细胞对环境变化耐受更高所致。同时本实验发现细胞增殖较多时可见死细胞数略增加,这符合细胞凋亡的一般规律。
通过荧光染色凋亡细胞,发现随着钙离子对ALC成釉细胞作用时间的延长以及钙离子的浓度的增加,实验组细胞凋亡略呈增加。这与前期的CCK-8实验结果相一致。说明随着钙离子浓度的升高,钙离子可能对成釉细胞有一定的促凋亡作用,但钙对成釉细胞促凋亡的检测罕见文献报道。同时本实验中的细胞凋亡趋势微弱,无明确实验证据证明钙离子对成釉细胞有促凋亡作用,下一步动物实验可继续验证钙离子是否在机体内会发生成釉细胞的促凋亡作用。
与0 mmol/L Ca2+浓度相比,*:P<0.01,**:P<0.001,***:P<0.000 1,ns:差异无统计学意义
通过流式细胞仪检测细胞周期可见,随着实验组钙离子的浓度升高和钙离子作用时间延长,实验组细胞的S期增加,可见钙离子能够促进细胞的DNA合成增加,但同时细胞G1、G2期下降,反馈细胞的RNA及蛋白质减少,这一实验结果提示由于钙离子的作用可将成釉细胞阻滞在S期,进入G2期的细胞减少。本实验结果发现钙离子干扰了成釉细胞的细胞生长周期。
Cyclin家族存在于细胞周期的各时相,Cyclin家族与CDK家族共同促进细胞周期的完成。在Cyclin家族中最常见的蛋白有Cyclin A、Cyclin B、Cyclin D[18-20]。Cyclin A为细胞周期的正调控因子,它与CDK2结合可形成活性激酶复合物,释放出转录因子,促使细胞由S期进入到G2期。本研究中Western blot结果显示钙干预组较对照组Cyclin A蛋白表达下调,提示细胞增殖时由S期进入G2期受阻,这与流式检测细胞周期的实验结果相一致。Cyclin B在从G2期进入到M期的转化过程中发挥着重要作用,在本研究中钙干预组中细胞周期蛋白Cyclin B表达下调,提示由G2期进入M期的细胞减少,细胞分裂受影响。Cyclin D蛋白可调节细胞周期,使细胞周期通过G1期进入S期,本实验钙干预组中Cyclin D的表达上调,提示由G1期进入S期的成釉细胞增加。
目前钙对氟牙症的拮抗作用成为新的研究热点,但是关于钙对成釉细胞的干预方式以及钙是通过何种方式预防氟牙症的发生目前尚不完全清楚。研究证明,本实验所选取的钙离子浓度对成釉细胞的增殖及凋亡未见明显改变,提示钙对成釉细胞无明显毒副作用,对钙拮抗氟牙症提供了安全性保证。同时钙对成釉细胞的细胞周期产生影响,提示钙可能干扰了成釉细胞的分化,这为进一步研究钙对氟牙症的拮抗提供了一定的实验基础和理论依据。

