棉籽蛋白ACE抑制肽的酶法制备及其体外稳定性研究
常 畅,刘治平,陈哲漪,闫巧娟,江正强,*
(1.中国农业大学 食品科学与营养工程学院/中国轻工业食品生物工程重点实验室, 北京 100083;2.中国农业大学 工学院, 北京 100083)
高血压是引发冠心病和脑出血等重大疾病的主要因素,全球约有11.3亿人患有高血压病。2019年,全球由高血压及其并发症导致的死亡人数高达1 080万[1]。血管紧张素转化酶(angiotensin-I-converting enzyme, ACE)是促使人体血压升高的重要分子[2],化学合成ACE抑制剂(卡托普利、赖诺普利)是临床治疗高血压的主要药物,但伴有窦性心动过速和血管神经性水肿等不良反应,长期服用会对患者造成严重的身体和精神负担[3]。食源性ACE抑制肽因安全性高、易吸收、无过度降压危险而备受关注[4]。围绕ACE抑制肽的制备方法、降压机理和构效关系等方面已有大量研究[5],但相关产品不多。源于酪蛋白的缬氨酸- 脯氨酸- 脯氨酸和异亮氨酸- 脯氨酸- 脯氨酸是目前应用最多的ACE抑制肽,如日本生产的乳酸菌饮料、芬兰生产的发酵乳品以及荷兰生产的功能性水溶粉剂,以及美国和法国生产的鲣鱼肽片剂和胶囊。除酪蛋白肽和鲣鱼肽外,其他食源性ACE抑制肽仍处于研究阶段,尚未实现产业化。
我国棉籽产量居世界第一,提油后的棉籽粕蛋白质含量高达60%,高于大豆粕的蛋白质含量。棉籽蛋白的主要成分是球蛋白(质量分数为90%),包括2S(质量分数为30%)、7S和12S(质量分数为60%)球蛋白。棉籽蛋白质量近似于豆类蛋白,营养价值高于谷物蛋白[6]。de Oliveira Filho等[7]通过热处理协同蛋白酶水解制备的棉籽蛋白水解物具有抗氧化和ACE抑制活性,其中,碱性蛋白酶水解物的ACE抑制率高达99.5%。Gao等[8]利用单因素实验结合响应面中心组合设计试验优化木瓜蛋白酶水解条件,制备的FPAIGMK(IC50=38.9 μmol/L)是迄今报道的活性最高的棉籽蛋白ACE抑制肽。目前,酶法制备棉籽蛋白ACE抑制肽的研究较多,但其抑制活性有待进一步提高,且尚未见评价棉籽蛋白水解物及其ACE抑制肽的消化吸收稳定性的研究。食源性ACE抑制肽经口服后需通过胃肠道消化降解、小肠上皮吸收渗透等多重生理屏障,而这些生理屏障会导致活性肽体内稳定性降低,限制人体对活性肽的有效生物利用。研究ACE抑制肽的消化吸收稳定性对于推动活性肽在功能性食品中的应用具有重要作用。
本研究以脱酚棉籽蛋白为原料,拟利用不同蛋白酶水解制备ACE抑制肽并优化其水解条件,通过分离纯化和质谱鉴定,挖掘具有ACE抑制活性的新型肽段,探究其体外消化吸收稳定性,以期为活性肽体内吸收的基础研究和棉籽蛋白在功能性降压食品中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
脱酚棉籽蛋白(总蛋白质质量分数为74.8%),北京中棉紫光生物科技有限公司;Caco-2细胞株,中国科学院细胞库;碱性蛋白酶(Alcalase 2.4L,来源于地衣芽孢杆菌)、复合蛋白酶(来源于芽孢杆菌属)、风味蛋白酶(来源于米曲霉),丹麦Novozymes公司;木瓜蛋白酶、菠萝蛋白酶、胃蛋白酶、胰蛋白酶,上海源叶生物科技有限公司;L-酪氨酸、福林酚、ACE、马尿酰- 组氨酰- 亮氨酸(N-hippuryl-His-Leu hydrate,HHL)、邻苯二甲醛(o-phthalaldehyde, OPA)、胎牛血清、Dulbecco’s modification of eagle’s medium(DMEM)培养基,美国Sigma-Aldrich公司;盐酸、氢氧化钠、乙酸乙酯、四硼酸钠、氯化钠、硼酸、碳酸钠、异丙醇、磷酸二氢钠、磷酸氢二钠、甲醇、甲酸、乙腈等化学试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
pH计,德国赛德利斯北京有限公司;TU- 1901型分光光度计,北京普析通用仪器有限公司;LGJ- 10型冷冻干燥机,北京松源华兴科技发展有限公司;UPC- 900KTA型蛋白纯化系统,美国GE Healthcare公司;Acquity nano型高效液相色谱- 质谱联用仪,美国Waters公司;HH- 1型数显恒温水浴锅,常州荣华仪器制造有限公司;QP- 50型生物培养箱,山东博科集团;TD6M型高速离心机,长沙平凡仪器仪表有限公司;EVOM2型电阻仪、Transwell型培养板(孔径0.4 μm、膜面积1.12 cm2、12孔的聚酯膜),美国Millipore公司。
1.3 实验方法
1.3.1不同蛋白酶水解棉籽蛋白条件的优化
配制质量分数为5%的棉籽蛋白溶液(pH值为7.0),分别加入1 500 U/g碱性蛋白酶、复合蛋白酶、风味蛋白酶、木瓜蛋白酶和菠萝蛋白酶,调节酶解反应体系至不同蛋白酶的最适pH值和温度(表1)。摇床振荡(200 r/min)酶解6 h后,100 ℃水浴加热5 min灭酶,冷却后离心(10 000 r/min,5 min)取上清液,真空冷冻干燥,-20 ℃保存。以水解度、蛋白回收率和ACE抑制率为评价指标,确定最适蛋白酶。

表1 不同蛋白酶的最适水解条件Tab.1 Optimal hydrolysis conditions of different proteases
配制质量分数为5%的棉籽蛋白溶液(pH值8.0),最适蛋白酶加酶量为1 500 U/g,50 ℃分别水解1~6 h,探究水解时间对蛋白回收率和ACE抑制率的影响。再配制质量分数为5%的棉籽蛋白溶液(pH值8.0),最适蛋白酶加酶量为750~3 000 U/g,50 ℃水解5 h,探讨加酶量对蛋白回收率和ACE抑制率的影响。
1.3.2水解度和蛋白回收率的测定
采用OPA法测定水解度(DH)。取400 μL棉籽蛋白水解液(质量浓度为0.2 mg/mL)加入3 mL OPA试剂,反应2 min,在340 nm处测定吸光值。绘制标准曲线:取0~400 μL丝氨酸标准液(质量浓度为0.1 mg/mL)于5 mL试管中,去离子水补足体积至400 μL,加入3 mL OPA试剂,反应2 min,在340 nm处测定吸光值,利用吸光值与丝氨酸浓度绘制标准曲线。水解度的计算方法见式(1)。
(1)
式(1)中,htot是原料蛋白肽键的质量摩尔浓度,mmol/g(棉籽蛋白的htot为7.54 mmol/g);h是水解蛋白相对于原料蛋白的被水解肽键的质量摩尔浓度,mmol/g。
采用微量凯氏定氮法,分别测定水解前的总蛋白质含量和水解后的蛋白质含量,计算棉籽蛋白水解物的蛋白回收率,计算方法见式(2)。
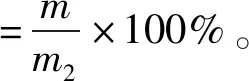
(2)
式(2)中,m1为水解物中蛋白质质量,mg;m2为原料总蛋白质质量,mg。
1.3.3ACE抑制活性的测定
采用HHL方法测定ACE抑制率[9]。将HHL溶于50 mmol/L硼酸盐缓冲液(含300 mmol/L NaCl、pH值8.3),制得5 mmol/L HHL溶液。取20 μL棉籽蛋白水解物溶液(质量浓度为2 mg/mL)与120 μL HHL溶液混合,再加入10 μL ACE溶液(0.1 U/mL),在37 ℃反应60 min。加入150 μL盐酸(1 mmol/L)终止反应,然后加入1 mL乙酸乙酯充分振荡萃取10 s后,在10 000 r/min下离心5 min,收集酯层750 μL烘干。冷却后加入500 μL去离子水溶解残渣,采用紫外分光光度计测定228 nm处的吸光值。以20 μL硼酸盐缓冲液替代棉籽蛋白水解物溶液,作为空白对照。在反应前,加入150 μL盐酸(1 mmol/L)灭活ACE,作为阳性对照。利用样品吸光值(Aa)、空白对照吸光值(Ab)和阳性对照吸光值(Ac),计算ACE抑制率,见式(3)。
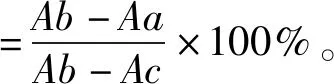
(3)
将样品溶液稀释至不同浓度,测定ACE抑制率,以ACE抑制率为纵坐标,样品浓度的log值为横坐标,利用GraphPad Prism 8.0软件进行非线性拟合计算半抑制浓度(IC50)。
1.3.4棉籽蛋白复合蛋白酶水解物的分离和鉴定
采用快速蛋白液相色谱(fast protein liquid chromatography, FPLC)联用KTA纯化系统,以Sephadex G- 15型(100 cm×12 mm)层析柱,分离50 mg/mL棉籽蛋白复合蛋白酶水解物。分离前,采用0.22 μm微滤膜除杂。上样量为1.5 mL,洗脱液为磷酸缓冲液(10 mmol/L、pH值7.0),洗脱速度为0.8 mL/min,紫外检测波长为280 nm,收集洗脱液,冷冻干燥,测定ACE抑制活性。
利用纳米高效液相色谱- 质谱联用仪,鉴定具有较高ACE抑制活性水解组分的序列组成,色谱柱为Thermo Acclaim PepMap C18型柱(75 mm×2 mm, 3 μm)。将水解组分(质量浓度为0.1 mg/mL)溶于质量分数为0.1%的甲酸水溶液,上样量7 μL。以含有质量分数0.1%甲酸的乙腈溶液为洗脱液,以1 mL/min的速度在65 min内进行梯度洗脱(质量分数1%~35%),通过PEAKS Studio软件分析肽序列。利用AHTpin数据库挑选ACE抑制肽进行合成(国肽生物科技有限公司),测定ACE抑制活性。
1.3.5体外消化吸收稳定性的测定
将2 g NaCl和7 mL体积分数为36%的盐酸溶于去离子水,定容至1 000 mL后,加入3.2 g胃蛋白酶制备胃液(pH值为1.2)。将6.8 g磷酸二氢钾和77 mL 0.2 mol/L氢氧化钠溶于750 mL去离子水,加入10 g胰蛋白酶,并用0.1 mol/L氢氧化钠调节pH值至6.8,定容至1 000 mL制备肠液。将棉籽蛋白复合蛋白酶水解物(质量分数为2.5%)溶于胃液,在37 ℃消化1.5 h,加热至100 ℃灭酶10 min,冷却后离心(10 000 r/min)10 min取上清液,测定ACE抑制率。取10 mL离心前的胃液样品,将pH值调节至6.8,加入10 mL肠液,在37 ℃消化3 h,加热至100 ℃灭酶10 min,冷却后离心(10 000 r/min)10 min取上清液,测定ACE抑制率。
将Caco-2细胞接种于25 cm2卡式培养瓶中,加入体积分数为1%的DMEM培养液(含有100 U/mL青霉素和链霉素)、10%的胎牛血清、1%的L-谷氨酰胺和1%的非必需氨基酸,在37 ℃、95%相对湿度、5% CO2培养箱中培养。当细胞融合度达到70%~80%时,加入质量分数为0.25%的胰蛋白酶消化,调整细胞浓度以3×105个/mL接种于12孔Transwell板的滤膜上。在Transwell板的上室和下室中分别加入0.5 mL细胞悬液和1.5 mL DMEM培养液。培养21 d,利用细胞电阻电压欧姆仪测定跨膜单层细胞电阻值(transepithelial electrical resistance, TEER),明确Caco-2细胞单层膜的紧密性和完整性[10]。分别在Caco-2细胞单层膜的刷状缘膜(AP)侧和基底膜(BP)侧加入HBSS(Hank’s balanced salt solution)缓冲液0.5 mL和1.5 mL,在37 ℃培养箱中培养30 min。细胞活性实验证实棉籽蛋白复合蛋白酶水解物在质量浓度为0.4~2.0 mg/mL时,未对Caco-2细胞显示出细胞毒性(图1)。因此,AP侧加入0.5 mL含有质量分数为1~2 mg/mL棉籽蛋白复合蛋白酶水解物的HBSS缓冲液,BP侧加入1.5 mL空白HBSS缓冲液。在37 ℃培养箱中培养2 h后,取BP侧培养液测定ACE抑制率。以未加入棉籽蛋白复合蛋白酶水解物的样品作为空白对照。

图1 棉籽蛋白复合蛋白酶水解物对Caco-2细胞存活率的影响Fig.1 Effect of cottonseed protein hydrolysate prepared by protamex on cell viability of Caco-2 cells
1.4 数据分析
采用IBM SPSS 22.0软件分析实验数据,每个实验重复3次,数据表示为平均值±标准差。采用一维方差分析(One-Way ANOVA)中的Tukey’s多重比较进行显著性分析,P<0.05表示数据具有显著性差异。
2 结果与分析
2.1 棉籽蛋白的酶解条件优化结果
不同蛋白酶水解棉籽蛋白制备ACE抑制肽的结果如表2。由表2可知,在同等酶活力下,不同蛋白酶水解棉籽蛋白的能力具有显著性差异(P<0.05)。棉籽蛋白水解物的ACE抑制率显著高于未经水解的棉籽蛋白ACE抑制率(15.0%)。风味蛋白酶水解物的水解度(55.6%)和蛋白回收率(43.9%)显著高于其他蛋白酶水解物,但其ACE抑制率较低(47.1%)。木瓜蛋白酶水解物的水解度(33.3%)和蛋白回收率(17.8%)较低,但其ACE抑制率却处于较高水平(70.7%)。复合蛋白酶水解物的ACE抑制率最高(85.7%),水解度(32.5%)和蛋白回收率(40.6%)也处于较高水平。因此,选用复合蛋白酶水解棉籽蛋白制备ACE抑制肽。进一步优化复合蛋白酶水解时间和加酶量,结果如图2。由图2(a)可知,随着水解时间的延长,蛋白回收率缓慢增加,而ACE抑制率在1~5 h内不断升高,在5 h时达到最大值,随后略微降低。当加酶量不断增加时,蛋白回收率不断升高,但ACE抑制率先升高后降低。当复合蛋白酶加酶量为1 500 U/g,水解pH值为8.0,温度为55 ℃,水解时间为5 h时,ACE抑制率最高,为93.7%,蛋白回收率为39.8%[图2(b)]。因此,在复合蛋白酶的最适pH值和温度下,加酶量为1500 U/g,水解棉籽蛋白5 h,棉籽蛋白水解物(质量浓度为2 mg/mL)的ACE抑制率为93.7%。

表2 棉籽蛋白不同蛋白酶水解物的水解度、蛋白回收率和ACE抑制率Tab.2 Effects of proteases on degree of hydrolysis, protein recovery rate, and ACE inhibitory activity of cottonseed protein hydrolysates
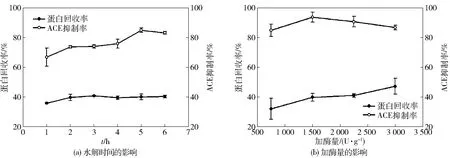
图2 复合蛋白酶水解时间和加酶量对棉籽蛋白水解物的蛋白回收率和ACE抑制率的影响Fig.2 Effect of hydrolysis time and protamex concentration on protein recovery rate and ACE inhibitory activity of cottonseed protein hydrolysates
本研究中,复合蛋白酶水解物的ACE抑制率高于de Oliveira Filho等[7]和Gao等[11]研究中木瓜蛋白酶和风味蛋白酶水解棉籽蛋白的ACE抑制率(55%~74%)。风味蛋白酶具有内切酶和外切酶的作用特性,酶切位点广泛,可产生小肽和游离氨基酸[7,12]。风味蛋白酶的水解效率较高,但过度酶切导致水解物的ACE抑制率显著低于其他蛋白酶水解物[13]。风味蛋白酶的酶切特性导致肽段羧基端的疏水性氨基酸较少,如Leu、Ile、Val,而这些氨基酸是ACE抑制肽的重要组成[14],因此,风味蛋白酶不适用于制备ACE抑制肽。Margatan等[15]研究发现,木瓜蛋白酶仅部分选择性水解棉籽蛋白中的7S球蛋白,导致水解度和蛋白回收率较低。复合蛋白酶和碱性蛋白酶均为内切酶,碱性蛋白酶的酶切位点主要是羧基端的疏水性氨基酸,而复合蛋白酶具有更广泛的酶切位点,可以切割肽键和螺旋结构中的氢键,进而产生具有较高活性的中小型ACE抑制肽[7,12]。综合文献报道和棉籽蛋白不同蛋白酶水解物的实验结果,本研究选用复合蛋白酶水解棉籽蛋白。
2.2 棉籽蛋白复合蛋白酶水解物的分离及肽段鉴定结果

不同数目的*表示水解组分(F1~F5)间的差异显著(P<0.05)。图3 棉籽蛋白复合蛋白酶水解物的分离组分及其ACE抑制活性Fig.3 Fractions of cottonseed protein hydrolysate prepared by protamex and their ACE inhibitory activities
利用液相色谱分离棉籽蛋白复合蛋白酶水解物,得到5个水解组分(F1、F2、F3、F4、F5),分析各组分的ACE抑制活性,结果如图3。由图3(b)可见,各水解组分的ACE抑制活性具有显著性差异(P<0.05),其中,F1组分的ACE抑制活性最低(IC50=599.8 μg/mL),F2、F3和F5组分的活性较为相近(IC50≈316.8 μg/mL),而F4组分的ACE抑制活性最高(IC50=220.1 μg/mL)。经质谱(图4)和AHTpin数据库分析,F4组分的251条肽段中发现3条具有ACE抑制活性且尚未被报道的肽段:VFNNNPQE、LLSQTPRY和VFPGCPET。虽然3条肽段的分子质量较为相近,且肽链长度相同,但表现出不同的ACE抑制活性(P<0.05)(表3),其中,LLSQTPRY具有较高的ACE抑制活性(IC50=105.2 μmol/L)。
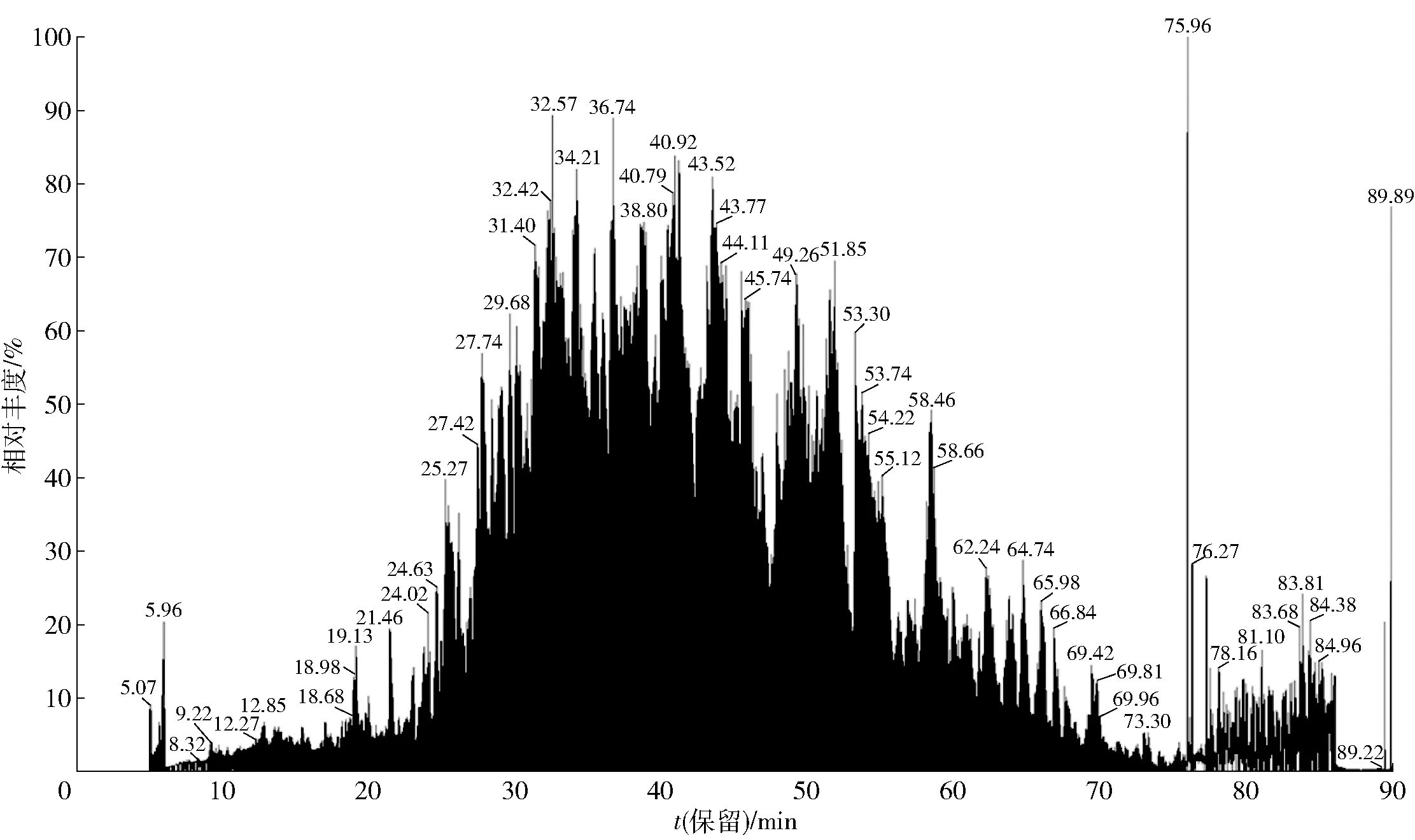
图4 棉籽蛋白复合蛋白酶水解物中F4组分的质谱总离子流图Fig.4 Total ion chromatography of fraction 4 from cottonseed protein hydrolysate prepared by protamex

表3 3种棉籽蛋白活性肽的分子质量和ACE抑制活性Tab.3 Molecular weights and ACE inhibitory activities of three peptides from cottonseed protein hydrolysate prepared by protamex
目前,常用超滤、凝胶层析和离子交换色谱等方法对水解物进行分离纯化,富集ACE抑制肽。Gao等[8,11]利用木瓜蛋白酶水解棉籽蛋白,通过超滤结合凝胶层析的方法分离水解物,得到ACE抑制活性较高的组分(分子质量为0.8~2.4 kDa,IC50=159 μg/mL);利用反相高效液相色谱结合基质辅助激光解吸电离飞行时间质谱,进一步纯化鉴定,发现分子质量为 763 Da 的肽段FPAIGMK具有较高的ACE抑制活性。Ma等[16]利用碱性蛋白酶水解辣木叶蛋白,超滤分离水解物后,收集ACE抑制率(84.7%)较高的水解组分(分子质量<1 kDa)进行肽段鉴定,发现2条新型ACE抑制肽:LGF(IC50=153.7 μmol/L)和GLFF(IC50=139.2 μmol/L)。虽然,上述研究通过蛋白酶水解制备新型ACE抑制肽,但其活性均低于本研究发现的LLSQTPRY。ACE抑制肽一般由2~20个氨基酸组成[17],羧基端具有疏水性氨基酸(Trp、Leu、Ile等),氨基端具有脂肪族氨基酸(Val、Leu、Pro、Ile、Ala、Met)。带正电的氨基酸(Lys、Arg、His)容易接近ACE羧基端活性口袋中带负电的Glu403和Glu162,从而抑制ACE活性[18],而位于羧基端第三位的Pro可通过疏水作用力与ACE活性中心结合,抑制ACE活性[19]。本研究中,VFNNNPQE、LLSQTPRY和VFPGCPET氨基端由脂肪族氨基酸构成,羧基端第三位为Pro,其中,LLSQTPRY含有带正电的Arg。由于亲水性氨基酸(Asn、Tyr、Thr)的存在,3条ACE抑制肽的活性均低于FPAIGMK[8]。然而,LLSQTPRY的ACE抑制活性却高于大豆蛋白和菜籽蛋白等同类蛋白源ACE抑制肽的活性[18,20]。
2.3 棉籽蛋白复合蛋白酶水解物的体外消化吸收稳定性分析
利用人工胃肠液结合Caco-2细胞单层膜模型,评价棉籽蛋白复合蛋白酶水解物的体外消化吸收稳定性,结果如图5。由图5可见,水解物经人工胃肠液消化和Caco-2细胞单层膜转运吸收后,ACE抑制率显著降低(P<0.05)。经人工胃液消化后,水解物的ACE抑制率由93.7%降低至68.4%,经人工肠液进一步消化,最终产物的ACE抑制率为53.8%。利用Caco-2细胞单层膜模型分析水解物在小肠上皮细胞的吸收作用发现,水解物可被刷状缘膜中的细胞肽酶降解,导致ACE抑制率显著降低(P<0.05),但仍保持一定ACE抑制活性(20.5%),水解物浓度对转运吸收作用并无显著性影响(P>0.05)。

不同数目的*表示样品间的显著性差异(P<0.05)。CPH- P,棉籽蛋白复合蛋白酶水解物;CPH- PP,棉籽蛋白复合蛋白酶水解物经人工胃液消化;CPH- PPT,棉籽蛋白复合蛋白酶水解物经人工胃肠液消化;CPH- PH,质量浓度为2 mg/mL棉籽蛋白复合蛋白酶水解物经Caco-2细胞单层膜转运吸收处理;CPH- PL,质量浓度为1 mg/mL棉籽蛋白复合蛋白酶水解物经Caco-2细胞单层膜转运吸收处理。图5 棉籽蛋白复合蛋白酶水解物的体外消化吸收稳定性Fig.5 In vitro digestion and absorption stabilities of cottonseed protein hydrolysate prepared by protamex
由于消化类蛋白酶和细胞肽酶可降解活性肽为短肽或游离氨基酸,许多ACE抑制肽进行体内实验后活性减弱,甚至丧失。ACE抑制肽普遍以水解物形式口服进入人体,需要克服消化道酶和肠道黏膜等一系列屏障,以活性形式转运至体液循环发挥生理作用。本研究中,棉籽蛋白复合蛋白酶水解物经体外模拟消化后,ACE抑制率降低,这与小麦面筋蛋白水解物和酪蛋白水解物结果类似[21-22]。对于消化率较低的蛋白质而言,适度酶解可为后续胃肠消化激发ACE抑制肽释放奠定良好基础。Vermeirssen等[22]和郝欣悦等[23]研究发现,由于胃蛋白酶和胰蛋白酶可将大分子肽降解,米糠蛋白碱性蛋白酶水解物和瑞士乳杆菌干酪水解物的ACE抑制活性和多肽含量在体外模拟消化后显著增加。研究表明,ACE抑制肽的小肠吸收机制主要包括载体介导主动转运、细胞旁路转运和胞饮转运。尽管吸收效率可能受到肽链长度、疏水性和表面电荷等因素的影响,但肽链长度是最关键的因素[24]。本研究中,棉籽蛋白复合蛋白酶水解物中ACE抑制肽多具有较长肽链,难以完整地穿过肠上皮细胞屏障,限制其在Caco-2细胞单层膜上的转运吸收。水解物易被刷状缘膜中的肽酶降解为游离氨基酸[25],ACE抑制活性降低至20.5%。实验所用的Caco-2细胞单层膜比人体肠道细胞更为致密,阻碍部分活性序列转运吸收[22],因此,本研究中的棉籽蛋白复合蛋白酶水解物经实际体内吸收后,也可能表现出较高的ACE抑制活性。
3 结 论
本研究通过复合蛋白酶水解棉籽蛋白制备ACE抑制肽,经酶解条件优化,提高水解物ACE抑制率至93.7%。通过高效液相色谱分离和质谱鉴定,发现3条新型ACE抑制肽:VFNNNPQE、LLSQTPRY和VFPGCPET,其中LLSQTPRY的ACE抑制活性最高(IC50=105.2 μmol/L)。棉籽蛋白复合蛋白酶水解物经人工胃肠液消化和Caco-2细胞转运吸收后,仍保留一定ACE抑制活性。后期可利用微胶囊化技术,通过筛选壁材、调整芯壁比、优化制备方法及条件等,提高棉籽蛋白复合蛋白酶水解物及其ACE抑制肽稳定性和生物利用率。鉴于新型ACE抑制肽较高的活性及其生物利用率,棉籽蛋白复合蛋白酶水解物有望作为功能性食品配料,为降压食品的开发及产业化提供依据。
——全棉籽的加工与利用

