丁香酚对解淀粉芽孢杆菌气液界面生物膜的抑制作用
杨 露,覃书漫,李志洪,杨 倩,张志清,陈安均,黎杉珊,侯晓艳,申光辉
(四川农业大学 食品学院, 四川 雅安 625014)
生物膜是细菌附着于生物或非生物表面,被自身分泌的胞外多糖、蛋白质、胞外DNA等胞外基质大分子包裹形成的有组织的细菌群体[1]。由于受到生物膜基质的保护,膜内菌体对外部环境中抑菌和杀菌物质的耐受能力比游离菌体高几十至上千倍[2]。根据形成界面特性差异,生物膜分为固液界面形成的潜底型生物膜和气液界面形成的表皮型生物膜[3]。芽孢杆菌属细菌广泛存在于各类环境中,极易在合适条件下形成表皮型生物膜,比潜底型生物膜的成膜速度更快,成膜量更高,对食品生产的危害更大。解淀粉芽孢杆菌(Bacillusamyloliquefaciens)是芽孢杆菌属常见细菌种类,尽管国内外鲜见解淀粉芽孢杆菌对人体致病性及其直接危害的报道,但相关菌株的污染可导致食品的腐败变质[4],形成生物胺等有害代谢产物[5],间接危害人体健康;因此,对解淀粉芽孢杆菌表皮型生物膜的控制具有重要研究意义。
食品工业中应用于生物膜控制的传统方法包括物理、化学方法等,但易产生细菌耐药性等问题。天然抗生物膜活性物质较传统方法具有绿色、安全的优势,受到国内外广泛关注[6]。丁香酚是丁香精油等植物精油中的苯丙烷类小分子化合物[7],具有良好的抑菌及抗生物膜活性[8]。Far等[9]研究表明,丁香酚对耐甲氧西林金黄色葡萄球菌的最小抑菌浓度为3.125%~0.010%。Ashrafudoulla等[10]研究发现,质量分数0.1%~0.6%的丁香酚可显著降低副溶血弧菌生物膜形成量。然而,有关丁香酚抑制腐败解淀粉芽孢杆菌生物膜形成及其作用机理的研究较少。
细菌生物膜的形成受菌株特性、黏附界面特性及环境因素影响[11]。其中,细菌运动能力[12]和表面理化特性[13]对细菌早期成膜阶段在界面的黏附过程具有重要影响。本研究主要考察丁香酚对腐败解淀粉芽孢杆菌生物膜形成的抑制及成熟生物膜的清除效果,并重点从细菌运动能力、细胞表面特性变化对腐败菌成膜早期界面黏附过程影响的角度,探讨丁香酚抗解淀粉芽孢杆菌生物膜形成的作用机理,以期为控制腐败芽孢杆菌生物膜形成提供理论参考。
1 材料与方法
1.1 材料与试剂
解淀粉芽孢杆菌DY1a,分离自腐败豆杆制品,保存于四川农业大学食品学院。丁香酚(质量分数≥99.0%),合肥巴斯夫生物科技有限公司;2, 3, 5-三苯基氯化四氮唑(TTC),北京索莱宝科技有限公司;考马斯亮蓝试剂盒,南京建成生物工程研究所;其余试剂均为分析纯,成都市科龙化工试剂厂。
1.2 仪器与设备
Satorius CP225D型电子天平,德国赛多利斯公司;SW- CJ- 2FD型超净工作台,苏净集团苏州安泰空气技术有限公司;SHP- 160型智能生化培养箱,上海三发科学仪器有限公司;Sorvall ST16R型冷冻离心机、Varioskan Flash型荧光酶标仪,美国赛默飞世尔科技公司;Milli- Q型超纯水系统,美国Millipore公司;Nano ZS90型纳米粒度电位仪,英国马尔文帕纳科公司;Eclipse E100型普通光学显微镜,日本尼康公司;KH- 300DE型数控超声波清洗器,昆山禾创超声仪器有限公司;759S型紫外可见分光光度计,上海棱光技术有限公司;ZEISS Sigma 500型场发射扫描电镜,德国卡尔蔡司公司。
1.3 实验方法
1.3.1培养基配制
LB培养基(g/L):牛肉膏3.0、蛋白胨10.0、NaCl 5.0、琼脂15.0,pH值7.4~7.6。
胰蛋白胨大豆肉汤(TSB)培养基(g/L):胰蛋白胨 34.0、大豆木瓜蛋白酶消化物 6.0、NaCl 10.0、KH2PO45.0、葡萄糖 5.0,pH值7.1~7.5。
胰蛋白胨大豆肉汤豆浆(TSBS)培养基A液:豆浆粉50.0 g/L,自然pH值,溶解于1/2最终体积的培养基中。TSBS培养基B液(g/L):胰蛋白胨 17.0、大豆木瓜蛋白酶消化物 3.0、NaCl 5.0、KH2PO42.5、葡萄糖 2.5,溶解于1/2最终体积的培养基中。灭菌后将A液与B液混合,自然pH值。
PCA培养基(g/L):胰蛋白胨 5.0、酵母浸粉 2.5、葡萄糖 1.0、琼脂 15.0,自然pH值。
泳动琼脂培养基(g/L):胰蛋白胨 10.0、NaCl 5.0、 葡萄糖 5.0、琼脂3.0,自然pH值。
丛集琼脂培养基(g/L):胰蛋白胨 10.0、NaCl 5.0、 葡萄糖 5.0、琼脂5.0,自然pH值。
1.3.2最低生物膜抑制质量浓度测定
1) 细菌菌悬液制备。参考汪伦记等[14]的方法,从斜面上挑取菌体接种于LB培养基中,37 ℃、160 r/min 振荡培养24 h。菌悬液4 ℃条件下4 000 r/min离心10 min,菌体沉淀用无菌PBS缓冲液(pH值7.4)洗涤3次后,用无菌PBS缓冲液(pH值7.4)调整菌体OD600 nm至0.10 (5×108CFU/mL)。
2) 最低生物膜抑制质量浓度(MBIC)测定。取0.5 mL丁香酚与3 mL吐温20混合振荡乳化,按二倍稀释法使用灭菌TSBS液体培养基稀释丁香酚至不同质量浓度。向50 mL的无菌烧杯中依次加入5 mL菌悬液、5 mL灭菌TSBS液体培养基、10 mL不同丁香酚质量浓度(3.00、1.50、0.75 mg/mL)的丁香酚- 吐温20- TSBS乳化液,获得丁香酚质量浓度分别为1.500、0.750、0.375 mg/mL的腐败菌培养液(腐败菌菌体最终浓度约为106CFU/mL),以等体积分数吐温20(1.8%)为对照。烧杯使用无菌封口膜密封,置于37 ℃培养48 h,观察生物膜形成情况并拍照。不同处理均重复3次。使用接种环轻挑培养基气液界面,目视观察是否有稳定生物膜形成,并结合生物膜干重法综合判断,将无生物膜形成的丁香酚质量浓度确定为MBIC。将气液表面形成的生物膜小心挑取转移至干燥至恒重的定性滤纸表面,55 ℃干燥至恒重,称量生物膜干质量。
1.3.3生物膜微观形貌观察
将灭菌载玻片(1.97 cm×2.56 cm)斜放入装有20 mL含不同质量浓度丁香酚的TSBS培养基的烧杯中,37 ℃静置培养48 h。缓慢取出载玻片,并用无菌PBS缓冲液(pH值7.4)洗涤附着在载玻片上的生物膜,以去除游离菌体细胞,在超净台自然晾干后,喷金处理,使用扫描电镜观察生物膜表面微观形貌的变化。
1.3.4生物膜内活菌数测定
参照Jha等[15]的方法测定生物膜内活菌数。将分布载玻片特定面积(1.97 cm×2.56 cm)上的生物膜用无菌PBS缓冲液(pH值7.4)轻轻冲洗去除非黏附性的菌体,将生物膜黏附于灭菌棉签头上,转移至3 mL无菌水试管中,300 W超声处理30 min,涡旋振荡20 s,依次进行梯度稀释,吸取20 μL不同稀释梯度的稀释液到PCA平板表面并涂布均匀,37 ℃培养24 h进行菌落计数。
1.3.5生物膜清除能力测定
参考Mohsenipour等[16]的TTC法测定不同质量浓度的丁香酚对形成48 h的生物膜的清除率。向24孔细胞培养板中加入1.5 mL TSBS培养基,并接入0.5 mL细胞浓度106CFU/mL的菌悬液,37 ℃静置培养48 h。用无菌PBS缓冲液(pH值7.4)轻洗生物膜2次,再向各孔加入1.5 mL 无菌PBS缓冲液(pH值7.4)稀释后的丁香酚溶液,37 ℃静置培养24 h,弃去丁香酚稀释液,加入1.5 mL 1.0 mg/mL TTC溶液,置于37 ℃避光反应3 h,测定各孔在490 nm的吸光度,按式(1)计算生物膜清除率。
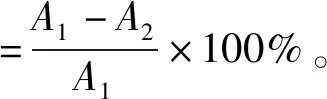
(1)
式(1)中,A1、A2分别为对照组和处理组吸光度。
1.3.6细菌运动性测定
分别配制丁香酚质量浓度为1.500、0.750、0.375 mg/mL的泳动琼脂培养基和丛集琼脂培养基,及106CFU/mL的菌悬液(制备方式同1.3.2)。待泳动琼脂培养基凝固后,风干培养基表面的水分。泳动能力测定:将5 μL过夜培养稀释后的菌液滴在平板中心,待琼脂吸干后,移至37 ℃培养箱中静置培养24 h。丛集能力测定:制备好琼脂培养基后,用无菌牙签蘸取纯化后的芽孢单菌落,刺入丛集琼脂培养基(未刺到底),移至37 ℃培养箱中静置培养24 h。设置对照组,每个质量浓度至少设置3组平行,培养完成后,记录细菌生长情况,测量细菌泳动和丛集圈直径大小,细菌泳动和丛集能力的抑制率计算见式(2)。
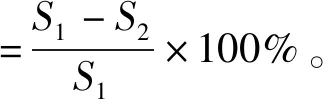
(2)
式(2)中,S1为对照组泳动或丛集圈面积,cm2;S2为处理组泳动或丛集圈面积,cm2。
1.3.7细菌表面特性测定
1) 细胞表面疏水性测定。采用改良的微生物黏附碳氢化合物法测定腐败菌细胞表面疏水性[17]。取3 mLOD600 nm为0.50的菌悬液,加入9 mL用无菌PBS缓冲液(pH值7.4)稀释的不同质量浓度的丁香酚- 吐温20乳液,混匀后37 ℃下孵育4 h,再加入300 μL正十六烷与二甲苯混合有机溶剂(体积比1∶1),涡旋混合2 min,室温下静置15 min使两相分离,取下层水相,采用血球板计数法测定细菌细胞数量,以未添加丁香酚的菌悬液为对照。细菌表面疏水率按式(3)计算。

(3)
式(3)中,C0为添加有机溶剂前菌悬液细胞浓度,个/mL;C1为加有机溶剂处理后下层水相细胞浓度,个/mL。
2) 细胞表面Zeta电位测定。参考宁亚维等[18]的方法,测定腐败菌细胞表面Zeta电位值。取5 mLOD600 nm为0.20的菌悬液与5 mL不同质量浓度的丁香酚- 吐温20乳液混合于50 mL离心管中,在37 ℃、160 r/min振荡孵育2 h,超声分散10 min,测定Zeta电位。
3)细菌自聚集性测定。参考Wang等[19]的方法分析细菌自聚集性。向15 mL试管内加入3 mLOD600 nm为0.25的菌悬液、9 mL用无菌PBS缓冲液(pH值7.4)稀释的不同质量浓度丁香酚- 吐温20乳液,涡旋10 s后从液面以下2 cm处吸取200 μL菌液于96孔无菌聚苯乙烯细胞培养板中,使用酶标仪测定600 nm的吸光度,然后将试管37 ℃水浴孵育6 h,测吸光度,按式(4)计算细菌自聚集率。
细菌自聚集率=(A1-A2)/A1×100%。
(4)
式(4)中,A1、A2分别为孵育前后的吸光度。
1.3.8生物膜基质及胞外溶液中多糖与蛋白质含量测定
多糖和蛋白质测定分别采用苯酚- 硫酸法和考马斯亮蓝法。生物膜基质中多糖与蛋白质含量测定:按照1.3.1培养生物膜,将气液界面形成的生物膜转移到10 mL离心管,加入5 mL质量分数 2% EDTA溶液(含质量分数2% NaCl),37 ℃震荡提取12 h,待生物膜完全溶解,4 ℃、4 000 r/min离心30 min,取上清液测定多糖和蛋白质含量。膜下胞外溶液中多糖与蛋白质含量测定:将表面(气液界面)的生物膜轻轻挑开,用移液枪吸取生物膜下的菌悬液2 mL,10 000 r/min离心10 min,取上清液后,采用相同方法分别测定胞外溶液多糖和蛋白质含量。多糖和蛋白质含量计算分别见式(5)、式(6)。
(5)
式(5)中,ρ1为多糖含量,mg/cm2或mg/mL;m1为样品测定液多糖质量,mg;V1为样品定容体积,mL;V2为样品测定液体积,mL;S为烧杯中生物膜总面积(cm2)或烧杯中胞外溶液总体积(mL);0.9为葡萄糖换算成葡聚糖的校正系数。
(6)
式(6)中,ρ2为蛋白质含量,μg/cm2或mg/mL;A1为测定液的吸光度;A2为空白组的吸光度;A3为标准品的吸光度;ρ为标准品质量浓度,g/L;B为稀释倍数;S为烧杯中生物膜总面积(cm2)或烧杯中胞外溶液总体积(mL)。
1.4 数据处理
所有实验重复3次,结果用平均值±标准差表示。采用IBM SPSS 20.0软件进行方差分析和Duncan多重比较检验(P<0.05),Origin Pro 2019软件绘图。
2 结果与分析
2.1 丁香酚对解淀粉芽孢杆菌生物膜形成能力的影响
豆浆、吐温20及不同质量浓度丁香酚对解淀粉芽孢杆菌气液界面形成的生物膜的影响见图1、图2。由图1可知,与TSB培养基相比,添加豆浆的TSBS培养基表面形成的生物膜厚度明显增加,烧杯侧壁黏附菌体数量增多,表明添加豆浆可促进解淀粉芽孢杆菌在TSB培养基中形成生物膜。与TSBS培养基相比,TSBS- 吐温20培养基表面形成的生物膜无明显变化,表明添加体积分数1.8%吐温20对解淀粉芽孢杆菌生物膜的形成几乎无影响,吐温20可用作丁香酚的乳化剂。添加丁香酚的TSBS培养基表面生物膜形成量明显减少,其中添加1.500 mg/mL丁香酚的TSBS培养基表面无生物膜形成,因此丁香酚对解淀粉芽孢杆菌DY1a生物膜的MBIC为1.500 mg/mL。

图1 培养基添加不同成分对解淀粉芽孢杆菌DY1a生物膜的影响Fig.1 Effects of different components added to culture medium on biofilm of B. amyloliquefaciens DY1a
由图2可知,随着丁香酚质量浓度逐渐提高,解淀粉芽孢杆菌DY1a的生物膜形成量逐渐减小,当添加的丁香酚质量浓度达到MBIC时,无生物膜形成,表明丁香酚对解淀粉芽孢杆菌DY1a生物膜的形成有明显的抑制效果,且抑制强度呈较强的质量浓度依赖性。
2.2 丁香酚对解淀粉芽孢杆菌生物膜微观形态的影响
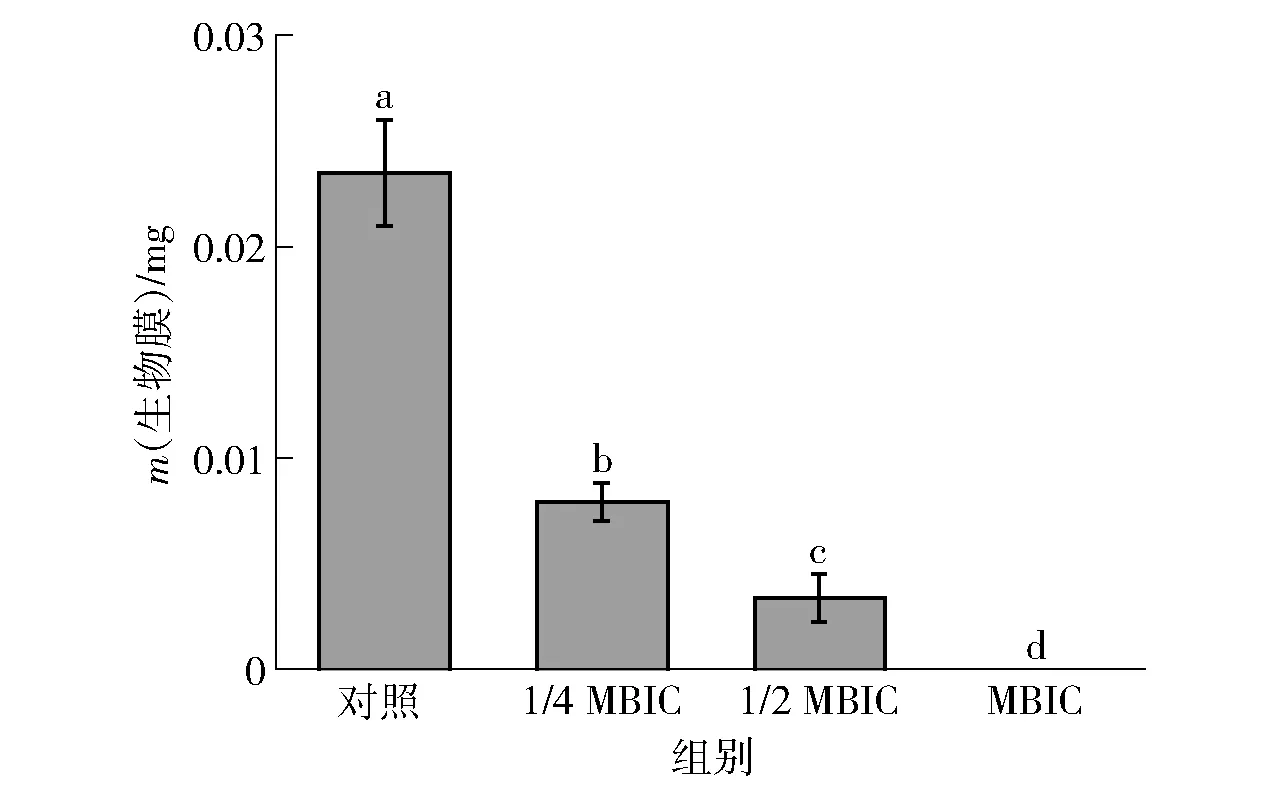
不同字母表示组间数据差异显著(P<0.05)。图2 丁香酚对解淀粉芽孢杆菌DY1a生物膜的影响Fig.2 Effect of eugenol on biofilm of B. amyloliquefaciens DY1a
丁香酚对解淀粉芽孢杆菌DY1a生物膜微观形态的影响见图3。由图3可知,在培养48 h后,丁香酚对细菌气液交界面生物膜的形成量和表面特征产生了显著影响。未添加丁香酚的培养体系气液交界面形成了较厚的生物膜聚合物,整体呈现褶皱状态,1/2 MBIC、1/4 MBIC丁香酚处理组玻片表面较为光滑平整,生物膜变薄。MBIC组仅含有少量游离菌体。随着丁香酚质量浓度提高,生物膜形成量均较对照组明显减少。

图3 丁香酚对解淀粉芽孢杆菌DY1a生物膜微观形态的影响Fig.3 Effect of eugenol on biofilm microstructureof B. amyloliquefaciens DY1a
2.3 丁香酚对解淀粉芽孢杆菌生物膜内活菌数的影响
丁香酚可以通过杀死解淀粉芽孢杆菌抑制生物膜的形成,通过平板计数法可以量化生物膜内活细菌的数量。丁香酚对解淀粉芽孢杆菌生物膜内活菌数的影响见图4。由图4可以看出,在解淀粉芽孢杆菌生物膜形成过程中,不同质量浓度的丁香酚对生物膜内的细菌数量有显著影响(P<0.05)。随着丁香酚质量浓度的提高,膜内的活菌数逐渐减少。在丁香酚质量浓度为1/2 MBIC时,解淀粉芽孢杆菌生物膜内的活菌数为7.81 lg CFU/cm2;1/4 MBIC时,生物膜内的活菌数为8.51 lg CFU/cm2;而未添加丁香酚的对照组(8.73 lg CFU/cm2),其生物膜内活菌数显著高于丁香酚添加组(P<0.05)。由于丁香酚质量浓度为MBIC时,完全抑制了气液界面生物膜的形成,故其生物膜内活菌数未测定。
2.4 丁香酚对解淀粉芽孢杆菌生物膜清除能力的影响
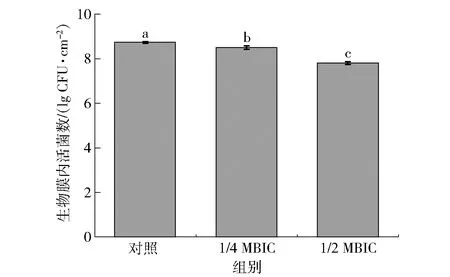
不同字母表示组间数据差异显著(P<0.05)。图4 丁香酚对解淀粉芽孢杆菌DY1a生物膜内活菌数的影响Fig.4 Effect of eugenol on living bacteria embedded in biofilm of B. amyloliquefaciens DY1a
TTC法可对生物膜形成情况进行间接定量检测,TTC可以被活细胞线粒体中与辅酶Ⅱ相关的脱氢酶还原成橘黄色的水溶性甲瓒,而生物膜内活细胞释放的甲瓒可通过比色法评估。丁香酚对解淀粉芽孢杆菌DY1a生物膜的清除能力见图5。由图 5可知,不同质量浓度的丁香酚对培养48 h的成熟生物膜表现出了不同的清除率。当丁香酚质量浓度为MBIC时,生物膜清除率为28.85%,随着丁香酚质量浓度从1/4 MBIC增加到MBIC时,解淀粉芽孢杆菌生物膜的清除率显著提高了18.32%(P<0.05)。
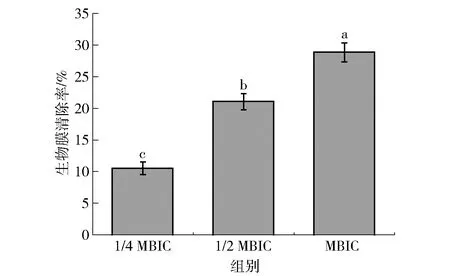
不同字母表示组间数据差异显著(P<0.05)。图5 丁香酚对解淀粉芽孢杆菌DY1a成熟生物膜的清除效果Fig.5 Eradicating effect of eugenol on mature biofilm of B. amyloliquefaciens DY1a
2.5 丁香酚对解淀粉芽孢杆菌细菌运动性的影响
泳动运动(swimming motility)和丛集运动(swarming motility)都是依赖鞭毛使细菌能够找到并促进其在理想位点黏附的运动方式。泳动和丛集运动使细菌能够趋利避害,适应生存环境的快速变化,在细菌生存和定殖中起着关键作用[20]。泳动运动一般表现为细菌个体在液体环境中由鞭毛推动的易位行为,而丛集运动是细菌群体在黏性环境中由鞭毛推动的群集交流运动。丁香酚对解淀粉芽孢杆菌DY1a泳动和丛集运动的影响见表1、图6。由 表1 及图6可知,丁香酚对腐败菌泳动和丛集能力具有显著性抑制作用。随着丁香酚质量浓度增加,泳动培养基平板表面形成的泳动圈直径和面积逐渐减小,添加MBIC的丁香酚可完全抑制腐败菌DY1a的泳动运动。与泳动运动结果类似,随着培养基丁香酚质量浓度的增加,腐败菌从集圈直径和面积逐渐减少,其中添加MBIC的丁香酚对腐败菌丛集运动的抑制率可达97.50%。

图6 丁香酚对解淀粉芽孢杆菌DY1a泳动和丛集运动的影响Fig.6 Effect of eugenol on swimming and swarming motility of B. amyloliquefaciens DY1a
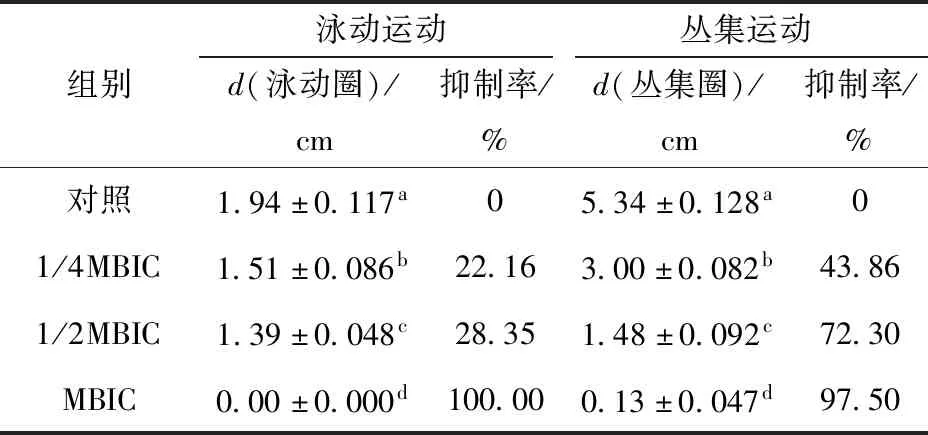
表1 丁香酚对解淀粉芽孢杆菌DY1a泳动和丛集运动的抑制率Tab.1 Inhibition ratio of eugenol on swimming and swarming motility of B. amyloliquefaciens DY1a
2.6 丁香酚对解淀粉芽孢杆菌细胞表面特性的影响
细菌之间及其与界面间的初始相互作用在很大程度上取决于细菌的表面性质[21],包括表面疏水性和表面电荷。丁香酚对解淀粉芽孢杆菌细胞表面特性的影响见图7。由图7(a)可知,丁香酚对细胞表面疏水性有显著影响(P<0.05),当丁香酚质量浓度从1/4 MBIC增加到MBIC时,细胞表面疏水性从38.49%逐渐减少到19.88%,而未添加丁香酚的对照组其表面细胞疏水性(47.90%)显著高于丁香酚添加组(P<0.05)。
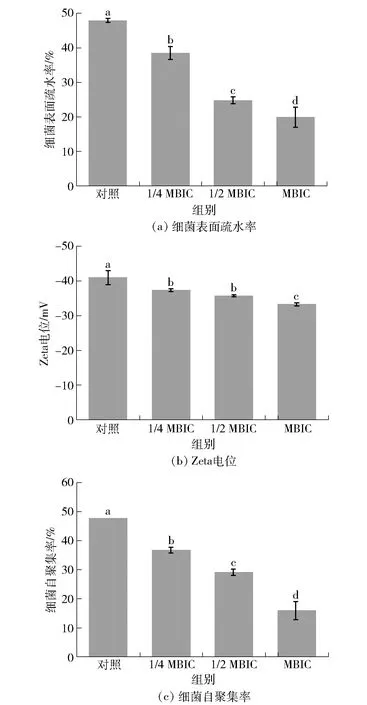
不同字母表示组间数据差异显著(P<0.05)。图7 丁香酚对解淀粉芽孢杆菌DY1a细胞表面特性的影响Fig.7 Effect of eugenol on cell surface properties of B. amyloliquefaciens DY1a
Zeta电位大小可反映细胞表面净电荷多少,可作为细菌之间相互排斥或吸引力强度的度量。不同处理组细菌Zeta电位均为负值,这可能与细胞表面存在的羧基、磷酸盐等电负性基团有关[22]。由图7(b)可知,未添加丁香酚的对照组表面Zeta电位绝对值为41.00 mV,经丁香酚处理后细胞表面Zeta电位绝对值降低,随着丁香酚质量浓度从1/4 MBIC增加到MBIC,细胞表面Zeta电位绝对值由37.40 mV降至33.33 mV,且丁香酚对细胞表面电位绝对值的影响大小与质量浓度呈负相关。
细菌自聚集是促成生物膜群落的形状和成熟的重要因素之一,较强的自聚集有助于形成更加结实致密的生物膜[23]。由图7(c)可知,添加丁香酚显著减弱了细菌的自聚集性(P<0.05),当丁香酚添加质量浓度从1/4 MBIC增加到MBIC时,细菌自聚集性从36.73%逐渐减小到15.93%。根据热力学理论,细胞表面疏水性的减弱会降低细胞间表面张力,并增强细胞与周围液体培养基之间的张力[24],使细胞悬浮液保持均匀分散所需的能量减少,更易保持悬浮状态,进而表现出自聚集能力的降低。
2.7 丁香酚对解淀粉芽孢杆菌胞外多糖与蛋白质含量的影响
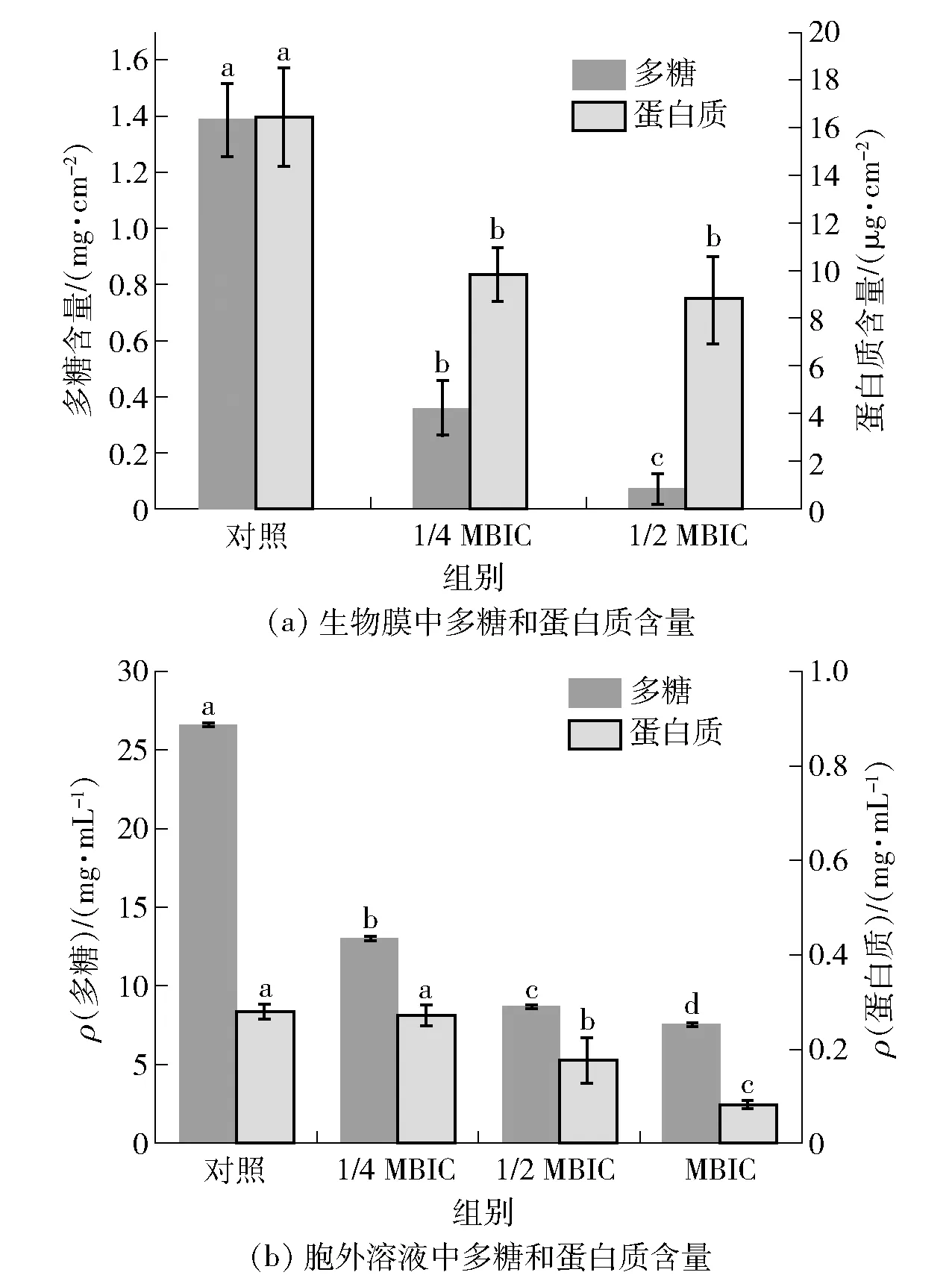
不同字母表示组间数据差异显著(P<0.05)。图8 丁香酚对解淀粉芽孢杆菌DY1a多糖和蛋白质含量的影响Fig.8 Effects of eugenol on polysaccharide and proteincontents of B. amyloliquefaciens DY1a
胞外聚合物(extracellular polymeric substance,EPS)是生物膜细胞的骨架,使得生物膜具有稳定的结构,并保护膜内微生物,EPS由胞外多糖、蛋白质等成分组成,生物膜的EPS含量以多糖和蛋白含量进行表征。丁香酚对生物膜中和胞外多糖和蛋白质的含量有显著影响(图8)。由图8(a)可知,当丁香酚质量浓度从1/4 MBIC增加到1/2 MBIC时,生物膜中的多糖和蛋白质含量随着丁香酚质量浓度的增加而逐渐减少,而未添加丁香酚的对照组生物膜中的多糖和蛋白质含量显著高于丁香酚添加组。添加MBIC质量浓度的丁香酚完全抑制了气液界面生物膜的形成,该质量浓度下生物膜中多糖和蛋白质含量未测定。此外,细菌胞外多糖和蛋白质不仅是生物膜基质的重要组成成分,同时与菌体在生物膜形成的早期初始黏附阶段和界面的黏附过程有关。因此,本研究进一步分析了未成膜的浮游菌体向培养环境中分泌的胞外多糖和蛋白质含量。由图8(b)可知,添加丁香酚的培养体系胞外溶液中多糖和蛋白质质量浓度显著低于未添加丁香酚的对照组,表明丁香酚显著抑制了浮游菌体分泌至周围液体培养环境中的胞外多糖和蛋白质质量浓度。结果表明:丁香酚可抑制生物膜基质多糖和蛋白质的合成与分泌,进一步影响了细菌初始黏附过程,导致成熟生物膜形成的延迟或缺失。
3 讨 论
细菌生物膜的形成包括可逆黏附、不可逆黏附、早期生物膜的形成、成熟生物膜的结构化以及主动播散5个阶段[25]。浮游菌体通过集群性聚集不可逆地黏附于成膜界面是生物膜形成早期的重要行为,受细胞趋化运动能力、细胞间相互黏附力及胞外多糖等生物膜基质大分子合成及分泌等因素的影响。气液界面形成的生物膜与细菌趋氧生长特性有关[26]。Nitai等[27]通过自制拍照系统对液体培养基中芽孢杆菌气液界面生物膜早期静态生长期进行了延时观察,发现生物膜形成早期会在气液界面中部出现大量细胞聚集体,并通过群集性产生漩涡运动加速生物膜形成过程,认为这种集群运动现象依赖于鞭毛。因此,气液界面生物膜形成过程中,界面下的浮游菌体通过集群运动移动至气液界面形成聚集体更为关键。本研究结果表明:1.500 mg/mL的丁香酚分别显著抑制了解淀粉芽孢杆菌100.00%和97.50%的泳动和丛集运动能力,并进一步降低了菌体的自聚集能力。Fekrirad等[28]研究发现:1.25 μg/mL和2.50 μg/mL的丁香酚可显著抑制粘质沙雷菌的丛集运动,并且通过下调鞭毛运动的相关基因(bsmA、bsmB、fthD、fimC)的表达抑制生物膜的形成。Liu等[29]发现,丁香酚对单增李斯特菌CMCC54004生物膜也具有良好的抑制效果,1.28 mg/mL的丁香酚分别抑制100.0%的泳动运动和50.3%的丛集运动能力。
细胞表面疏水性与细菌黏附和表面定殖高度相关,细菌黏附能力随着细胞表面疏水性的增加而增加[30]。本研究结果表明:添加0.375~1.500 mg/mL的丁香酚使解淀粉芽孢杆菌细胞表面电负性降低8.78%~18.70%,疏水性下降19.65%~58.50%。细胞表面疏水性强弱与细胞表面的蛋白质、脂多糖等有关。在不少精油抗生物膜研究中也发现,生物膜形成的减少伴随着细菌表面疏水性下降及负电荷减少,Araby等[31]研究发现,5~25 μL/mL迷迭香精油可与菌体表面蛋白质相互作用,导致细菌细胞表面暴露在外的疏水性基团减少,亲水性基团增加,疏水性降低13.4%~58.2%。Ashrafudoulla等[10]发现丁香酚能抑制耐药副溶血性弧菌生物膜的形成,0.6%的丁香酚能显著降低32%~41%的细菌表面疏水性。正常生理条件下,细菌细胞表面分布带有电负性基团的脂多糖、糖蛋白等分子而呈较强的电负性[32]。丁香酚分子中存在游离羟基[33],当丁香酚与细菌表面相互作用时,吸引带正电的基团产生重排现象,从而导致解淀粉芽孢杆菌细胞表面电负性降低,疏水性下降。
丁香酚对解淀粉芽孢杆菌生物膜外培养基及生物膜内基质的胞外多糖和蛋白质合成均有干扰抑制作用,0.750 mg/mL丁香酚分别显著抑制了生物膜基质和胞外溶液中的胞外多糖(94.8%和67.3%)和蛋白质(46.7%和36.9%)含量。Ashrafudoulla等[10]也有类似发现,添加0.6%丁香酚可使副溶血性弧菌ATCC27969和NIFS29的胞外多糖含量分别降低78%和71%,表明丁香酚不仅可以影响浮游菌体早期黏附聚集过程,同时干扰了生物膜内部处于非运动状态细胞合成生物膜基质大分子的能力。另外,1/2 MBIC丁香酚的添加改变了生物膜表面形貌,靠近空气面表面褶皱明显减少,变得较为光滑。此外,在丁香酚质量浓度为1/2 MBIC和1/4 MBIC条件下,丁香酚对丛集能力的抑制效果优于对泳动能力,主要是因为丛集运动不仅受到鞭毛的影响,还受表面湿度的影响[32],胞外多糖可作为湿润剂为琼脂中游动的细菌提供一层薄薄的液体润滑,促进丛集运动的延伸迁移,因此丁香酚在抑制鞭毛运动的同时,还可能抑制了胞外多糖的分泌,双重作用抑制了丛集运动。
本研究从细菌运动及菌体表面特性变化的视角解释了丁香酚对解淀粉芽孢杆菌生物膜的抑制作用。气液界面生物膜的形成相较于固液界面生物膜更为复杂。目前关于丁香酚抑制解淀粉芽孢杆菌气液界面生物膜机制的理论研究相对较少。因此,通过转录组、代谢组等组学技术进一步揭示丁香酚对解淀粉芽孢杆菌气液界面生物膜形成相关基因的调控机理十分必要。此外,虽然解淀粉芽孢杆菌是导致豆制品变质的主要腐败菌,但并未将丁香酚应用到豆制品的保鲜防腐实验中进行验证,因此丁香酚在实际生产中的应用效果有待进一步验证。
4 结 论
丁香酚对豆制品腐败菌解淀粉芽孢杆菌DY1a气液界面生物膜具有良好的抑制和清除活性, MBIC为1.500 mg/mL,在该质量浓度下对成熟生物膜的清除率为28.85%。丁香酚通过干扰与生物膜形成早期细胞黏附和聚集过程相关的运动能力,减弱细胞表面疏水性和负电位,抑制胞外多糖和蛋白质合成,最终抑制或延缓生物膜的形成。丁香酚在豆制品等食品加工中芽孢杆菌生物膜的污染控制方面可能具有较强的应用潜力。

