白黄链霉菌TD- 1产帕马霉素对黄曲霉2219等霉菌的抑制作用
刘 彤,李王强,刘 丹,刘秀雨,路来风,2,李贞景,2,郭庆彬,2,王昌禄,2,*
(1.天津科技大学 食品科学与工程学院, 天津 300457;2.天津科技大学 省部共建食品营养与安全国家重点实验室, 天津 300457)
在适宜的温度和湿度条件下,小麦、玉米等食品原料在生长期和储藏期都容易受到真菌侵染和真菌毒素的污染[1]。常见的产毒素菌种有镰刀菌(Fusariumspp.)、青霉菌(Penicilliumspp.)和曲霉菌(Aspergillusspp.)[2],其中黄曲霉(Aspergillusflavus)广泛分布于土壤、空气和腐烂的植物残渣中,其代谢产物——黄曲霉毒素被认为是对人类健康有直接危害的真菌代谢物,黄曲霉毒素B1(aflataxin B1,AFB1)毒性最强[3-5]。
为从源头上防止真菌及其毒素对食品的污染,可在原料收获前后就对产毒真菌进行控制。如在种植过程中,采取轮作、农田灌溉、适当的杂草控制等措施[6];在储存期间,采用快速干燥、添加化学物质或利用微生物等方法来防止真菌生长和毒素产生[7]。以化学物质为基础的防治仍然是预防食品中各种真菌毒素污染的常用措施,但化学物质的应用不仅增加了食品中有毒残留物的风险,而且还导致真菌耐药性。我国近年来在限制谷物和食品中使用化学杀菌剂方面做出了很大努力。
微生物作为天然产物的主要来源之一,在防治真菌及真菌毒素污染方面引起了广泛关注。在现有研究中,分离到对霉菌有抑制作用的微生物主要有芽孢杆菌、乳酸菌、酵母菌、链霉菌等[8-11]。在各种微生物中,链霉菌(Streptomycesspp.)作为放线菌中种类最多、最典型的革兰氏阳性需氧菌,在自然界中分布广泛[12]。链霉菌次级代谢途径复杂,可产生丰富的代谢产物,如抗生素、抗肿瘤剂、酶抑制剂、除草剂和杀虫剂等,通常不会产生对环境有污染的有毒残留物,在医药、农业、食品、化妆品等领域应用广泛[13-15]。
微生物可通过产生活性物质抑制霉菌的生长,活性物质主要包括蛋白酶[8]、挥发性有机物[13]、有机酸[9]、抗生素[16]等。帕马霉素是1979年Mccan等[17]从白黑链霉菌ATCC 12461(StreptonycesalbonigerATCC 12461)中分离到的一种新型抗生素。该抗生素对分枝杆菌、真菌和革兰氏阳性细菌具有活性,并能刺激真菌气生菌丝的形成[18]。随着分子质量的增大,帕马霉素稳定性增强,但抗菌活性减弱。
本研究以具有自主知识产权的白黄链霉菌TD- 1为研究对象,利用薄层色谱、硅胶柱层析、高效液相色谱和液相- 质谱联用等技术手段对链霉菌中的活性物质——帕马霉素进行分离,探明其对黄曲霉2219等霉菌的抑制机制,包括对霉菌细胞壁、细胞膜、线粒体等的影响以及对黄曲霉毒素含量和合成调控基因的影响。本研究从已报道的白黑链霉菌[19]、林可链霉菌[20]外的具有自主知识产权的白黄链霉菌TD- 1中分离纯化出帕马霉素,并初步研究其对黄曲霉2219等霉菌的抑制机理。希望本研究可为开发新型生物防霉剂,降低我国粮食损失,防止食品原料受到霉菌及毒素污染,保证食品安全提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1供试菌株
白黄链霉菌TD- 1,从天津市宝坻区饲料厂周围土壤中分离筛选得到。专利菌株保藏编号是 CGMCC No.4666。
黄曲霉,购于中国工业微生物菌种保藏管理中心(CICC NO. 2219);桔青霉(Penicilliumcitrinum)、黑曲霉(Aspergillusniger)、灰霉(Botrytiscinerea)、哈茨木霉(Trichodermaharzianum)、米曲霉(Aspergillusoryzae)为实验室保存菌种。
1.1.2主要培养基
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯,200.0 g;葡萄糖,20.0 g;琼脂,30.0 g;自来水,1 000 mL;pH值自然,121 ℃灭菌20 min。
ISP4培养基:可溶性淀粉,10.0 g;K2HPO4,1.0 g;MgSO4·7H2O,1.0 g;NaCl,1.0 g;(NH4)2SO4,2.0 g;CaCO3,2.0 g; FeSO4·7H20,1.0 mg;MnCl2,1.0 mg;ZnSO4·7H20,1.0 mg;自来水,1 000 mL;pH值7.2,121 ℃灭菌20 min。
SGG培养基:可溶性淀粉,10.0 g;葡萄糖,10.0 g;甘油,10.0 g;玉米浆粉,2.5 g;蛋白胨,5 g;酵母膏,2.0 g;NaCl,1.0 g;CaCO3,3.0 g;自来水,1 000 mL;pH值7.2,121 ℃灭菌20 min。
PBS缓冲液:NaCl,8.0 g;KCl,0.2 g;Na2HPO4,1.44 g;KH2PO4,0.24 g;蒸馏水,1 000 mL;pH值7.4。
1.1.3主要试剂
罗丹明123、碱式磷酸酶试剂盒,北京索莱宝生物科技公司;甲醇(色谱纯)、乙酸乙酯(分析纯)、正己烷(分析纯)、二异丙胺(分析纯),天津康科德科技有限公司;乙酸铵(色谱纯),阿拉丁试剂有限公司。
1.2 仪器与设备
1200型高效液相色谱仪,美国Agilent公司;IT- TOF型高分辨液质联用仪,日本岛津公司;FEI_Apreo型场发射高分辨扫描电子显微镜,美国捷克公司;070- 851型PCR仪,德国Biometra公司;MX3000P型荧光定量PCR仪,美国Agilent公司。
1.3 实验方法
1.3.1霉菌抑制效果的测定
白黄链霉菌TD- 1在SGG液体培养基中培养 4 d,发酵液过0.22 μm无菌滤膜。利用滤纸片法在PDA平板上进行抑制霉菌实验,将200 μL白黄链霉菌TD- 1发酵液均匀涂布在PDA平板上,在每个平板的滤纸片中分别加入5 μL黄曲霉2219、桔青霉、黑曲霉、灰霉、哈茨木霉和米曲霉的孢子悬浮液(1×106CFU/mL),每个平板均匀放置3个滤纸片。28 ℃下培养4 d,利用十字交叉法测量霉菌菌落直径,计算菌落生长抑制率[21],见式(1)。
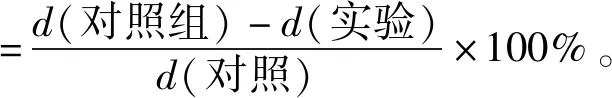
(1)
式(1)中,d(对照)为对照组菌落直径,cm;d(实验)为实验组菌落直径,cm。
1.3.2活性物质的分离纯化及鉴定
从SGG培养基中培养4 d的白黄链霉菌TD- 1发酵液中提取活性物质,发酵液经6 000 r/min离心20 min,取上清液,利用乙酸乙酯和甲醇分别对上清液和菌丝体进行提取。乙酸乙酯和上清液的体积比为2∶1,甲醇和菌丝体的体积比为10∶1,提取液经旋转蒸发浓缩后用甲醇复溶,合并提取物。利用硅胶柱层析对提取液进行分离,洗脱剂为V(乙酸乙酯)∶V(正己烷)∶V(二异丙胺)=1∶40∶0.5,用量20 mL,周期2 s/滴,洗脱后的馏分经真空浓缩,甲醇复溶,获得混合物,利用高效液相色谱(high performance liquid chromatography, HPLC)及液相- 质谱联用仪(liquid chromatography-mass spectrometry, LC- MS)进行检测。
色谱条件:5020- 8973 Inertsustain AQ- C18型色谱柱(250 mm×4.6 mm,5 μm);DAD检测器波长,215 nm。进样梯度:质量分数0.2%的乙酸铵与甲醇体积比为3∶7。进样量20 μL,时间30 min,流速1 mL/min,柱温35 ℃。
质谱条件:离子模式为ESI+、ESI-,质量扫描范围m/z100~1 000 u,雾化器流速1.5 L/min,干燥气压强115.0 kPa,离子源温度200 ℃。
1.3.3霉菌最小抑制浓度的测定
将帕马霉素质量浓度利用二倍稀释法分别调整为2.000、1.000、0.500、0.250、0.125、0 mg/mL,利用96孔板微量稀释法测定帕马霉素对6种霉菌的最小抑制浓度(minimal inhibitory concentration, MIC)。以0 mg/mL为甲醇溶剂处理组,不添加帕马霉素作为空白对照组,36 h后没有变混浊的孔即MIC。
1.3.4霉菌细胞形态的观察
利用滤纸片法进行帕马霉素抑制霉菌实验,28 ℃培养4 d后从平板上挑取菌丝。利用Li等[22]方法进行扫描电镜观察。用质量分数为4%的戊二醛4 ℃下固定12 h,冷冻干燥24 h,研磨成粉。用棉签蘸取少量菌丝体粉末,将各个样品用导电胶固定在铝台上。用吸耳球吹打掉多余的粉末,离子溅射仪喷金后,置于扫描电子显微镜平台上进行观察。
1.3.5霉菌细胞膜通透性的测定
通过测定细胞悬浮液的OD260检测霉菌细胞膜通透性的变化[23]。在PDA平板表面均匀涂布帕马霉素,待挥干后贴上玻璃纸。在玻璃纸上接种黄曲霉2219等霉菌的孢子悬浮液,28 ℃培养4 d,用PBS缓冲液洗下霉菌菌丝体,4 ℃条件下4 500 r/min离心10 min,取上清液用紫外分光光度计测定OD260值。
1.3.6霉菌能量代谢的测定
采用Yang等[24]所述罗丹明123染色法检测帕马霉素处理后霉菌线粒体膜电位的变化。
1.3.7霉菌细胞壁完整性的测定
方法同1.3.5。用帕马霉素处理黄曲霉2219等6种霉菌后,28 ℃培养4 d,用PBS缓冲液洗下霉菌菌丝体,4 500 r/min离心10 min,取上清液。用碱式磷酸酶(alkaline phosphatase, AKP)试剂盒测定AKP含量,利用酶标仪测定OD510值,根据绘制的标准曲线计算出酶活力单位。酶活越高,说明细胞壁破坏越严重。
1.3.8霉菌中麦角甾醇质量分数的测定
方法同1.3.5。用帕马霉素处理黄曲霉2219等6种霉菌后,30 ℃培养3 d,分别离心收集菌体,PBS缓冲液洗涤两次至上清液无色,去上清液。按照Kumar等[25]方法对霉菌中麦角甾醇进行提取并测定其质量分数。用式(2)计算麦角甾醇质量分数。

(2)
式(2)中,A230为上清液于230 nm处的吸光值;A282为上清液于282 nm处的吸光值;m(菌体)为菌体质量,g。
1.3.9黄曲霉2219产毒素质量浓度的测定
利用滤纸片法进行帕马霉素抑制黄曲霉2219实验。分别在培养2、3、4、5 d时从PDA平板上黄曲霉2219菌落边缘取5个直径0.6 cm琼脂塞,利用体积分数为80%甲醇萃取AFB1,4 500 r/min离心10 min,取上清液,经真空浓缩仪浓缩干燥,流动相[V(水)∶V(乙腈)=3∶1]复溶,进行高效液相色谱检测。
色谱条件:5020- 8973 Inertsustain AQ- C18型色谱柱(250 mm×4.6 mm×5 μm);FLD 检测器波长,365 nm。进样梯度:V(水)∶V(乙腈)=3∶1。进样量20 μL,时间15 min,流速1 mL/min,柱温30 ℃。
1.3.10黄曲霉毒素生物合成途径基因表达的测定
利用RT- qPCR法测定帕马霉素处理组和对照组中黄曲霉毒素生物合成途径中laeA、aflS、aflM、aflP和aflQ基因表达,验证帕马霉素对黄曲霉毒素合成的影响。
根据 NCBI 公布的黄曲霉基因组信息,结合RT- qPCR引物设计原则,使用 primer5 软件设计引物,以β-tubulin基因为内参基因,引物序列见表1。
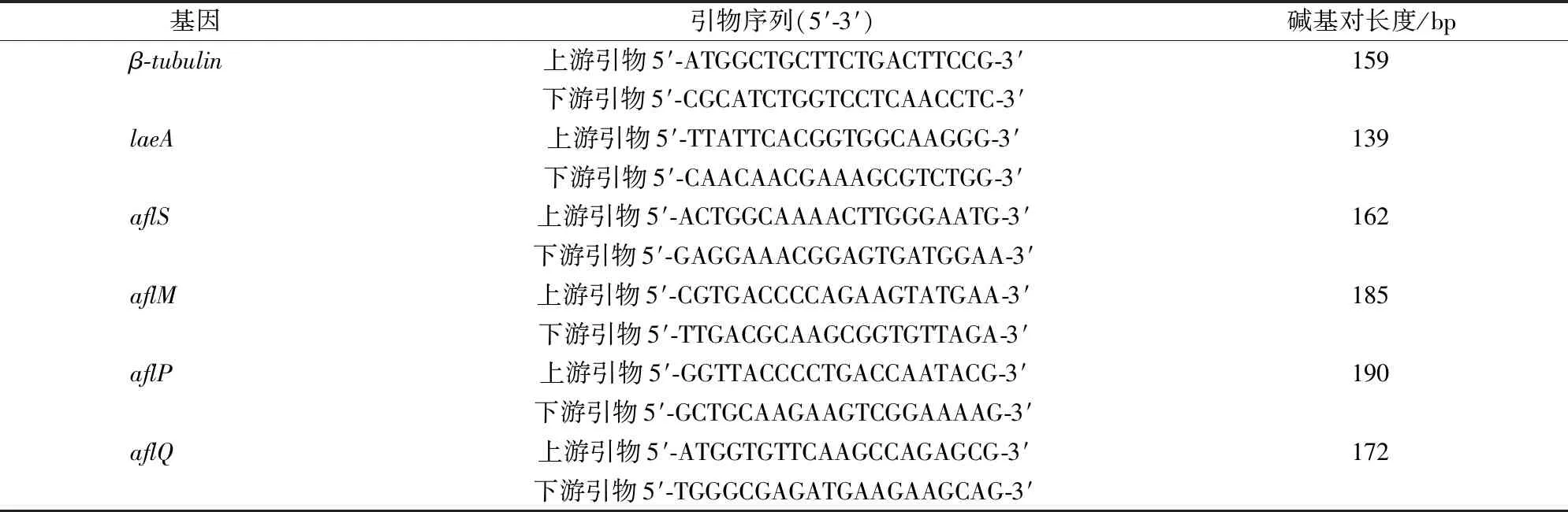
表1 RT- qPCR 基因引物Tab.1 Gene primers for RT- qPCR

表2 RT- qPCR 反应体系Tab.2 Reaction system of RT- qPCR
1.4 数据处理与分析
使用SPSS 26.0软件进行数据统计分析,P<0.05为差异显著,实验结果均采用平均值±标准差表示;采用Origin 8.5软件进行数据处理及绘图。
2 结果与分析
2.1 白黄链霉菌TD- 1对黄曲霉2219等霉菌的抑制作用分析
按照1.3.1方法,对白黄链霉菌TD- 1无细胞发酵液进行抑制黄曲霉2219、桔青霉、黑曲霉、灰霉、木霉、米曲霉等霉菌实验,计算菌落生长抑制率,结果见表3。由表3可知:白黄链霉菌TD- 1无细胞发酵液对6种霉菌的生长均具有抑制作用,尤其对黑曲霉和黄曲霉2219有较强的抑制效果,抑制率高于50%;对桔青霉、灰霉、木霉、米曲霉的抑制率在25%~50%。因此,白黄链霉菌TD- 1无细胞发酵液对霉菌具有广谱抑菌性。一些对植物有危害的病原菌,在采前、采后、运输、储藏等不同环节都可能使果实产生病害,甚至腐烂,可利用白黄链霉菌TD- 1对食品原料中的病原真菌污染尤其是黄曲霉和黑曲霉污染进行生物防治。

表3 白黄链霉菌TD- 1 对6种霉菌的抑制作用Tab.3 Inhibition of six kinds of fungus by Streptomyces alboflavus TD- 1
2.2 活性物质的鉴定及分析
对白黄链霉菌TD- 1上清液和菌丝体中的活性物质进行分离纯化,结果见图1至图3。由图1可知,13.5 min的峰为主要活性物质,峰面积占比62.516%。对样品继续进行LC- MS检测,由图3可知,该混合物的相对分子质量包含593、607、621、635和649。利用LC- MS仪器中的结果分析软件进行分子式预测,结果见表4。由表4可知,活性物质的分子式为C34H59NO7、C35H61NO7、C36H63NO7、C37H65NO7和C38H67NO7,判断其为帕马霉素- 593、607、621、635、649(pamamycin);且该物质的最大吸收波长为211~221 nm(图2),与文献报道的帕马霉素的最大紫外吸收波长215 nm相一致[18]。判断白黄链霉菌 TD- 1对黄曲霉2219等霉菌发挥抑制作用中的活性物质为帕马霉素及其同系物,同系物之间相差一个亚甲基 CH2。
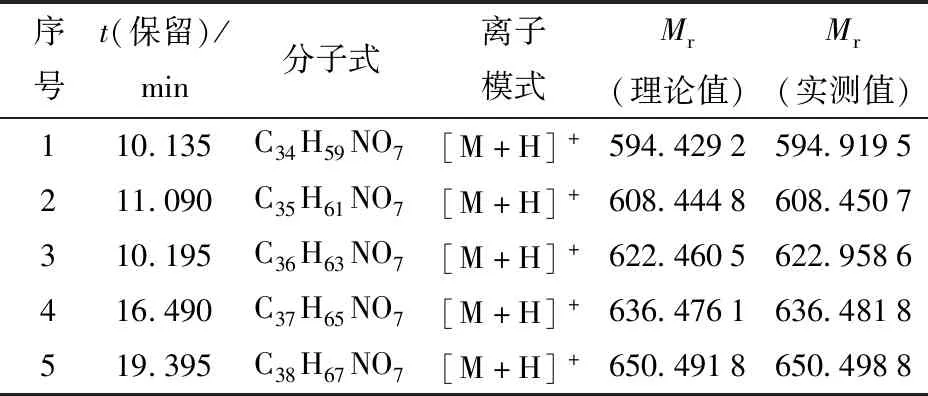
表4 白黄链霉菌TD- 1代谢产生的活性物质的质谱信息Tab.4 MS information of active compounds produced by metabolism of Streptomyces alboflavus TD- 1
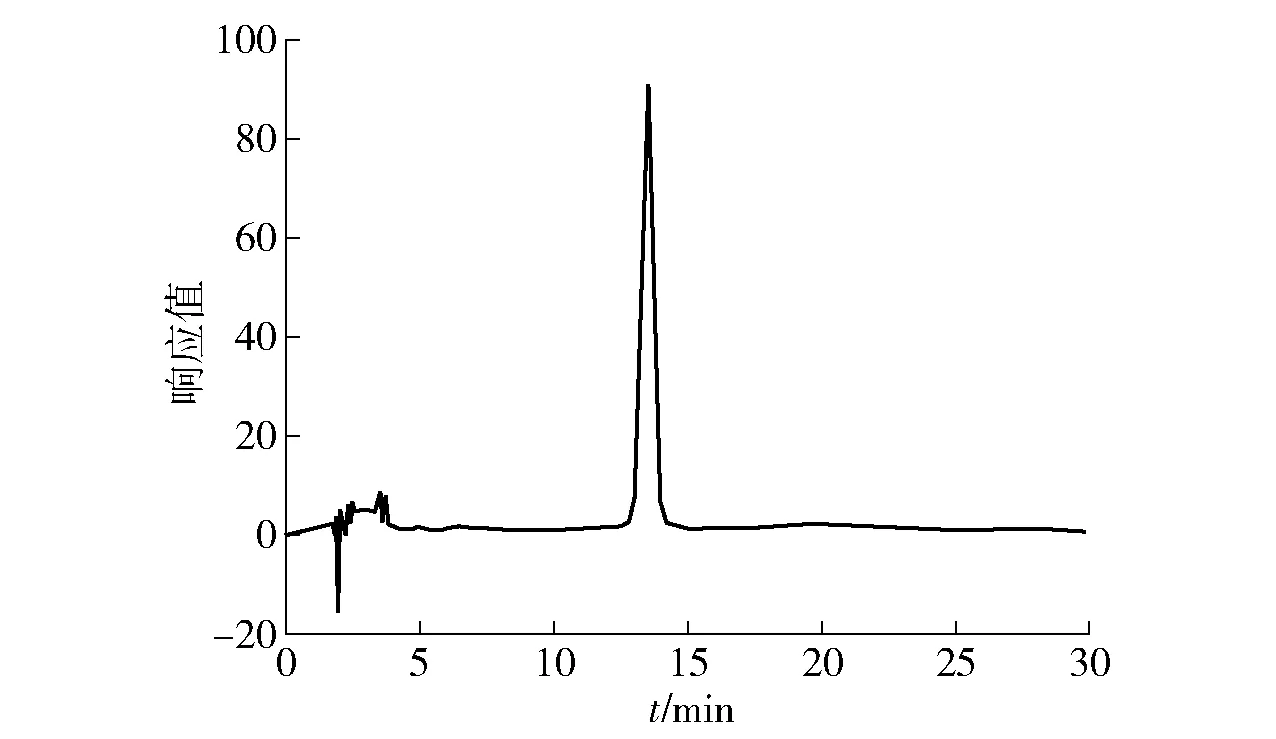
图1 白黄链霉菌TD- 1代谢产生的活性物质的HPLCFig.1 HPLC of active compounds produced by metabolism of Streptomyces alboflavus TD- 1
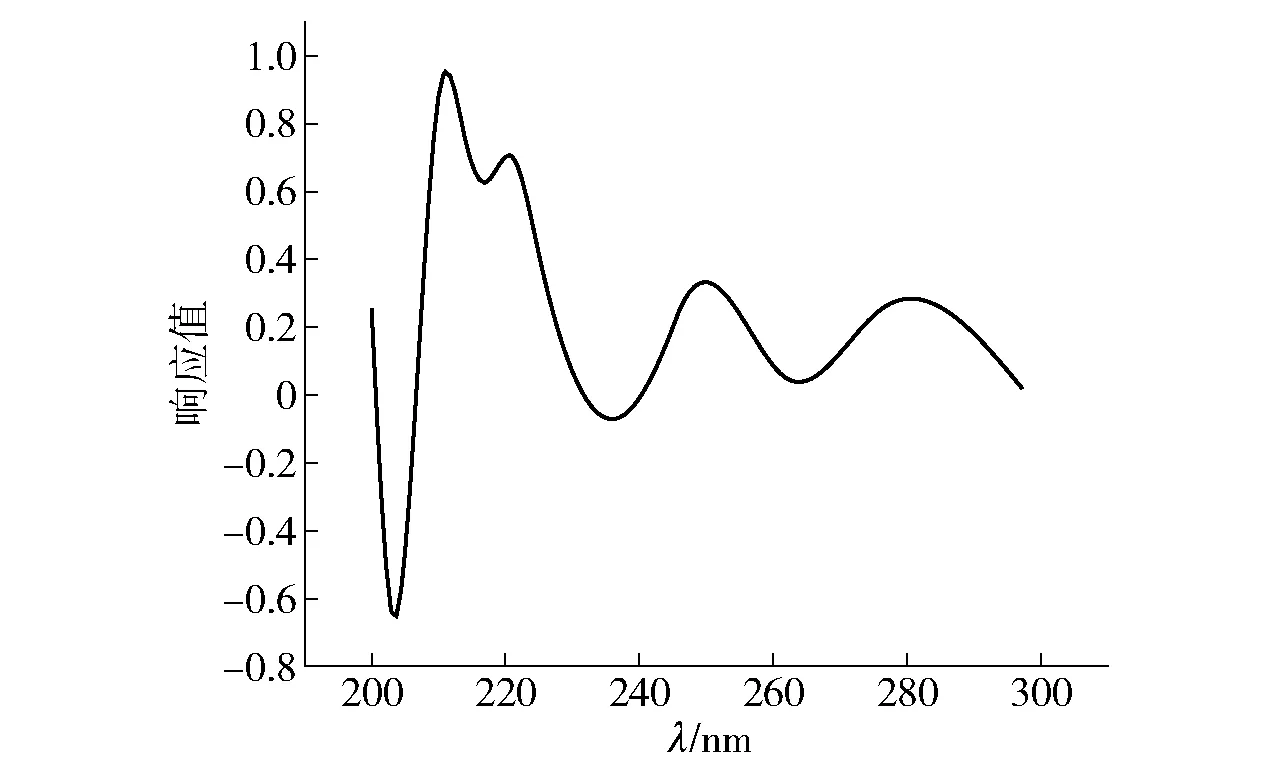
图2 13.5 min活性物质峰的紫外吸收光谱Fig.2 Spectrogram of UV absorption of 13.5 min active compounds peak
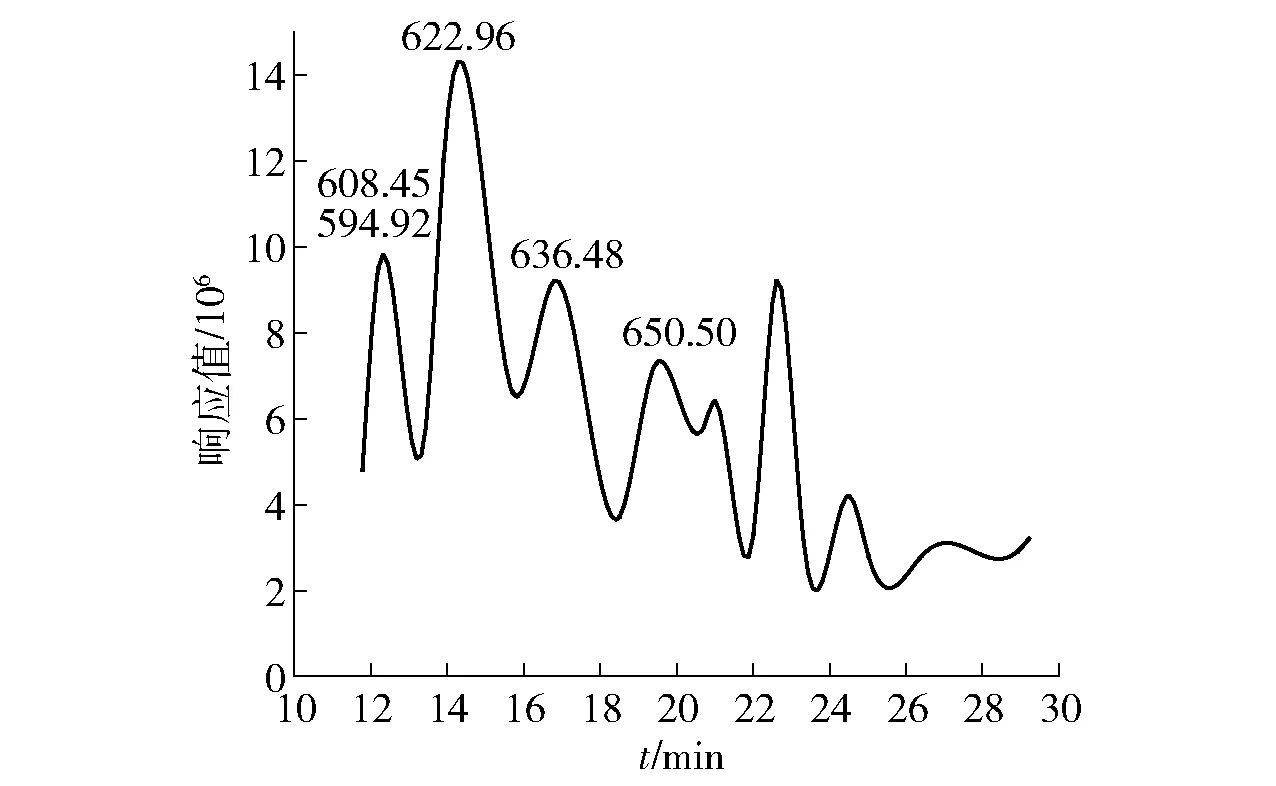
图3 白黄链霉菌TD- 1代谢产生的活性物质的总离子流图Fig.3 TIC profile of active compounds produced by metabolism of Streptomyces alboflavus TD- 1
2.3 帕马霉素对黄曲霉2219等霉菌的最小抑制浓度分析
采用质量浓度为2.000、1.000、0.500、0.250、0.125、0 mg/mL的帕马霉素对黄曲霉2219进行抑菌活性测定,结果见表5。由表5可知,帕马霉素对桔青霉的抑制效果最好,仅需0.125 mg/mL帕马霉素即可对桔青霉产生抑制作用;其次是灰霉,需要0.500 mg/mL帕马霉素抑制其生长;对于黄曲霉2219、黑曲霉、木霉和米曲霉,帕马霉素的最小抑制浓度均为1.000 mg/mL。6种霉菌主要为引起食品原料污染的病原菌,在粮食、果蔬的生长、采后或储藏期间易对植物造成霉菌污染;其中,桔青霉是在柑桔的采后环节对其产生严重危害,从而引起果实的病害和腐烂[27]。帕马霉素可考虑作为桔青霉的有效抗菌剂,选择合适浓度对柑桔采后病害进行防治。

表5 帕马霉素对6种霉菌的最小抑制浓度Tab.5 MIC of pamamycin for six kinds of fungus

A.孢子空白组, B.孢子甲醇组, C.孢子实验组, D.菌丝体空白组, E.菌丝体甲醇组, F.菌丝体实验组。图4 帕马霉素对霉菌孢子和菌丝体微观形态的影响Fig.4 Effect of pamamycin on morphologies of spores and mycelia of fungus
2.4 帕马霉素对黄曲霉2219等霉菌菌丝形态的影响
按照1.3.4的方法,利用2 000倍扫描电子显微镜观察帕马霉素对黄曲霉2219等霉菌孢子和菌丝体形态的影响,结果见图4。由图4可知:帕马霉素对黄曲霉2219和米曲霉的孢子菌丝体均有明显的致畸作用,使其形态发生明显改变,失去正常形态,表现为孢子凹陷,菌丝体扭曲、皱缩以及断裂;帕马霉素使桔青霉、木霉和灰霉的菌丝体发生断裂,表面不平,严重畸形,但对孢子形态则没有显著影响;对于黑曲霉,帕马霉素使其菌丝体形态没有发生改变,仍可见丰富生长点,但孢子形态则发生严重塌陷。可见,帕马霉素会使霉菌的孢子和菌丝体形态发生不同程度的畸变。
2.5 帕马霉素对黄曲霉2219等霉菌细胞膜通透性的影响
通过测定PBS缓冲液的OD260值研究帕马霉素对6种霉菌细胞膜通透性的影响,OD260值越高,则细胞膜损伤越严重,通透性增加[28],实验结果见图5。由图5可知:黄曲霉2219和黑曲霉经帕马霉素处理后,OD260值均升高。帕马霉素造成黄曲霉2219和黑曲霉的细胞膜结构损伤,改变了通透性,说明黄曲霉2219和黑曲霉对帕马霉素更为敏感,帕马霉素对两者细胞膜结构产生了影响;帕马霉素对哈茨木霉和桔青霉的细胞膜无损伤,甚至使米曲霉和灰霉的OD260降低。OD260值的降低可能是由于帕马霉素使细胞膜的物质运输功能降低,阻碍了胞内核酸等物质的泄露。

图5 帕马霉素对黄曲霉2219等霉菌细胞膜的影响Fig.5 Effect of pamamycin on cell membrane of Aspergillus flavus 2219 and other fungus
2.6 帕马霉素对黄曲霉2219等霉菌能量代谢的影响
线粒体是细胞内一种细胞器,能为细胞产生能量,是细胞呼吸的主要场所[29]。罗丹明123是一种亲脂性阳离子染料,可以通过被动扩散进入细胞并累积在线粒体基质中。罗丹明123可以作为荧光强度的指示剂,荧光强度与染料聚集的多少呈正相关关系[30]。线粒体膜被损伤,即破坏了线粒体的完整性,从而导致能量的合成能力减弱。帕马霉素对霉菌的线粒体能量代谢影响见图6。
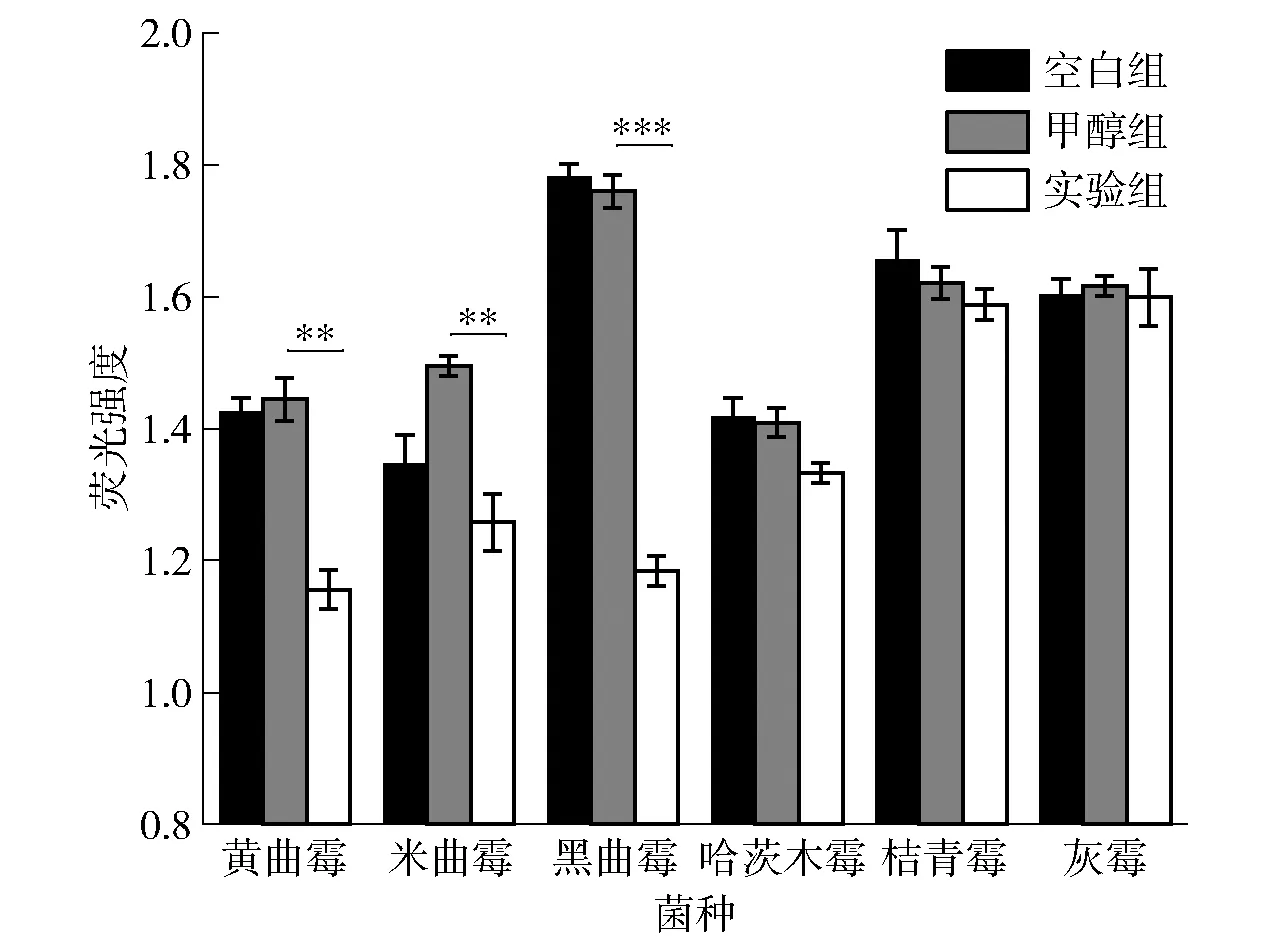
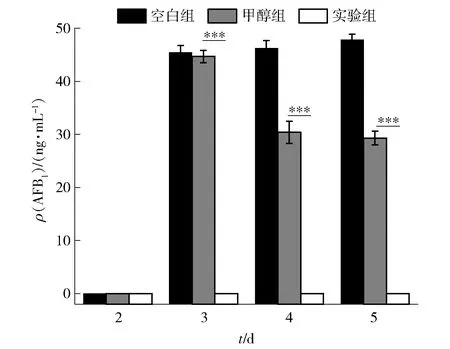
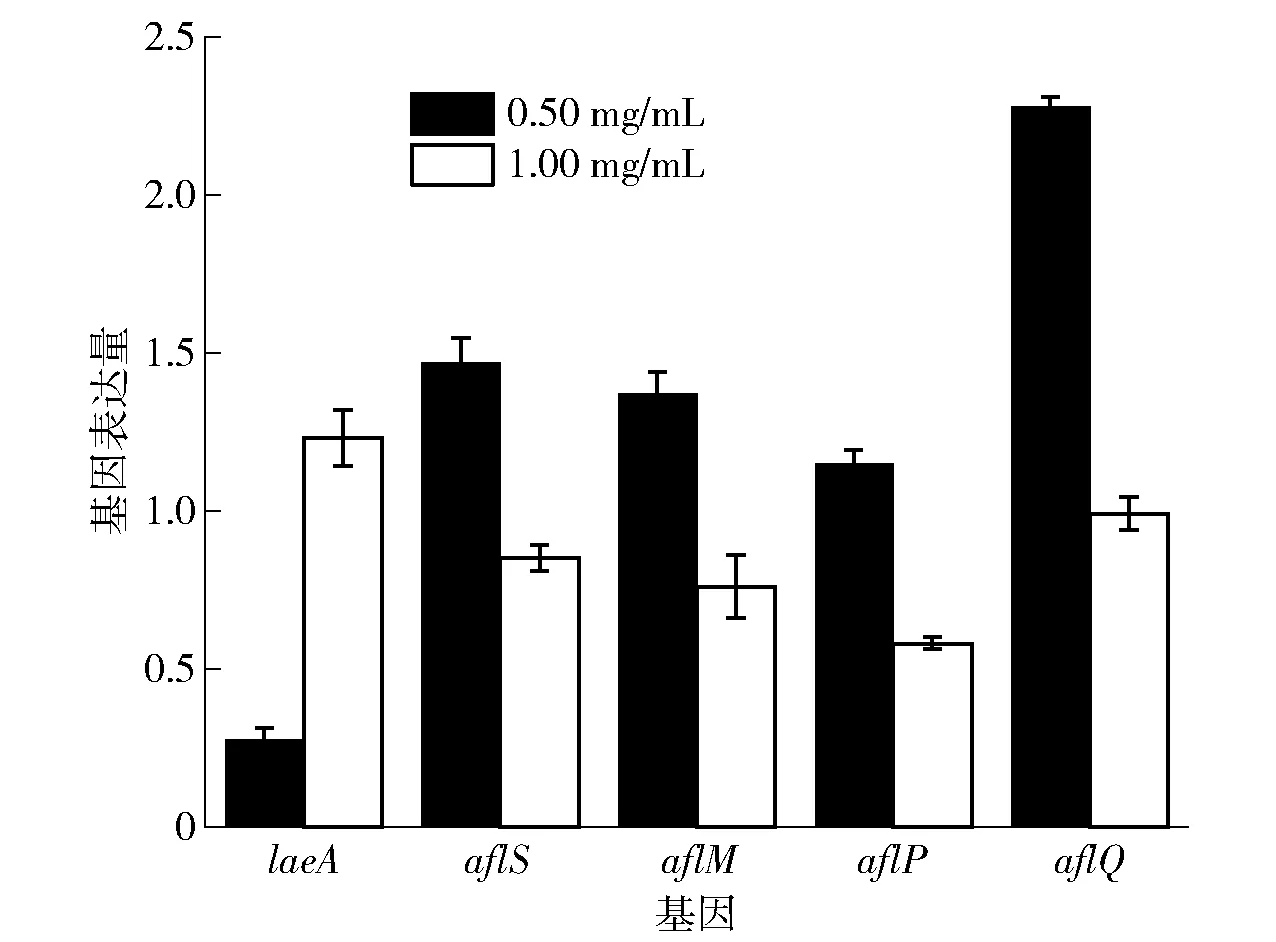
*为0.01 6种霉菌经帕马霉素处理后,荧光强度变弱,表明帕马霉素破坏了霉菌线粒体膜,影响了线粒体能量代谢,使 ATP合成能力减弱。对于黑曲霉,对照组和帕马霉素处理组的线粒体荧光强度的差异最显著(P<0.001),表明帕马霉素对黑曲霉的线粒体膜损伤最严重,并减弱其合成 ATP 的能力;帕马霉素对黄曲霉2219和米曲霉的线粒体膜电位也具有非常明显的破坏作用,影响代谢使其不能正常产生能量;木霉、桔青霉和灰霉的线粒体荧光强度也有所减弱,但帕马霉素对其破坏能力不明显。 细胞壁存在于细胞膜外,维护细胞形态,对细胞起到保护作用。当细胞壁发生破坏时,细胞膜和细胞壁之间的AKP就会渗出到胞外[31]。因此,可以通过测定细胞外AKP含量的变化,间接反映白黄链霉菌TD- 1产生的活性物质——帕马霉素对细胞壁的影响。实验结果见图7。 *为0.01 由图7可知,经帕马霉素处理后,霉菌胞外的AKP含量均显著升高,表明帕马霉素损伤了霉菌细胞壁,阻碍了物质运输和信息传递。尤其可以看出,帕马霉素处理后的黄曲霉2219胞外AKP含量明显升高,破坏了进入黄曲霉2219细胞内部的第一屏障;对于米曲霉和黑曲霉,帕马霉素对其细胞壁也具有较强的破坏能力,使胞外AKP 含量显著升高(P<0.001);桔青霉、灰霉和木霉经帕马霉素处理后,位于细胞壁和细胞膜之间的AKP也不同程度地渗透到胞外,具有显著性差异(P<0.001)。可见,帕马霉素可以显著破坏霉菌细胞壁的完整性。 麦角甾醇是细胞膜的组成成分,有利于维持细胞活力和酶活性,保证流动性和完整性,促进物质的运输[32]。帕马霉素对霉菌麦角甾醇含量影响的实验结果见图8。由图8可知:经帕马霉素处理后,除米曲霉外,其他菌丝细胞膜中麦角甾醇质量分数均降低,表明帕马霉素可抑制菌丝细胞膜中麦角甾醇的生物合成,并通过这种作用使菌丝不能正常生长;尤其是木霉菌细胞膜中的麦角甾醇质量分数经帕马霉素处理后有极显著降低(P<0.001);帕马霉素对黄曲霉2219、黑曲霉和灰霉细胞膜中麦角甾醇的作用也非常显著(P<0.01);帕马霉素也使桔青霉细胞膜中麦角甾醇的质量分数降低,但与对照组相比无明显差异(P>0.05)。米曲霉细胞膜中麦角甾醇质量分数升高,可能由于甲醇溶剂与麦角甾醇间的作用,促进了麦角甾醇的合成。 *为0.01 本研究实验结果表明,帕马霉素能够抑制黄曲霉2219的生长。而黄曲霉2219在生长状态下可以合成致癌的黄曲霉毒素。利用帕马霉素处理黄曲霉2219,每天测定AFB1的质量浓度,判断帕马霉素对黄曲霉毒素质量浓度的影响,实验结果见图9。黄曲霉2219生长3 d后开始产生AFB1,空白组质量浓度为45.5 ng/mL。在第3天时帕马霉素对AFB1发挥最大作用,使其质量浓度下降 98.3%。随着时间的增长,空白组中的AFB1质量浓度逐渐升高,实验组仍未检出AFB1;同时,甲醇组AFB1质量浓度开始下降,此时可能由于帕马霉素的不稳定性导致甲醇溶剂开始对AFB1发挥作用[33],但其中帕马霉素使AFB1质量浓度下降了65.7%,仍发挥主要作用。可见,帕马霉素可使黄曲霉2219产生AFB1的质量浓度得到有效控制,尤其在第3天开始合成AFB1时,帕马霉素即可显著抑制其合成。 *为0.01 为验证白黄链霉菌TD- 1所产帕马霉素是否可以下调黄曲霉2219的毒素合成、调控基因的表达,选取了曲霉属的关键全局调控基因laeA,黄曲霉毒素合成相关结构基因aflM、aflP和aflQ以及调控基因aflS为目的基因,对相关基因表达量进行测定,结果见图10。由图10可知,除laeA外,aflM、aflP、aflQ和aflS等目的基因均在1.00 mg/mL帕马霉素处理下表达量下降,尤其aflP下降了1.72倍,而laeA在0.50 mg/mL帕马霉素处理下表达量可显著下降3.64倍,由此可见,帕马霉素可以降低黄曲霉毒素合成和调控基因的表达。 图10 帕马霉素处理对AFB1生物合成基因表达量的影响Fig.10 Effect of pamamycin on AFB1 biosynthetic gene expression 为降低粮谷类的损失,保障人类健康和食品安全,一些天然产物作为化学杀菌剂的替代品被广泛用于食品工业。从白黄链霉菌TD- 1中分离纯化出了活性物质——帕马霉素,研究发现,其对黄曲霉2219等霉菌的生长具有明显的抑制作用,MIC为0.125~1.000 mg/mL。经帕马霉素处理后的霉菌,其孢子和菌丝体的形态会发生不同程度的畸变。帕马霉素破坏霉菌细胞壁的完整性,影响霉菌的线粒体能量代谢,使 ATP 合成能力减弱,并使黄曲霉2219和黑曲霉细胞膜损伤,改变其通透性;帕马霉素还可使除米曲霉外的其他霉菌菌丝细胞膜中麦角甾醇质量分数降低,表明帕马霉素能抑制菌丝细胞膜中麦角甾醇的生物合成,并通过这种作用使霉菌菌丝不能正常生长。帕马霉素对黄曲霉2219产AFB1的抑制效果更强,在黄曲霉2219生长至第3天时,帕马霉素即使AFB1的质量浓度下降了98.3%。经过验证,帕马霉素可以降低黄曲霉毒素的合成,当其质量浓度为1.00 mg/mL时,可使黄曲霉毒素合成相关结构基因aflP表达量下降1.72倍;当其质量浓度为0.50 mg/mL时,曲霉属关键全局调控基因laeA表达量下降了3.64倍。本研究表明,利用白黄链霉菌TD- 1等微生物可以防治食品原料中的黄曲霉等霉菌污染。未来还将对帕马霉素调控黄曲霉毒素生物合成的分子机制进行深入研究。2.7 帕马霉素对黄曲霉2219等霉菌细胞壁完整性的影响

2.8 帕马霉素对黄曲霉2219等霉菌麦角甾醇质量分数的影响

2.9 帕马霉素对黄曲霉2219产毒素质量浓度的影响
2.10 帕马霉素对黄曲霉毒素生物合成途径中基因表达的影响
3 结 论

