榆干离褶伞溶栓酶对高脂血症大鼠血管内皮的保护作用
苏 新,李 钰,李芳芳,张蕊萌,沈明花
(延边大学 医学院, 吉林 延吉 133002)
高脂血症是以血脂水平异常升高为主要特征的代谢性疾病。正常生理状态下,脂类的分解与合成处于动态平衡,长期的高脂肪饮食可导致机体脂类代谢紊乱,是引发高脂血症的重要因素之一。先前的研究表明,脂肪的过量摄入会促进机体氧自由基的生成,诱发氧化应激反应[1],影响血管内皮的结构和功能[2-3],增加动脉粥样硬化的风险。因此,降低血脂、保护血管内皮是预防动脉粥样硬化的有效途径。目前,对于高脂血症的治疗,核心措施是调整生活方式联合药物治疗,其中最为常用的药物是他汀类降脂药[4];但在长期或大量服用他汀类药物后会产生肝毒性、肌肉不适等不良反应[5]。因此,寻找具有降脂作用或具有血管内皮保护作用的天然产物具有重要的意义。
榆干离褶伞(Lyophyllumulmarium)又名大榆蘑、榆生离褶伞,属担子菌亚门、层菌纲、口蘑科、离褶伞属,分布于我国河北、吉林、黑龙江等地,具有保肝[6]、抗炎[7]、溶栓[8]等作用。在前期工作中从榆干离褶伞菌丝体中分离纯化了分子质量为50 kDa的溶栓酶。榆干离褶伞溶栓酶(Lyophyllumulmariumfibrinolytic enzyme,LUFE)通过提高抗氧化酶活性,抑制脂质过氧化,减轻酒精诱导的血管内皮细胞的氧化应激损伤[9]。前期实验结果表明,LUFE可以抑制酒精所致的脂类代谢紊乱,降低血脂,减轻大鼠酒精性肝损伤[10]。LUFE有降血脂、保护血管内皮细胞的作用,但是LUFE对高脂血症诱导的血管内皮损伤的保护作用还有待进一步探究。本研究拟通过高脂饮食建立高脂血症大鼠模型,探究LUFE对高脂血症所致血管内皮损伤的保护作用,并初步探讨其作用机制,以期为榆干离褶伞的功能性食品开发提供理论依据和参考。
1 材料与方法
1.1 实验动物和饲料
雄性SD大鼠[SYXK(吉)2020-0009]70只,体质量(150±10)g,延边大学实验动物中心提供。所有实验操作通过延边大学医学院医学伦理委员会批准,伦理编号:20222400。SD大鼠饲养在温度20~25 ℃、湿度50%~60%、环境清洁、无噪声、光照周期昼夜交替12 h的环境下。高脂饲料由延边大学实验动物中心配制,组成成分见表1。
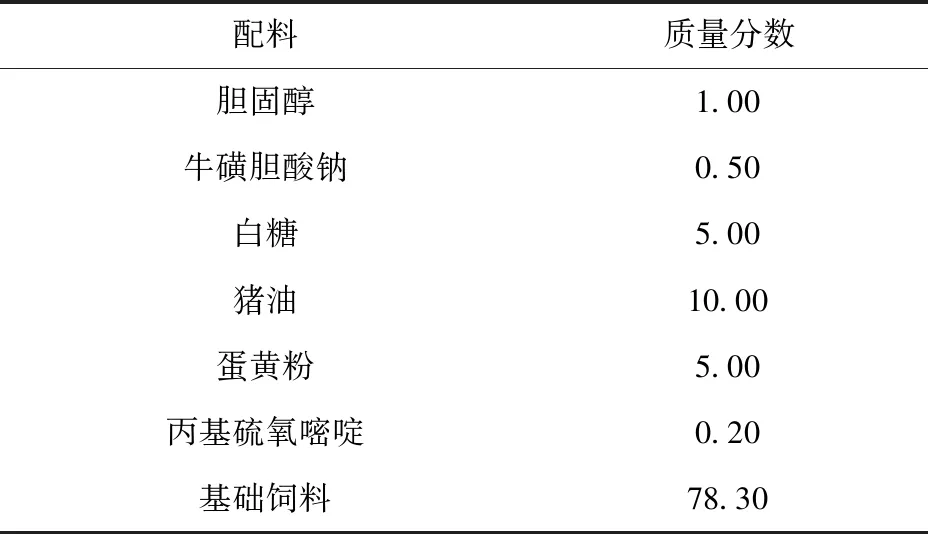
表1 高脂饲料成分及比例Tab.1 Composition and proportion of high-fat diet %
1.2 材料与试剂
根据参考文献[11]从榆干离褶伞菌丝体中分离纯化获得LUFE。根据前期研究结果,选取LUFE干预剂量为400 mg/(kg·d)[6,8,10]。阿托伐他汀钙片,齐鲁制药有限公司;白糖、猪油、鸡蛋,购自当地超市;胆固醇、牛磺胆酸钠、丙基硫氧嘧啶、饱和油红O染色液、核蛋白提取试剂盒,北京索莱宝科技有限公司;总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、过氧化氢酶(CAT)、6-酮前列腺素F1α(6-keta-PGF1α)、内皮素-1(ET-1)、丙二醛(MDA)试剂盒,南京建成生物工程研究所;高密度脂蛋白胆固醇(HDL-C)试剂盒,上海酶联生物科技有限公司;超氧化物歧化酶2(SOD2)试剂盒,碧云天生物科技有限公司;核因子E2相关因子2(Nrf2)抗体,北京博奥森生物技术有限公司;乙酰化超氧化物歧化酶2[Ac-SOD2(Lys68)]抗体,江苏亲科生物研究中心有限公司;超氧化物歧化酶2(SOD2)抗体、PCNA抗体,沈阳万类生物科技有限公司;血红素加氧酶-1(HO-1)抗体、沉默信息调节因子3(Sirt3)抗体、β-actin抗体,美国Cell Signaling Technology公司。
1.3 仪器与设备
BX53F型显微镜,日本OLYMPUS公司;RT- 2100型酶标仪,深圳雷杜公司;Azure C280型凝胶成像仪,美国Bio-Rad公司。
1.4 实验方法
1.4.1动物分组及处理
取70只SD大鼠随机分为4组,正常对照组、模型组、阳性对照组、LUFE组,除阳性对照组10只,其余每组各20只。观察大鼠饮食饮水情况、精神状态、有无大鼠死亡,并记录大鼠体质量。正常对照组喂养普通饲料,其余组根据体质量给予高脂饲料75 g/kg。LUFE组同时按体质量灌胃生理盐水溶解的LUFE(400 mg·kg-1·d-1),其余各组给予等量生理盐水。实验4周后,除阳性对照组,每组各随机抽取10只大鼠禁食12 h,根据体质量腹腔注射7 mL/kg乌拉坦麻醉,腹主动脉取血并分离取出主动脉弓至髂主动脉部分。阳性对照组于实验第5周开始每日灌胃生理盐水溶解的阿托伐他汀钙片5 mg·kg-1·d-1,其余各组大鼠的处理方式不变。实验8周后,大鼠禁食12 h,根据体质量腹腔注射7 mL/kg 乌拉坦麻醉,腹主动脉取血并分离取出主动脉弓至髂主动脉部分。将血液于4 ℃静置 30 min,2 000 r/min 离心20 min,小心吸取上层血清至1.5 mL离心管中分装备用。将主动脉置于生理盐水中清洗干净,用于后续实验。
1.4.2主动脉组织形态学检测
截取主动脉弓下方1.5 cm处的胸主动脉置于质量分数为4%的多聚甲醛中固定,脱水、包埋,苏木精- 伊红(HE)染色,于400倍光学显微镜下观察并拍照。
1.4.3主动脉油红O染色
使用眼科剪将全段主动脉纵向剖开,置于质量分数为4%的多聚甲醛中室温固定10 min,生理盐水漂洗,浸于45 ℃预热的油红O工作液中10 min,经体积分数为75%的酒精分化至正常乳白色,观察主动脉脂质斑块的分布情况,使用image j图像分析软件测定脂质斑块及主动脉的面积,并计算脂质斑块分布的相对面积(斑块总面积与血管总面积比值)。
1.4.4血清生理生化指标检测
取1.4.1节制备的血清,按照试剂盒说明书测定血清中TC、TG、LDL-C、HDL-C、MDA、ET-1、6-keta-PGF1α水平以及CAT、SOD2活性。
1.4.5Western blot检测
将主动脉截取50 mg,按照每1 mg动脉组织加入10 μL蛋白裂解液于冰上匀浆,裂解30 min,经4 000 r/min离心5 min,获取总蛋白提取液。另取动脉70 mg,按照核蛋白提取试剂盒的步骤分别在相对应的步骤中加入300 μL磷酸盐缓冲液、200 μL浆蛋白抽提试剂、60 μL核蛋白抽提试剂,于4 ℃以4 000 r/min离心10 min,获取核蛋白提取液。
采用BCA法对总蛋白、核蛋白提取液进行定量。蛋白进行十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳,电转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,使用质量分数为5%的脱脂奶粉溶液封闭1 h,洗膜,加入相应一抗,4 ℃孵育过夜,洗膜后加入二抗室温孵育1 h,加入显影液进行曝光。
据了解,中央新闻纪录厂20世纪50年代的老资料《第一届人大通过宪法》10 s的价格是1 200元,1957年拍摄的《一个小镇的变化》资料反映的是湖南吉首50年代发展与变迁,每分钟的价格是4 500元。因此可以看出时间老、年代久远的资料也是十分珍贵的。它代表着一种积淀与厚度,是价值生命力的充分体现。
1.5 动脉粥样硬化指数计算
根据式(1)计算SD大鼠动脉粥样硬化指数(AI)。
(1)
式(1)中,c(TC)为血清中TC浓度,mmol/L;c(HDL-C)为血清中HDL-C浓度,mmol/L。
1.6 统计学处理
实验数据以平均值±标准差表示,使用SPSS 20.0统计学软件进行数据单因素方差分析、t检验分析,P<0.05时有统计学意义,应用GraphPad Prism 6.0软件作图。
2 结果与分析
2.1 LUFE对大鼠体质量影响
LUFE对大鼠体质量的影响,实验结果如表2。由表2可知,各组大鼠初始体质量无显著差异。实验中观察各组大鼠基本状态并记录体质量,饮食诱导4周后,正常对照组大鼠食欲良好、精神活泼,体质量稍有增加。与正常对照组相比,模型组与阳性对照组大鼠状态未见明显异常,体质量增长显著(P<0.05);而LUFE组大鼠体质量显著低于模型组与阳性对照组(P<0.05)。诱导8周后,与正常对照组相比,模型组大鼠体质量增长显著(P<0.01),阳性对照组与LUFE组大鼠体质量显著低于模型组(P<0.01)。实验结果说明,长期高脂饮食可造成大鼠体质量增加,阿托伐他汀钙片与LUFE可以控制大鼠体质量的显著增长。
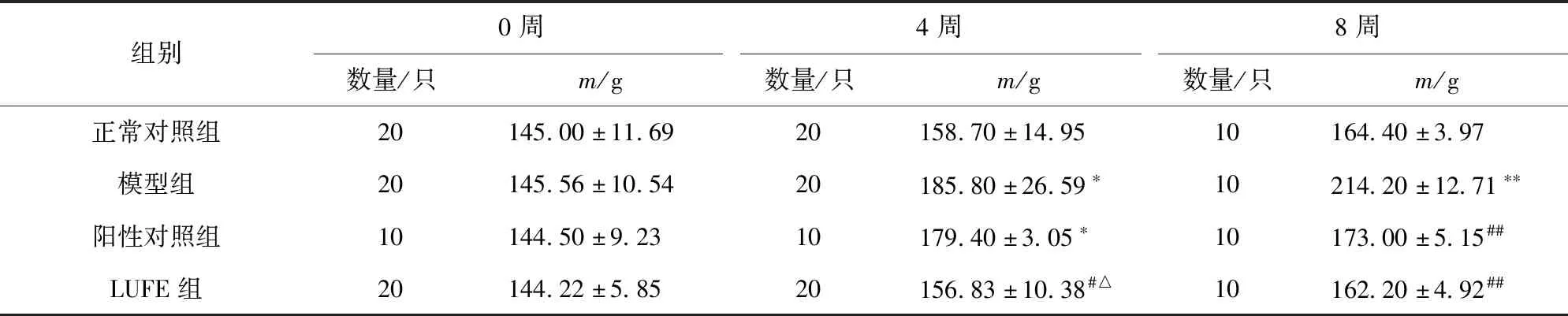
表2 LUFE对大鼠体质量的影响Tab.2 Effect of LUFE on body mass of rats
2.2 LUFE对高脂血症大鼠胸主动脉组织形态的影响
大鼠主动脉形态检测结果如图1。由图1可知,饮食诱导4周后,正常对照组、LUFE组大鼠胸主动脉组织结构均未见明显异常,模型组大鼠胸主动脉内膜可见轻度增厚,未见显著的病理性变化。诱导8周后,正常对照组大鼠胸主动脉形态结构正常,血管内皮连续光滑。模型组大鼠胸主动脉内膜增厚、不连续,内皮细胞脱落,内膜中膜界限不清。与模型组相比,LUFE组与阳性对照组胸主动脉损伤明显减轻,内膜连续,未见内皮细胞脱落。
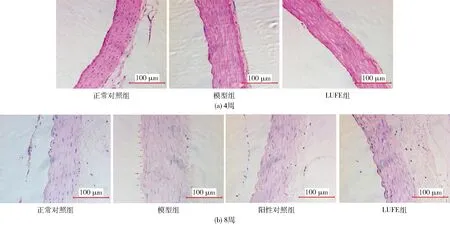
左侧为管腔,红色箭头指示血管内皮细胞脱落处。图放大倍率为400倍。图1 LUFE对高脂血症大鼠主动脉形态的影响Fig.1 Effects of LUFE on aortic morphology in hyperlipidemia rats

A为正常对照组,B为模型组,C为阳性对照组,D为LUFE组。与正常对照组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与模型组比较,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);n=5。图2 LUFE对高脂血症大鼠主动脉脂质斑块分布的影响Fig.2 Effect of LUFE on lipid plaque distribution in aorta of hyperlipidemia rats
2.3 LUFE对高脂血症大鼠主动脉脂质斑块分布的影响
油红O染色结果见图2。由图2可知,饮食诱导8周后,正常对照组大鼠主动脉内侧平整光滑,无脂质沉积。模型组大鼠主动脉血管内膜增厚、粗糙,可见大面积脂质斑块沉积,触及质硬、无弹性。与模型组相比,LUFE组与阳性对照组的动脉质地柔软,少量脂质斑块沉积。使用image j图像分析软件分析主动脉沉积斑块面积,与正常对照组相比,模型组脂质斑块分布的相对面积极显著升高(P<0.01)。而与模型组相比,LUFE组与阳性对照组脂质斑块分布的相对面积极显著降低(P<0.01)。
2.4 LUFE对高脂血症大鼠血脂代谢的影响
血清TC、TG、 LDL-C 、HDL-C常被认为是衡量体内血脂水平的指标[12],根据其计算的AI值常被用来评价动脉粥样硬化的危险程度[13]。大鼠血脂和AI检测结果如图3和图4。由图3和图4可知,高脂饮食4、8周后,与正常对照组相比,模型组大鼠表现为高脂血症血脂特征,AI值和血清TC、TG、LDL-C水平均极显著升高(P<0.01),HDL-C水平无显著变化(P>0.05)。与模型组相比,LUFE组大鼠AI值和血清TC、TG、LDL-C水平均不同程度下降,HDL-C的水平无显著变化(P>0.05)。与模型组相比,阳性对照组AI值和血清TC、TG水平显著降低,血清LDL-C、HDL-C水平无显著变化(P>0.05)。与阳性对照组相比,LUFE组大鼠AI值和血清TG、LDL-C水平均不同程度下降,说明LUFE和阿托伐他汀钙片具有降脂、降低高脂血症大鼠进一步发展为动脉粥样硬化风险的作用,且LUFE作用较为显著。
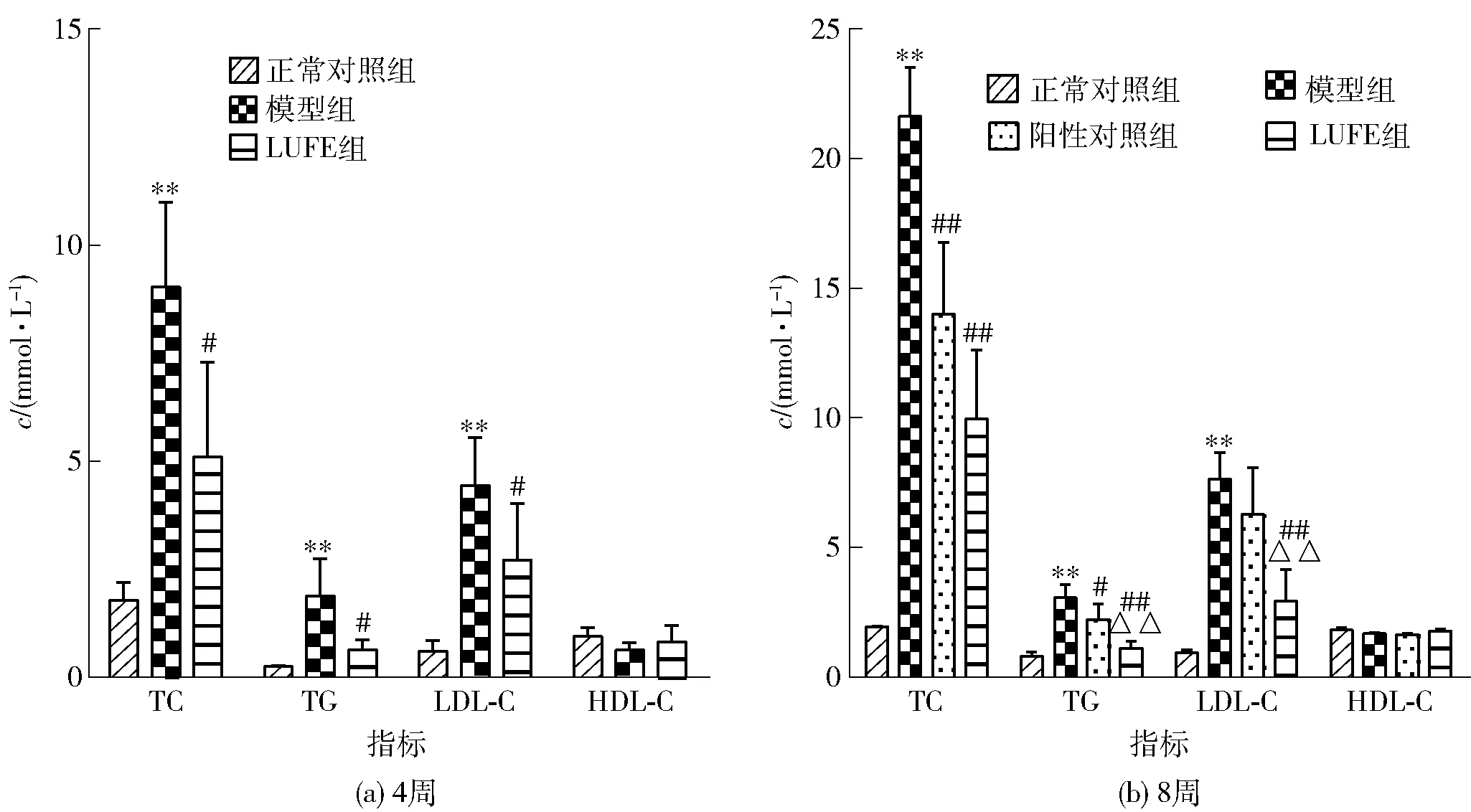
图3 LUFE对高脂血症大鼠血脂代谢的影响Fig.3 Effect of LUFE on lipid metabolism of hyperlipidemia rats
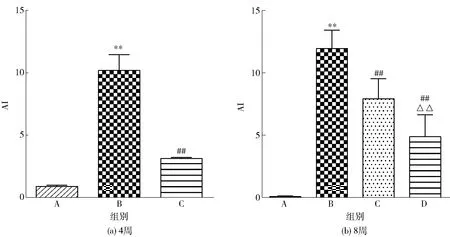
A为正常对照组,B为模型组,C为阳性对照组,D为LUFE组。与正常对照组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与模型组比较,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);与阳性对照组比较,△表示差异显著(P<0.05),△△表示差异极显著(P<0.01)。图4 LUFE对高脂血症大鼠AI的影响Fig.4 Effect of LUFE on AI of hyperlipidemia rats
2.5 LUFE对高脂血症大鼠血清氧化应激水平的影响
高脂血症会导致机体氧化- 抗氧化水平失衡[3]。位于线粒体中的锰超氧化物歧化酶(MnSOD)即SOD2,是超氧化物歧化酶的3种存在方式之一,可催化超氧阴离子转化为H2O2和O2,H2O2可被过CAT分解为H2O和O2,从而起到清除ROS的作用[14]。MDA是脂质过氧化反应的主要产物,具有细胞毒性[15-16],是机体发生氧化应激反应的标志物之一。
大鼠血清抗氧化酶活性和MDA水平检测结果如表3。由表3可知,饮食诱导4周后,与正常对照组相比,模型组大鼠血清MDA水平和SOD2、CAT活力无显著变化,这可能与高脂饮食处理时间较短有关。与模型组相比,LUFE组大鼠血清MDA、SOD2、CAT水平无显著变化。饮食诱导8周后,与正常对照组相比,模型组大鼠血清MDA水平显著升高,SOD2、CAT活力显著降低,说明血脂异常可导致机体氧化—抗氧化系统失衡。与模型组相比,LUFE组、阳性对照组MDA水平显著下降,SOD2、CAT活力显著升高。结果表明阿托伐他汀钙片或LUFE干预能够缓解大鼠的氧化应激损伤。
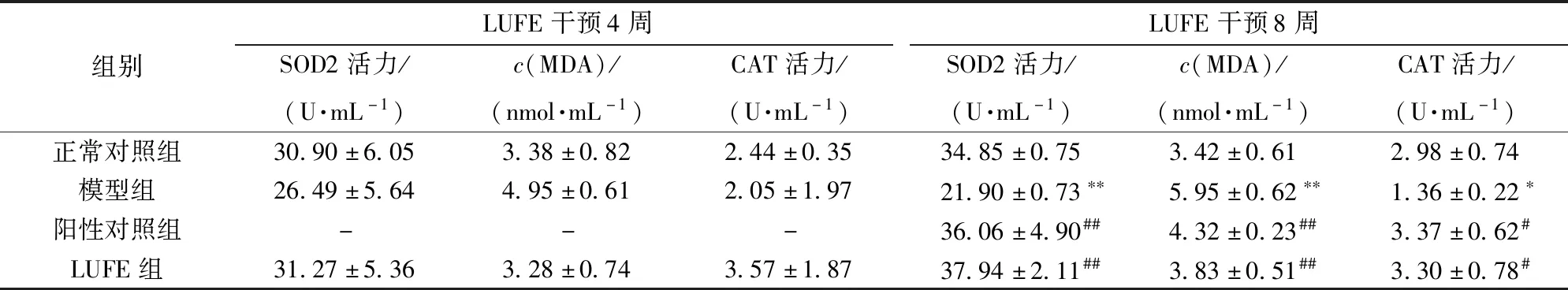
表3 LUFE对高脂血症大鼠血清氧化应激的影响Tab.3 Effect of LUFE on oxidative stress in serum of hyperlipidemia rats
2.6 LUFE对高脂血症大鼠血清ET-1和6-keta-PGF1α水平的影响
正常生理条件下血管内皮细胞分泌多种血管活性因子来维持内皮的生理功能,如ET-1、一氧化氮(NO)、前列环素(PGI2)、血栓素A2(TXA2)、血管紧张素Ⅱ(AngⅡ),此类物质之间的动态平衡可以调节血管张力、维持血管正常生理功能[17]。血脂异常通常会导致血管内皮细胞损伤、内皮功能障碍、多种血管活性因子分泌失调[17-19]。大鼠血清ET-1和6-keta-PGF1α水平如表4。由表4可知,与正常对照组相比,以高脂饮食诱导4、8周的模型组大鼠血清ET-1水平均显著升高,诱导8周后模型组大鼠6-keta-PGF1α水平极显著下降(P<0.01);与模型组相比,高脂饮食诱导4、8周的LUFE组大鼠血清ET-1水平均极显著下降(P<0.01)。诱导8周后LUFE组大鼠血清6-keta-PGF1α水平极显著升高(P<0.01);与模型组相比,阳性对照组大鼠血清ET-1水平极显著降低,血清6-keta-PGF1α水平极显著升高(P<0.01)。结果显示,LUFE和阿托伐他汀钙片可能通过调节血管活性物质的水平,以维持血管内皮功能。

表4 LUFE对高脂血症大鼠血清中ET-1和6-keta-PGF1α水平的影响Tab.4 Effect of LUFE on levels of ET-1 and 6-keta-PGF1α in serum of hyperlipidemia rats
2.7 LUFE对高脂血症大鼠主动脉蛋白表达水平的影响
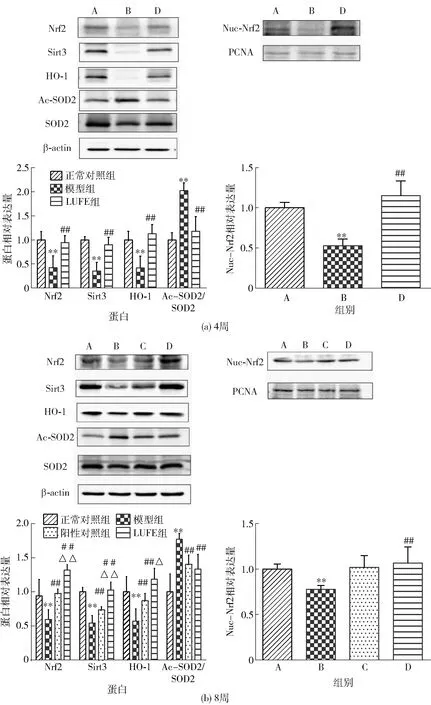
A为正常对照组,B为模型组,C为阳性对照组,D为LUFE组。与正常对照组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与模型组比较,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);与阳性对照组比较,△表示差异显著(P<0.05),△△表示差异极显著(P<0.01)。图5 LUFE对高脂血症大鼠主动脉蛋白表达的影响Fig.5 Effect of LUFE on protein expression in aorta of hyperlipidemia rats
大鼠主动脉蛋白表达水平检测结果如图5。由图5可知,高脂饮食诱导4、8周后,与正常对照组相比,模型组大鼠主动脉Nrf2、Sirt3、HO-1及核内Nrf2(Nuc-Nrf2)的蛋白表达极显著下降(P<0.01),Ac-SOD2(Lys68)蛋白表达极显著升高(P<0.01)。与模型组相比,LUFE组和阳性对照组大鼠主动脉Nrf2、Sirt3、HO-1及Nuc-Nrf2的蛋白表达显著升高,Ac-SOD2的相对蛋白表达极显著降低(P<0.01)。与阳性对照组相比,LUFE组大鼠主动脉Nrf2(P<0.01)、Sirt3(P<0.01)、HO-1(P<0.05)蛋白表达显著升高(P<0.05,P<0.01)。研究结果说明LUFE和阿托伐他汀钙片对血管内皮的保护作用可能与激活Nrf2及其下游相关蛋白有关,且LUFE对Nrf2及其下游相关蛋白的影响更为显著。
3 讨 论
在高脂血症中,血浆脂质水平异常也表现为血浆脂蛋白水平的异常,其中低密度脂蛋白(LDL)水平的升高是诱发血管内皮受损、导致动脉粥样硬化的关键因素。高脂肪、高热量饮食导致血脂升高,体内游离脂肪酸增多,通过激活烟酰胺腺嘌呤二核苷酸磷酸氧化酶及降低内皮型一氧化氮合酶的活性,增加血管内皮细胞ROS的生成[20-21]。ROS的产生诱发氧化应激反应,导致血管内皮细胞损伤、血管壁通透性改变,加速低密度脂蛋白(LDL)颗粒向动脉内膜下迁移,LDL被ROS氧化修饰后形成氧化型低密度脂蛋白(ox-LDL)[22-23]。内皮细胞上的凝集素样特异性受体1(LOX1)特异性识别、吞噬ox-LDL,诱导内皮细胞脂质蓄积、连接屏障受损[24],进一步加速了血管内皮的损伤,促进了动脉粥样硬化的发生和发展。因此,降低血脂、改善氧化应激状态对保护血管内皮和预防动脉粥样硬化的发生尤为重要。
本研究通过高脂饮食诱导高脂血症大鼠模型,以LUFE分别干预4、8周后,观察LUFE对高脂血症大鼠的血管内皮保护作用。实验结果显示,LUFE干预后减少大鼠动脉内膜的病理性损伤及脂质沉积,降低血清TC、TG、LDL-C水平和AI值,说明LUFE具有降低血脂、抑制脂代谢紊乱、降低动脉粥样硬化的风险;但是对于LUFE的干预作用是否具有时间依赖性,仍需进一步探讨。
SOD、MDA、CAT是反映机体氧化还原水平的指标[15]。本研究中模型组大鼠血清MDA水平升高,血清SOD2、CAT活性降低,表明高脂血症可引起机体抗氧化能力的降低。LUFE干预降低大鼠血清MDA水平,升高大鼠血清SOD2、CAT活性,表明可以通过提高抗氧化酶活性,降低脂质过氧化水平,从而减少高脂血症大鼠血管内皮的氧化损伤。ET-1是由血管内皮细胞产生的多肽、具有强效缩血管作用[25]。研究发现,ET-1可以促进内皮细胞LOX1与ox-LDL的结合,加速血管内皮功能紊乱[26]。前列环素(PGI2)是由内皮细胞产生的一种生物活性物质,具有扩血管、抗血小板聚集的作用,因PGI2在体内极不稳定,故多采取测定其产物6-keta-PGF1α的含量来反映体内PGI2的水平[27]。本研究中高脂血症大鼠ET-1水平升高、6-keta-PGF1α水平下降,表明高脂血症可影响大鼠血管收缩能力,影响内皮功能。LUFE干预降低ET-1水平,升高6-keta-PGF1α水平,表明LUFE具有舒张血管和保护血管内皮作用。有研究报道,在尼古丁诱导大鼠血管内皮细胞损伤模型中,LUFE干预降低ET-1水平而升高PGI2水平,这与本研究结果相一致[28]。
Nrf2是细胞抗氧化防御系统中重要的转录因子[29]。正常生理状态下,Nrf2在胞浆中以非活性形式存在[29]。当Nrf2被激活后,可转移入细胞核,进而调控下游抗氧化酶和II相解毒酶,如SOD、CAT、HO-1等靶基因的转录[30],清除氧自由基,抵御氧化损伤。Sirt3是位于线粒体中的一种烟酰胺腺嘌呤二核苷酸依赖性脱乙酰酶[31],可以介导SOD2的去乙酰化,以此达到清除ROS的作用[32]。据报道,Nrf2可调控Sirt3蛋白的表达水平[33],这可能与Nrf2亚基和Sirt3的启动子结合有关[34]。研究结果表明:模型组大鼠Nrf2、Sirt3、HO-1、SOD2、CAT水平均明显低于正常对照组,Ac-SOD2相对蛋白表达水平明显高于正常对照组;与模型组相比,经LUFE干预后,大鼠主动脉Nrf2、Sirt3、HO-1蛋白表达均上调,Ac-SOD2相对蛋白表达明显降低,血浆SOD2、CAT活性明显上升,提示LUFE保护血管内皮的机制可能与激活Nrf2及其下游相关基因的转录有关。
4 结 论
本研究利用LUFE对高脂血症大鼠进行干预,实验结果表明,给予LUFE干预后可以有效地控制大鼠体质量的增长,降低血脂,减轻动脉内膜的病理性损伤及脂质沉积。Western blot结果显示,LUFE可以通过激活Nrf2信号通路来减轻氧化应激损伤。LUFE对高脂血症所致的血管内皮损伤具有保护作用。后续将对LUFE抗氧化及调节脂质代谢的作用展开进一步研究,以期为推出食用菌相关的功能性食品提供更多理论依据。

