大球盖菇干制过程香气变化规律及与关键酶促反应的关联性
李佳霖,杨 焱,李 文,陈万超,3,*,刘晓风
(1.兰州理工大学 生命科学与工程学院, 甘肃 兰州 730050;2.上海市农业科学院食用菌研究所/农业农村部南方食用菌资源利用重点实验室/国家食用菌工程技术研究中心, 上海 201403;3.上海百信生物科技有限公司, 上海 201403)
大球盖菇(Strophariarugosoannulata)是一种药食兼用的食用菌,别名皱环球盖菇、裴氏球盖菇、赤松茸等,为担子菌门(Basidiomycota),层菌纲(Hymenomycetes),伞菌目(Agaricales),球盖菇科(Strophariaceae),球盖菇属(Stropharia)真菌[1]。研究表明,大球盖菇富含蛋白质、多糖、酚类及多种维生素等营养成分,是各种生物活性物质的良好来源[2]。大球盖菇环境适应能力极强、栽培模式粗放、经济效益高,联合国粮农组织(FAO)已向发展中国家推荐种植[3]。
新鲜的大球盖菇保质期短,主要是由于其较高的含水量和采后强烈的呼吸作用造成的。为延长大球盖菇的货架期,现主要通过干燥、罐装和腌制等方法对其子实体进行加工处理。干燥具有操作简易、成本低的优点,是食品工业中最传统、最有效的保鲜技术之一。该处理会直接影响食用菌风味特征,从而影响消费者选择偏好,通过合理的方式控制食用菌产生良好的风味特性是对其品质评估的重要指标之一。目前,食用菌加工中最常用的干制方式有自然风干、热风干燥、微波干燥、真空干燥和真空冷冻干燥[4]。与新鲜蘑菇相比,干蘑菇具有更浓郁的风味,并且在干制过程中营养成分和生物活性物质会发生改变[5]。胡思[6]研究发现,热风干燥可更好地保留大球盖菇菇粉中的滋味成分,并采用气质联用技术从热风干制菇粉中检出35种挥发性成分。李文等[7]对比不同干制方法处理的香菇样品,发现热风干燥后的样品含硫化合物含量最高且香味浓郁。
已有研究报道,食用菌干制过程中香气的形成主要是通过酶促反应及非酶促反应[8-9]。酶促反应主要基于生物合成途径,子实体内的酶受热激活,不饱和脂肪酸发生降解,开始形成风味前体物质及部分香气成分,后经关键酶的作用生成其他特征性香气成分;非酶促反应是由于连续的高温环境,使机体内部温度持续升高,水分活度不断下降致使酶的活性降低,加剧机体美拉德等热化学反应的进行,最终共同形成食用菌特有的香味。由于干制过程伴随多种中间产物的生成且反应变化快,这为食用菌风味研究带来诸多困难。现阶段对干燥大球盖菇的研究主要聚焦于干燥方式及成品的风味,而对干制过程中特征性香气成分的合成代谢及变化规律鲜有报道。
本研究基于顶空固相微萃取结合气相色谱- 质谱联用技术(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS- SPME- GC- MS)对大球盖菇55 ℃恒温热风干制处理过程中挥发性化合物的变化规律进行分析,利用气味活度值(odor activity value,OAV)及偏最小二乘判别分析法(partial least squares-discriminant analysis,PLS- DA)筛选出关键气味化合物,测定挥发性化合物代谢途径中关键香气代谢酶酶活,并将酶活与相应化合物含量进行相关性分析,阐述大球盖菇在干制过程中特征性香气的变化规律及形成机理,以期为大球盖菇进一步的开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
大球盖菇(Strophariarugosoannulata)鲜菇子实体,购自上海菇林源菌业专业合作社(上海崇明)。鲜菇采用林下栽培模式栽培,培养基为稻草,菌种为球盖菇5号[沪农品认食用菌(2004)第062号]。
1,2-二氯苯(内标物),国药集团化学试剂有限公司;C7~C30正构烷烃标准品,美国Sigma公司;脂肪氧合酶(lipoxygenase,LOX)活性测定试剂盒、乙醇脱氢酶(alcohol dehydrogenase,ADH)活性测定试剂盒,苏州梦犀生物医学科技有限公司。
1.2 仪器与设备
DGG- 9240B型电热恒温鼓风干燥箱,上海森信实验仪器有限公司;MA100C- 000230V1型水分仪,德国Sartorius AG公司;HS- SPME进样器,美国Supelco公司;75 μm DVB/CAR/PDMS型萃取纤维,美国Supelco公司; 7890A- 5975C型气质联用仪,安捷伦科技(上海)有限公司;DB- 5 ms型色谱柱,美国J&W Scientific公司; EPOCH2型酶标仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1样品处理
将鲜菇进行清洗修剪,使用恒温鼓风干燥机在55 ℃条件下进行干制处理,从鲜菇(0 h)开始每隔 1 h 取样,直至子实体水分质量分数小于10%时取样完毕。本实验共取样13个(分别为0~12 h),干制过程中大球盖菇水分含量如表1。将取得的样品子实体切成均匀的薄片,准确称取1.0 g,置于20 mL顶空瓶中待测。

表1 大球盖菇干制样品水分含量Tab.1 Moisture content of dried samples of Stropharia rugosoannulata %
1.3.2顶空固相微萃取提取条件
采用顶空固相微萃取对样品中的挥发性化合物进行提取,后通过气相色谱- 质谱鉴定挥发性化合物。参考Li等[10]的方法,向装有样品的顶空瓶中,加入5 mL去离子水及10 μL 1,2-二氯苯(内标物,质量浓度为100 μg/mL),迅速密封瓶口混匀待测。顶空瓶置于55 ℃条件平衡10 min,将75 μm DVB/CAR/PDMS型萃取纤维经230 ℃老化20 min后插入顶空瓶中,在55 ℃水浴保温吸附30 min,后立即将复合萃取纤维抽出并转移到GC- MS进样口中,在250 ℃下解吸10 min。
1.3.3气相色谱-质谱联用分析条件
色谱条件:色谱柱为DB- 5ms毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度保持在260 ℃;柱温箱升温程序设置为起始温度50 ℃,保持1 min,以10 ℃/min速率升温至280 ℃,并保持5 min;载气体积分数为99.99%的氦气;流速为1.0 mL/min;不分流进样。
质谱条件:电子轰击离子源(EI),电离电压70 eV;电流为35 μA;传输线温度和离子源温度分别保持在280 ℃和220 ℃;质量扫描范围m/z35~450 u。
质谱数据采用安捷伦GC- MS MSD ChemStation 数据分析软件处理,并采用NIST11和Wiley谱库检索,根据C7~C30正构烷烃标准品计算化合物保留指数(retention index,RI),对挥发性化合物进行鉴定和分析。
选用1,2-二氯苯作为内标物,通过内标法计算被测组分中挥发性化合物相对含量,计算方法见式(1)。
(1)
式(1)中,Ax为样品中待测化合物的峰面积;mi为加入内标物的质量,μg;Ai为内标物的峰面积;mx为称取的样品质量,kg;Ci为样品中待测化合物的质量分数,μg/kg。实验结果均以干重表示。
1.3.4气味活度值评价
气味活度值通常用于单一化合物对样品整体气味的贡献,是挥发性风味化合物的浓度与其阈值之比。一般认为,当OAV大于1时,说明该香气成分为样品的关键风味成分[11]。OAV计算方法见式(2)。
(2)
式(2)中,Ci为风味物质的质量分数,μg/kg;OTi为该风味物质的气味阈值,μg/kg。
1.3.5香气代谢酶活性测定
1.3.5.1 LOX活性测定
LOX催化底物亚油酸氧化,生成的产物在 234 nm 处具有特征吸收峰,可通过测定样品在 234 nm 波长处吸光度增加的速率计算LOX酶活。LOX活性单位定义:25 ℃中单位质量(mg)蛋白在单位体积(mL)反应体系中每分钟催化吸光度变化0.01为一个酶活单位。
按照LOX活性测定试剂盒上的方法检测。称取约0.1 g菇粉,加入1 mL硫酸缓冲液[含二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、聚乙烯吡咯烷酮(PVPP)]冰浴匀浆,15 000 r/min、4 ℃离心10 min,取上清液待测。样品组:在EP管中依次加入0.05 mol/L硼酸缓冲液(pH值9.0)790 μL 、亚油酸钠10 μL 及上清液20 μL,混匀。空白组用去离子水替代样品组中的上清液,其他溶液及加入顺序与样品组相同。样品组、空白组各取200 μL混合液移至96孔板中,25 ℃反应5 min,于234 nm处读取吸光度,ΔA=A(测定)-A(空白),LOX酶活计算方法见式(3)。
LOX酶活=ΔA×V(总)÷[Cpr×V(样)]÷0.01÷t=820×ΔA÷ρ(蛋白质)。
(3)
式(3)中,V(总)为反应总体积,820 μL;V(样)为上清液体积,20 μL;t为反应时间,5 min;ρ(蛋白质)为上清液蛋白质量浓度,mg/mL;LOX酶活单位为U/mg。
1.3.5.2 ADH活性测定
ADH催化NADH还原乙醛生成乙醇和NAD+,NADH在340 nm处有吸收峰,而NAD+没有。可通过测定样品340 nm波长处吸光度下降的速率计算ADH活性。ADH活性单位定义:25 ℃中单位质量(mg)蛋白每分钟氧化1 nmol NADH为一个酶活单位。
按照ADH活性测定试剂盒上的方法进行检测。称取约0.1 g菇粉,加入0.1 mol/L PBS(pH值6.0)1 mL,冰浴匀浆,15 000 r/min、4 ℃离心20 min,取上清液置冰上待测。在96孔板中加入Na2HPO4·12H2O、DTT、EDTA、PVPP、免疫染色通透液(Triton-X-100)和NADH的混合液160 μL,再加入乙醛20 μL及上清液20 μL,混匀。于340 nm处读取吸光度,记录15 s和75 s时的吸光度,分别记为A1和A2,ΔA=A1-A2,ADH酶活计算方法见式(4)。
ADH酶活=[ΔA÷ε÷d×V(总)×109]÷[ρ(蛋白质)×V(样)]÷t=3 215×ΔA÷ρ(蛋白质)。
(4)
式(4)中,ε为NADH摩尔消光系数,6.22×103L/(mol·cm);d为96孔板光径,0.5 cm;V(总)为反应总体积,200 μL;V(样)为上清液体积,20 μL;t为反应时间,1 min;ρ(蛋白质)为上清液蛋白质量浓度,mg/mL;ADH酶活单位为nmol/(min·mg) 。
1.4 统计分析
利用SIMCA 14.1软件进行偏最小二乘判别分析;采用SPSS统计软件对实验数据进行统计分析,数据用平均值±标准差(SD)表示,实验重复3次;采用单因素方差分析(one-way ANOVA)对不同干燥时间段样品进行差异显著性分析,P<0.05表示差异显著;相关性分析通过https:∥www.chiplot.online在线平台绘制。
2 结果与分析
2.1 干制过程中挥发性化合物成分分析
采用HS- SPME- GC- MS对不同干制时间段的大球盖菇样品中挥发性风味化合物进行分析,结果见图1。在整个干制过程中共鉴定出245种挥发性化合物,其中包括34种醛类化合物、40种醇类化合物、37种酮类化合物、29种酯类化合物、7种酸类化合物、24种烷烃类化合物、26种烯烃类化合物及48种其他类化合物。不同时间段化合物数量及相对含量统计结果见图1(a)和(b)。由图1(a)和(b)可知,干制过程中挥发性化合物组成及含量存在明显差异。多种化合物在干制过程中生成,又被快速消耗,这说明干制是一个复杂的过程,其中伴随多种化合物的代谢[12]。整个干制过程主要挥发性组分为醛类、醇类及酮类物质,三者含量之和占总化合物干质量的65.49%~89.30%,其中醛类化合物占比在整个过程始终保持最高,其次是醇类化合物,而烯烃类、酸类和酯类化合物占比较低,干制完成时烯烃化合物的种类及含量明显高于鲜菇。
随着干制时间的推进,挥发性化合物总含量变化趋势如图1(c)。由图1(c)可知,干制0~3 h,挥发性化合物总含量趋于稳定;在4~5 h总含量呈明显下降趋势,在5 h时达到最低值,为4.402 87 mg/kg。这可能是因为长时间的加热使细胞失水,参与挥发性物质合成的相关酶受热胁迫的影响,使其酶活降低,即酶促反应受到了抑制。干制6~12 h,挥发性化合物总含量呈现先上升后下降的趋势,6~8 h总量上升,可能原因是非酶促反应加剧,如Maillard反应、类脂氧化反应、Amadori重排、Strecker降解等,并伴随少量酶促反应的发生;8 h后挥发性化合物总量呈下降趋势,这是由于组织的大量失水使子实体内部机体反应停滞,以及自身物质的消耗导致的[13]。
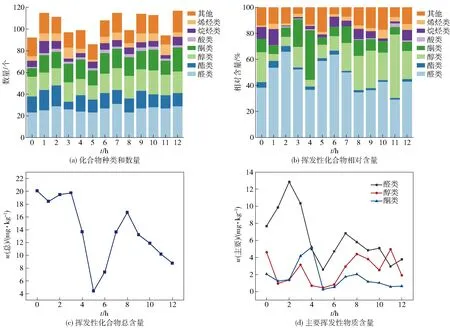
图1 大球盖菇干制过程中挥发性化合物的变化趋势Fig.1 Variation trend of volatile compounds in Stropharia rugosoannulata during drying process
在大球盖菇整个干制过程中醛类化合物最为丰富[图1(b)],其味觉阈值较低,对整体气味贡献度高。醛类化合物主要来源于支链和芳香氨基酸或半胱氨酸的降解及C16~C22不饱和脂肪酸的氧化分解[14]。醛类化合物具有多种香气,微量的醛赋予物质醇厚的香气,过量则会产生刺激性气味。在整个干制过程中,大球盖菇挥发性醛类化合物占总含量的29.15%~65.99%,其含量呈“M”形变化趋势,干制2 h时含量达到最大值,为12.857 mg/kg[图1(d)]。乙醛、2-甲基丁醛、异戊醛、正戊醛、正己醛、2-乙基-2-己烯醛、(E)-2-辛烯醛、苯甲醛等醛类物质存在于整个干制过程,其中含量最多的醛类物质为乙醛(0.192~2.472 mg/kg)、正己醛(1.236~6.705 mg/kg),前者具有水果风味,后者可赋予大球盖菇青香气味[15]。这两种物质随着干制时间的延长含量降低,这主要是因为干制后期该化合物受热易散失而造成损失[16]。苯甲醛和异戊醛作为干制过程中另外两种主要风味化合物,分别具有独特的苦杏仁香及麦芽香气,随着时间的延长两者含量呈上升趋势,这主要是因为长时间高温胁迫使得大分子糖类物质受热分解为葡萄糖和果糖,加速了美拉德反应的发生,同时伴随亮氨酸的Strecker降解,最终导致该类物质的生成,赋予干菇独特的风味。
醇类化合物主要是多不饱和脂肪酸在一系列酶的作用下发生脂质氧化的下游产物,是一类阈值较高的挥发性化合物,当含量足够高时才可对风味起贡献作用[17]。大球盖菇干制过程中挥发性醇类化合物占总含量的5.17%~48.84%[图1(b)],是第二大挥发性化合物,其含量变化波动较大[图1(d)],这可能是因为醇类化合物是代谢下游物质,易受酶活、温度等外界因素的影响。1-辛烯-3-醇、正己醇、甲醇是干制过程中含量较高的醇类化合物,其中1-辛烯-3-醇的质量分数最高(0.122~1.887 mg/kg),这与先前大多报道的1-辛烯-3-醇是食用菌中的典型挥发性八碳化合物的结论一致[18]。1-辛烯-3-醇又称为“蘑菇醇”,具有标志性的蘑菇气味,在干制过程中其含量呈“M”形变化趋势,在干制11 h时达到最大值(1.887 mg/kg)。正己醇具有花香、脂肪香气味,对大球盖菇的呈味起辅助作用,并且随干制进行含量下降。
酮类化合物是一类重要的挥发性化合物,根据链的长度酮类化合物具有不同呈味特性,短链酮具有脂香和焦香味,长链酮具有较强的花香味[19]。干制过程中酮类化合物的变化趋势为0~5 h先上升后下降,在干制4 h时达到最大值,5.212 mg/kg,随后变化不明显[图1(d)]。干制期间主要的酮类化合物为3-辛酮、1-辛烯-3-酮、甲基壬基甲酮和仲辛酮,值得注意的是3-辛酮和1-辛烯-3-酮具有蘑菇味和土壤腥味,在整个干制过程中其含量逐渐降低,鲜菇中含量明显高于烘干样品,可以很好地解释新鲜大球盖菇中浓烈的泥土腥味主要是由3-辛酮和1-辛烯-3-酮发挥的作用。
酯类化合物通常具有典型的果香味及轻微油脂香味,为许多果蔬的主要挥发性化合物。大球盖菇中酯类化合物含量较低,且随干制时间延长逐渐降低,主要原因在于酸、醇类等前体物在长时间热胁迫条件下大量损失,且后期受非酶促反应影响生成杂环类及酮类物质,最终赋予大球盖菇轻微豆香及水果风味[20]。酸类化合物主要呈现腐败的味道,给人带来不愉快的感觉,脂肪酸具有油脂味。大球盖菇干制过程中酸类化合物占比均小于2.75%[图1(b)],且通常阈值较高,即该类化合物对大球盖菇的气味影响不大。烷烃类化合物是一类阈值较高的化合物,干制过程中主要烷烃类物质为正戊烷,可赋予大球盖菇薄荷香味,干制后期烷烃类化合物含量增加,可能是因为烷氧自由基的裂解造成的[21]。除上述化合物外,随着干制时间增加,子实体中产生如2-正戊基呋喃、吡咯等杂环类化合物,可增加干制品特有的坚果或烤焙香气,这类小分子主要是由美拉德反应生成的[22]。
2.2 利用气味活度值和偏最小二乘判别分析对关键风味物质的鉴定结果
风味感官呈现受化合物含量和阈值影响,气味活度值(OAV)用来描述该挥发性风味化合物对样品气味的贡献程度[23]。已有研究报道,OAV在0.1~1.0的化合物具有修饰风味的作用,大于1.0表明该化合物为关键风味物质,且值越大对样品的整体气味特性贡献越大[24]。本研究对已报道阈值的风味化合物进行OAV计算,根据OAV结果共筛选出45种关键风味化合物(OAV>1),结果见表2[25-27]。由表2可知,在大球盖菇整个干制过程中,1-辛烯-3-酮阈值较低,对应得到的气味活度值最高,说明1-辛烯-3-酮是大球盖菇子实体中风味贡献最大的化合物。此外,异戊醛、正己醛、(E,E)-2,4-癸二烯醛、1-辛烯-3-醇、1-辛烯-3-酮、三甲胺均具有较高的OAV(数值远大于1.0),即这些化合物对大球盖菇的整体风味具有较高的贡献。
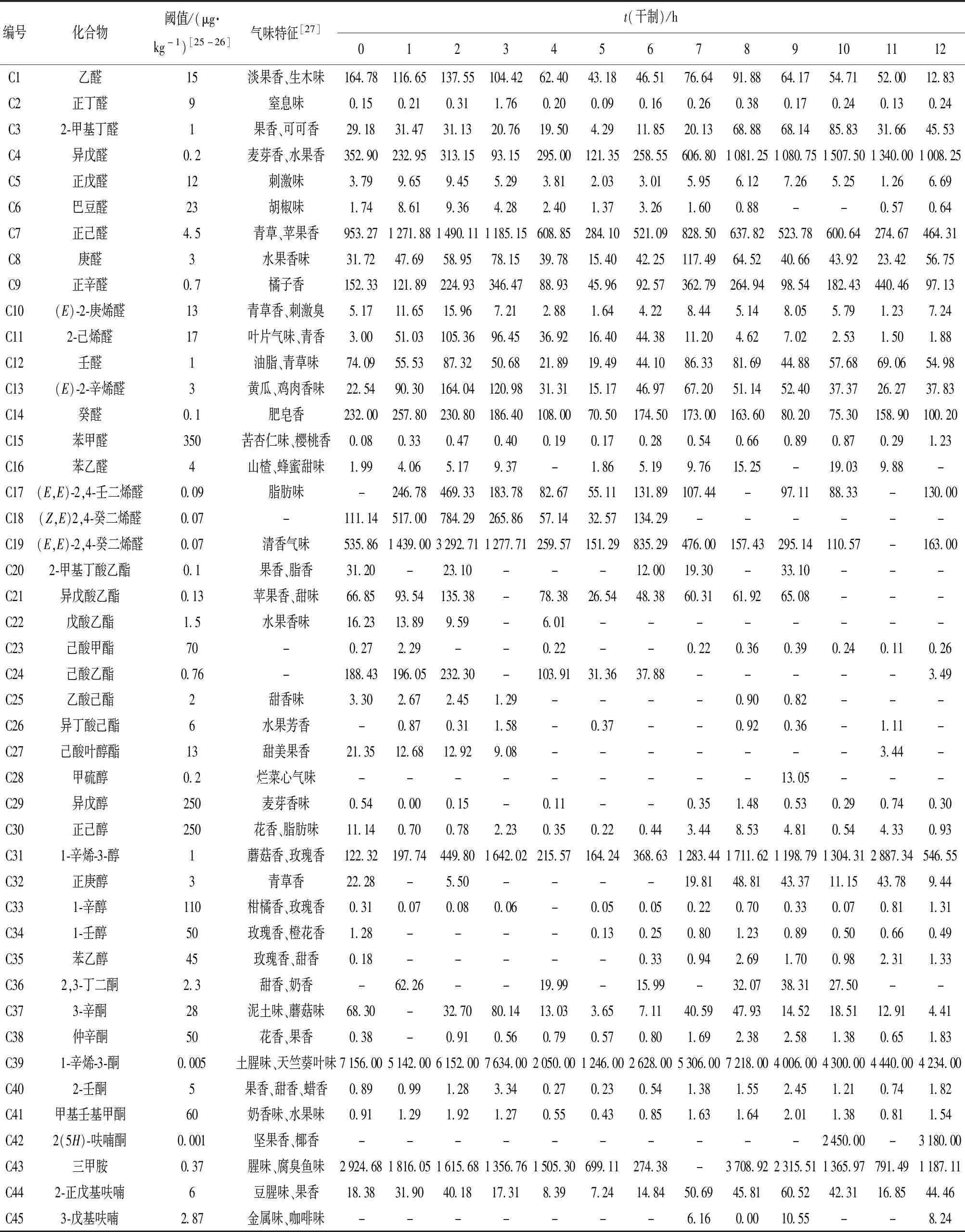
表2 大球盖菇干制过程中关键挥发性化合物的OAVTab.2 OAV of key volatile compounds in Stropharia rugosoannulata during drying process
为了更直观地观察干制过程中45种关键化合物的变化,本研究对这45种化合物进行OAV热图分析,见图2,通过颜色梯度变化反映不同干制时间点在各分类水平上化合物组成的相似性和差异性。图2中红色表示OAV较高,蓝色表示OAV较低。聚类分析结果表明:干制1 h和2 h OAV相似度高,主要气味贡献物质是(E,E)-2,4-癸二烯醛、1-辛烯-3-酮等;干制4 h和5 h时OAV相似度高,主要气味贡献物质是1-辛烯-3-酮、三甲胺等;干制7 h和9 h OAV相似度高,主要气味贡献物质是1-辛烯-3-酮等;干制8 h和11 h时OAV相似度高,主要气味贡献物质是1-辛烯-3-酮、1-辛烯-3-醇等;干制10 h和12 h时OAV相似度高,主要气味贡献物质是1-辛烯-3-酮、2(5H)-呋喃酮等。干制6 h与干制4、5 h可形成二次聚类,说明其具有相似性;同样干制10、12 h与干制8、11 h形成二次聚类;以此类推逐级向上分,级数越高相似度越低。从整个干制过程的聚类图来看,可以将13个干制时间段大致分为两大类:干制前期0~6 h(Ⅰ类)及干制后期7~12 h(Ⅱ类)。对热图进一步分析表明,1-辛烯-3-酮在整个干制过程中始终是风味贡献最大的化合物,(E,E)-2,4-癸二烯醛、己酸乙酯、正己醛的气味贡献度随着干制的进行逐渐减小,而2(5H)-呋喃酮、异戊醛、2-甲基丁醛、2-正戊基呋喃等化合物主要在干制后期发挥贡献作用。由此可知,干制过程中大球盖菇的气味变化特点是,鲜菇具有强烈的土腥味、青香味,随干制进行该类物质的含量逐渐减少,干制后期呈现麦芽香、坚果香等风味,但整个过程中蘑菇味、土腥味仍是大球盖菇的关键风味特征。
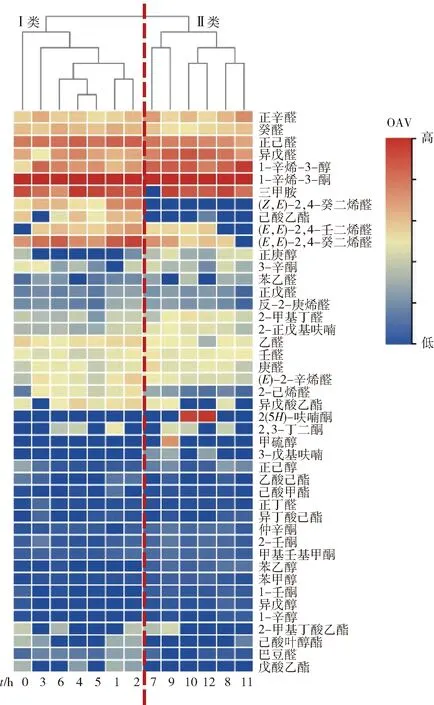
图2 大球盖菇干制过程中关键挥发性风味物质的气味活度值热图Fig.2 Heatmap of OAV of key volatile flavor compounds in Scropharia rugosoannulata during drying process
利用偏最小二乘判别法(PLS- DA)对干制过程中45种关键挥发性化合物的种类及含量的动态变化进行可视化呈现,见图3。由PLS- DA模型提取出3个主成分模型参数:R2X(cum)为0.618(>0.5),R2Y(cum)为0.973(>0.5),足以对X,Y矩阵数据做出解释,Q2(cum)为0.788(>0.5),说明预测模型拟合度合理。由载荷得分图[图3(a)与图3(b)]可知,两个阶段样品(紫色点)在主成分1(PC1)上呈负相关,表明组间差异显著;对于组内(黄色点)分析可知,每个样本点均独立存在,说明样本之间差异性显著。对载荷图中的信息进一步分析,得到样本与关键挥发性化合物之间具有一定的相关性,如C11(2-己烯醛)、C19[(E,E)-2,4-癸二烯醛]始终分布在干制2 h样本点周围,赋予该阶段大球盖菇叶片气味、青香气味;而C29(异戊醇)始终分布在干制8 h周围,可赋予该阶段大球盖菇麦芽香气。由此得出结论:不同时间点呈现的气味特性,是由其独特化合物导致的[28]。此外,经VIP得分值分析得到干制前期(0~6 h)和后期(7~12 h)的差异关键挥发性化合物(VIP>1)共20个,见图3(c)。结合表2的呈味特征分析,干制前期贡献成分为乙酸乙酯、2-己烯醛、巴豆醛、异戊醇、(Z,E)-2,4-二烯醛、戊酸Z酯、(E,E)-2,4-二烯醛和己酸叶醇酯等8个化合物,风味呈现以青草、叶片清香为主(OAV远大于1.0);其他12个化合物为干制后期贡献成分,风味呈现麦芽、果香和蘑菇香味。由此结论进一步论证了热图分析的结果,随着干制时间增加,大球盖菇风味特征由青草味向浓郁的蘑菇香气转变。
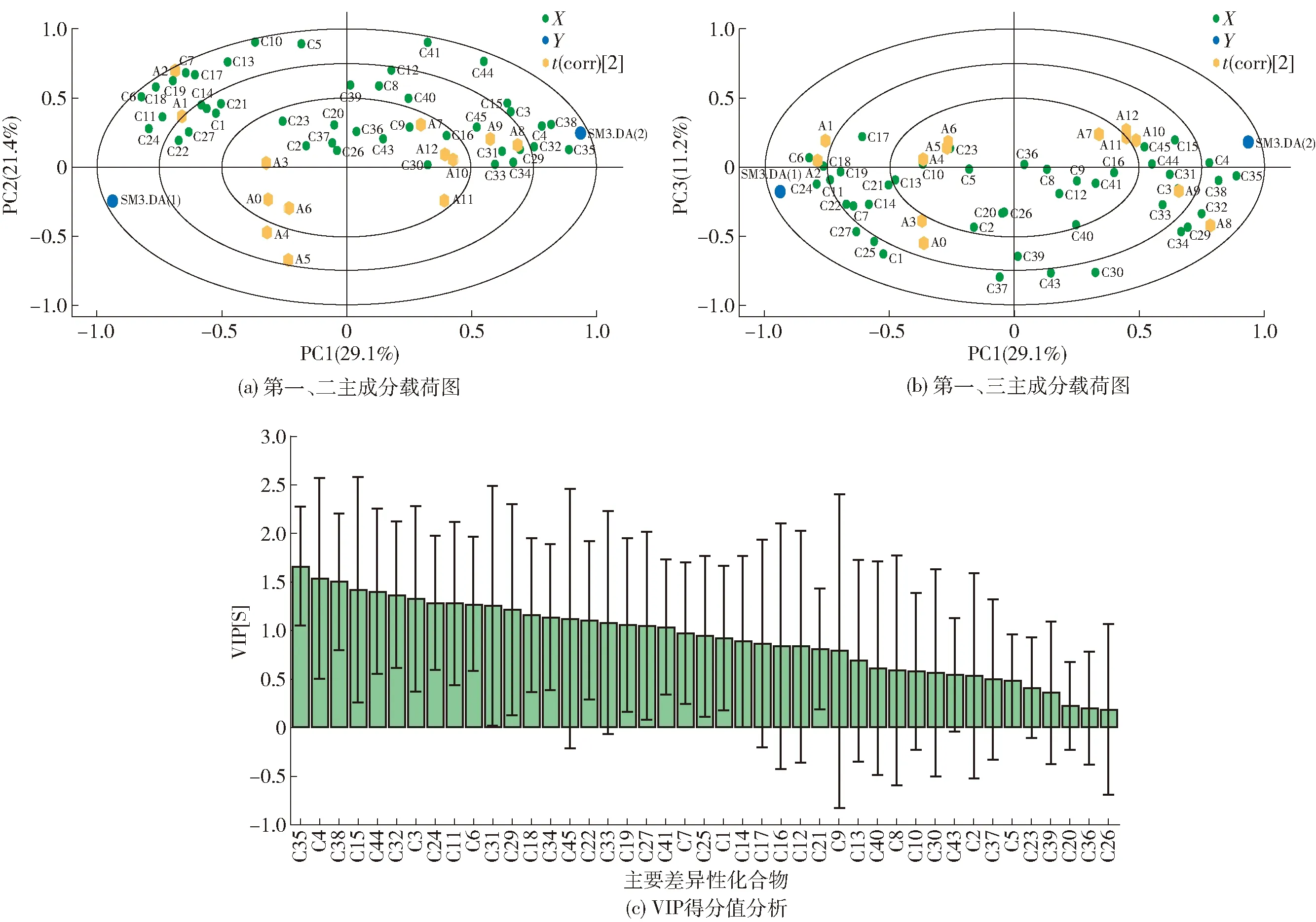
图3 关键挥发性风味物质偏最小二乘法分析Fig.3 Analysis of key volatile flavor compounds by partial least square method
2.3 香气代谢关键酶活性变化及其与主要香气成分关系
挥发性风味化合物主要是通过机体内部的非挥发性前体物质经过一系列生物化学反应生成的。本研究通过对大球盖菇干制过程中挥发性化合物组成、含量及气味活度值的综合评定,结果表明,影响其风味呈现的关键挥发性物质主要是醛类、酮类及醇类化合物,以醛类最为丰富。植物机体内醛类物质大致有3种产生途径:通过以不饱和脂肪酸为前体物的LOX代谢途径合成,在一系列酶的作用下进行醛、酮、酸及醇类等化合物的相互转换[29];通过游离氨基酸介导的Strecker降解反应合成;通过非酶促美拉德反应获得。LOX代谢途径是合成C6、C8、C9醛类化合物的主要途径[30],所生成代谢产物包含本研究得到的关键挥发性风味化合物。所以本研究进一步对大球盖菇干制过程中涉及的关键酶促反应进行分析,见图4。LOX代谢途径主要分为4个阶段[图4(a)]:1)酰基水解酶使类脂水解产生游离脂肪酸(主要是亚油酸和亚麻酸);2)游离脂肪酸在LOX作用下被氧化为C9-、C10-、C13-氢过氧化物;3)在氢过氧化物裂解酶(hydroperoxide lyase, HPL)的作用下氢过氧化物被进一步分解为C6-、C8-、C9-醛、酮类化合物;4)HPL酶解产物在ADH的还原作用下实现对相应醇类化合物的转换[31]。香气代谢合成酶的活性会导致风味化合物成分及含量的变化,直接影响食品的风味[32]。
本研究对LOX代谢途径中的关键酶LOX及ADH活性进行测定,分析在整个干制过程中风味酶酶活性的变化趋势,见图4(b)。结果表明,酶活随干制时间的延长整体呈显著下降的趋势,在干制 10 h 后酶活性达到最低且随时间延长不再变化。对于LOX活性,在干制0~3 h呈“V”形变化趋势,干制3 h时酶活达到最大值(1 784.84 U/mg),随后酶活呈下降趋势。这是因为干制使得子实体外界环境突然升高,导致机体内部平衡紊乱使酶活下降;随干制时间的延长,机体适应环境,内部平衡恢复,合成酶发生热激活,有利于风味前体物的形成;后期温度持续升高,使细胞失水、细胞通透性降低,最终导致酶活下降。对于ADH活性,在整个干制过程中呈“M”形变化趋势,干制1 h和5 h时ADH受热激活,其活性显著高于其他时间点,这说明在55 ℃的干制条件下该酶具有良好的热稳定性。值得注意的是,LOX的酶活明显高于ADH的酶活,这为合成醛类化合物提供了足够的前体物,这也是大球盖菇中醛类化合物整体含量较多的原因之一。
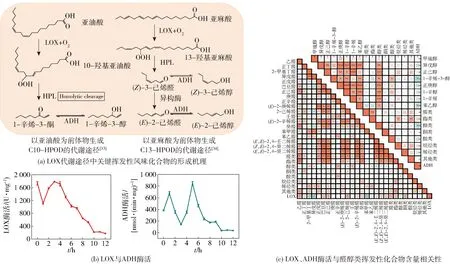
图4 大球盖菇干制过程中关键酶活性分析Fig.4 Analysis of key enzyme activity in Stropharia rugosoannulata during drying process
将LOX和ADH两种香气代谢合成酶酶活与醛、醇类关键风味化合物含量及8类化合物总含量进行相关性分析[图4(c)],结果表明:LOX酶活与大部分醛类化合物含量呈现正相关性,其中与大球盖菇关键香气组分乙醛、正己醛及2-己烯醛呈显著正相关(P<0.05),该类化合物的前体物在LOX酶活较高的干制前期(0~6 h)得到迅速积累,为大球盖菇特征香气中略带青草味奠定基础;LOX酶活与酮类化合物总量亦呈显著正相关(P<0.05),与醛类同属不饱和脂肪酸氧化降解产物,产生的短链酮增加了大球盖菇脂香和焦香味。ADH活性与醇类化合物含量具有较强的负相关性,这是因为ADH介导的醇与醛、酮之间的相互转化是一个可逆反应,致使大球盖菇醇类化合物同样保持较高的含量,且整个干制过程波动较大;ADH活性与1-辛烯-3-醇和苯乙醇呈显著负相关(P<0.05),随着干制后期(7~12 h)酶活降低,这两种化合物得到累积,其OAV分别为122.32~2 887.34和0.18~2.69(表2),从而呈现较为浓郁的蘑菇香气。
3 结 论
本研究通过顶空固相微萃取结合气质联用技术在大球盖菇干制过程中共鉴定出245种挥发性化合物,包括34种醛类化合物、40种醇类化合物、37种酮类化合物、29种酯类化合物、7种酸类化合物、24种烷烃类化合物、26种烯烃类化合物及48种其他类化合物。干制过程中挥发性化合物组成及含量存在明显差异,其中醛、酮及醇类占比最大,为大球盖菇中主要的挥发性物质。通过气味活度值结合热图聚类分析,筛选出45种关键风味化合物,其中1-辛烯-3-酮始终是干制过程中气味贡献最大的化合物,其次是1-辛烯-3-醇、正己醛等物质;通过偏最小二乘判别分析法对45种关键化合物进行分析,得出干制前后期共有20种差异性化合物,综合分析表明,随着干制的进行,大球盖菇土腥味、青草味逐渐减弱,干制后期由于美拉德反应生成多种杂环类小分子化合物赋予大球盖菇焦香、麦芽香等风味,丰富了大球盖菇的风味,但整个过程中蘑菇味、土腥味仍是大球盖菇的关键风味特征。由于香气代谢合成酶的活性会导致风味化合物成分及含量的变化,本研究通过对合成醛、醇、酮类化合物的主要酶促反应LOX途径中相关香气代谢酶活性进行测定,分析整个干制过程中该类酶活性变化趋势,旨在为干制过程中醛、醇、酮类化合物含量的动态变化提供理论依据。结果表明,LOX、ADH具有热激活现象,有利于干制过程中醛、醇、酮类化合物的生成,酶活随干制的进行整体呈显著下降的趋势,在干制终点香气代谢酶几乎没有活性。对代谢酶活性与对应化合物含量进行相关性分析发现,LOX活性与醛类化合物含量具有较强的正相关性,其中与乙醛、正己醛及2-己烯醛呈显著正相关(P<0.05),为大球盖菇特征香气中略带青草味奠定基础。ADH活性与醇类化合物含量具有较强的负相关性,该酶可催化醇与醛、酮类化合物之间发生可逆转换。ADH活性与1-辛烯-3-醇和苯乙醇具有显著负相关性(P<0.05),从而使得大球盖菇呈现较为浓郁的蘑菇香气。本研究旨在揭示大球盖菇干制过程的气味特性的变化趋势,希望为大球盖菇进一步的开发利用提供理论依据。

