+15 Gz重复暴露对小鼠CD4+T淋巴细胞的影响
傅昭粤,沈娱汀,李 娟,王 宁,方 亮,陈丽华
(空军军医大学基础医学院免疫学教研室,陕西 西安 710032)
战斗机在高速飞行过程中,由于飞行速度和方向发生改变,会产生加速度作用。如飞机俯冲改出时,飞行员可受到由足向头的持续性正加速度(positive acceleration,+Gz)作用[1-2]。现代战斗机在飞行过程中能产生持续时间长达45 s,以及高达6 G/s的加速度增长率,在此作用下飞行员会受到高达+9 Gz的重复暴露[3-5]。因此,随着现代高性能战斗机的列装,航空环境对飞行员的影响不容小觑,其持续性+Gz所引起的应激会导致飞行员身体机能和作业效能发生不同程度的变化[6-8]。在高+Gz的作用下,飞行员的免疫系统也会发生许多变化。既往研究发现,在+Gz作用下,CD4+T细胞亚群比例会发生改变[9],提示+Gz可能会影响免疫系统的稳态[10-11]。CD4+T细胞是一个异质性群体,根据其细胞膜标记分子、分泌的细胞因子、表达的转录因子和功能的不同可分为Th1、Th2、Th9、Th17、滤泡辅助性T细胞和调节性T(regulatory T, Treg)细胞等亚群[12]。既往关于+Gz对CD4+T细胞影响的研究并不多见[13],关于高+Gz暴露对Treg细胞影响的研究更是少有报道。
鉴于此,本研究在成功建立+15 Gz重复暴露7 d小鼠模型的基础上,初步探讨高+Gz重复暴露下小鼠免疫系统中CD4+T细胞和Treg细胞的变化,为后续进一步深入研究打下基础。
1 材料与方法
1.1 材料
实验选用10只6~8周龄C57BL/6雄性小鼠,平均体质量为20 g,均为SPF级。将小鼠随机分为+15 Gz组(+15 Gz,15 min/d,7 d)和对照组(0 Gz,15 min/d,7 d),每组5只。本实验经空军军医大学实验动物福利与伦理委员会审批通过(许可证号:20180101)。
1.2 方法
1.2.1 +Gz暴露 通过动物离心机构建+15 Gz重复暴露7 d小鼠模型[14]。通过小鼠固定器将小鼠水平固定于离心机的转臂上,头部面向离心机转臂轴心。+15 Gz组小鼠重复暴露于+15 Gz,15 min/d(峰值作用时间),共持续7 d。对照组小鼠仅放置于固定器中,不进行+Gz暴露。小鼠重复暴露7 d后,进行后续实验。
1.2.2 脾脏细胞的提取及单细胞悬液的制备 45 mg/kg戊巴比妥钠腹腔注射麻醉小鼠后,采用颈椎脱臼法处死小鼠。将小鼠浸泡于750 mL/L乙醇5 min后,转移至超净工作台。从小鼠左侧腹部中部剪开皮肤,暴露腹壁,并解剖分离小鼠脾脏。用剪刀将组织剪碎,加入5 mL小鼠淋巴细胞分离液,用研磨棒研磨至没有明显红色块状物。将研磨后的脾脏细胞收集于离心管中,液面上加0.5~1 mL RPMI 1640培养基,800g离心30 min(设置离心机刹车速度为0档)。离心后吸取白膜层,加10 mL PBS重悬,1 000 r/min离心5 min,弃上清。用细胞染色缓冲液重悬后,进行细胞计数,等待后续实验。
1.2.3 外周血单细胞悬液制备 45 mg/kg戊巴比妥钠腹腔注射麻醉小鼠后,进行眼球取血。收集小鼠外周血于2 mL EP管中,离心,弃上清。加入1 mL红细胞裂解液,室温裂解5 min,加入10 mL PBS中和,300g离心5 min后弃上清。用细胞染色缓冲液重悬脾脏细胞后计数。
1.2.4 流式细胞术 分别调整脾脏和外周血单细胞悬液的细胞浓度至5×109~1×1010个/L,转移至对应流式管中。通过Percp标记的抗小鼠CD4抗体(0.25 μg,100432;Biolegend,美国)、PE标记的抗小鼠CD25抗体(0.25 μg,113704;Biolegend,美国)以及Alexa Fluor 488标记的抗小鼠Foxp3抗体(0.25 μg,126406;Biolegend,美国)确定是否为Treg细胞,对照管加入相应的同型对照抗体(0.25 μg,400630,400508,400625;Biolegend,美国)。通过APC标记的抗小鼠CD4抗体(0.25 μg,100516;Biolegend,美国)、FITC标记的抗小鼠CD49b抗体(0.25 μg,103504;Biolegend,美国)和PE标记的抗小鼠LAG-3抗体(0.25 μg,125208;Biolegend,美国)确定是否为1型调节性T(type 1 T regulatory,Tr1)细胞。对照管加入相对应的同型对照抗体(0.25 μg,400512,400906,400408;Biolegend,美国)。4 ℃避光孵育30 min,加入2 mL流式洗液,清洗2次后弃上清。200~400 μL流式洗液重悬细胞后上机检测。
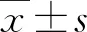
2 结果
2.1 +15 Gz暴露对小鼠脾脏CD4+ T细胞的影响
在小鼠完成+15 Gz重复暴露7 d后,制备其脾脏单细胞悬液,并通过流式细胞术进行检测。结果显示,与对照组相比,+15 Gz组小鼠脾脏中CD4+T细胞比例和数量变化均无显著差异(图1)。以上结果证明,+15 Gz重复暴露7 d并未引起脾脏CD4+T细胞比例和数量的改变。
A:流式细胞术检测对照组小鼠脾脏CD4+T细胞的代表图;B:流式细胞术检测+15 Gz组小鼠脾脏CD4+T细胞的代表图;C:对照组和+15 Gz组脾脏CD4+T细胞比例的统计图;D:对照组和+15 Gz组脾脏CD4+T细胞数量的统计图。
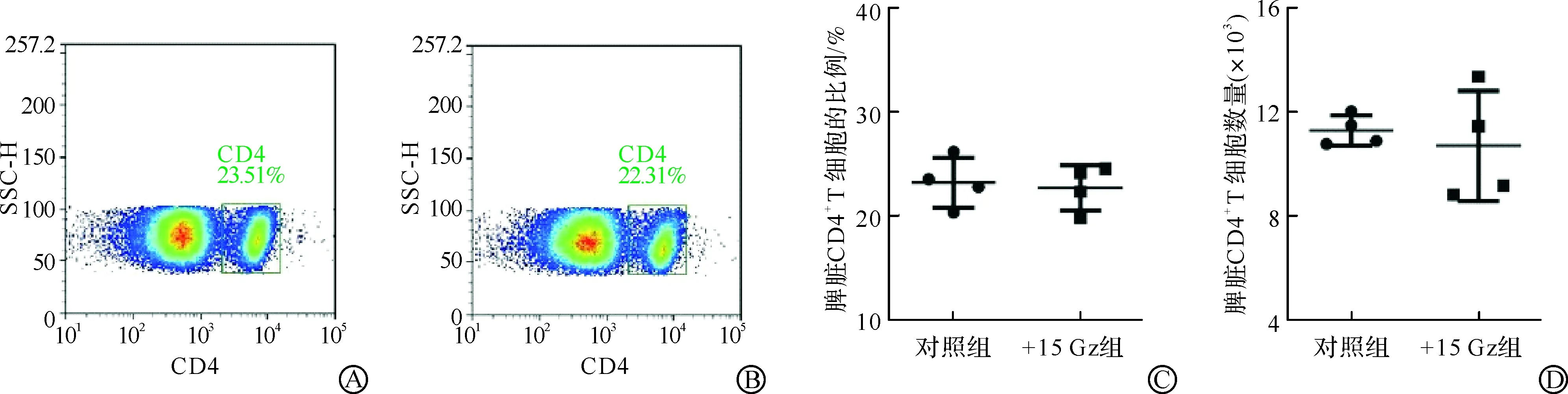
2.2 +15 Gz暴露对小鼠外周血CD4+T细胞的影响
为研究+15 Gz重复暴露对小鼠外周血CD4+T细胞比例和数量的影响,取+15 Gz重复暴露7 d后小鼠的外周血,制备单细胞悬液,并通过流式细胞术进行检测。对照组和+15 Gz组小鼠外周血CD4+T细胞流式检测代表图如图2A~B所示。结果显示,对照组CD4+T细胞比例平均值为15.41%,+15 Gz组CD4+T细胞比例平均值为18.80%(图2C),对照组CD4+T细胞数量平均值为3 950,+15 Gz组CD4+T细胞数量平均值为6 991(图2D)。+15 Gz暴露后小鼠外周血CD4+T细胞所占比例较对照组有所升高,但无统计学差异。而+15 Gz暴露后小鼠外周血CD4+T细胞数量相比对照组显著升高(P<0.05)。以上结果表明,+15 Gz重复暴露7 d显著上调外周血CD4+T细胞的数量。
A:流式细胞术检测对照组小鼠外周血CD4+T细胞的代表图;B:流式细胞术检测+15 Gz组小鼠外周血CD4+T细胞的代表图;C:对照组和+15 Gz组外周血CD4+T细胞比例的统计图;D:对照组和+15 Gz组外周血CD4+T细胞数量的统计图(aP<0.05)。
2.3 +15 Gz暴露对小鼠脾脏Treg细胞的影响
Treg细胞作为CD4+T细胞的亚群之一,在免疫应答的负调节及自身免疫耐受中发挥着重要的作用。因此,我们进一步探究+15 Gz重复暴露7 d后小鼠脾脏Treg细胞的变化情况。对照组和+15 Gz组小鼠脾脏Treg细胞流式检测代表图如图3A~B所示。结果显示,对照组和+15 Gz组小鼠脾脏Treg细胞比例平均值分别为12.95%和12.40%(图3C),脾脏Treg细胞数量平均值分别为2 482和2 497(图3D),两组小鼠脾脏Treg细胞比例和数量均无统计学差异。
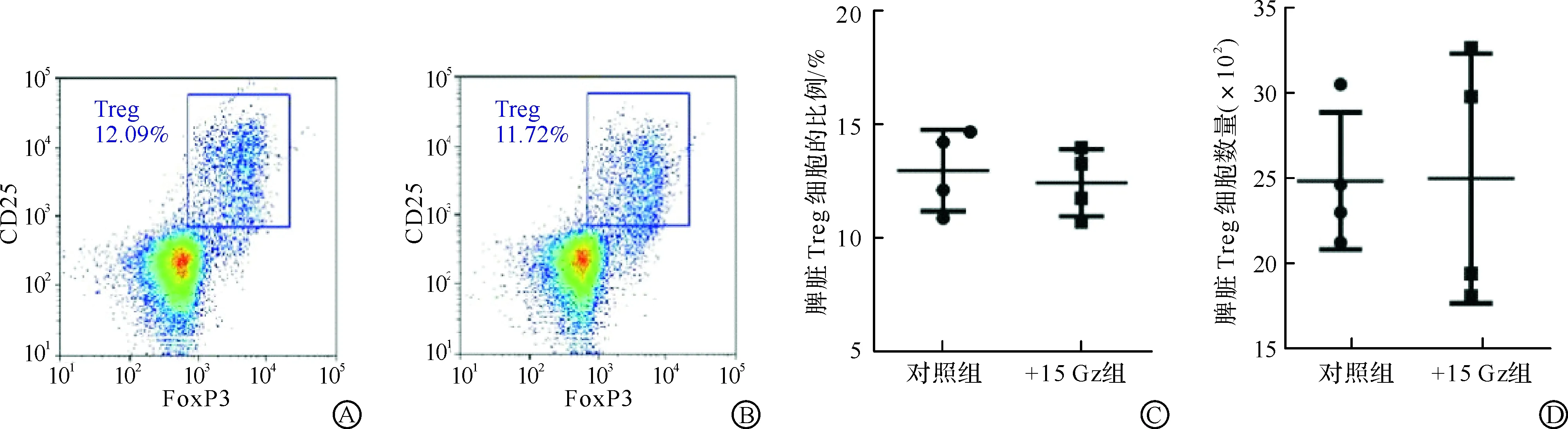
A:流式细胞术检测对照组小鼠脾脏Treg细胞的代表图;B:流式细胞术检测+15 Gz组小鼠脾脏Treg细胞的代表图;C:对照组和+15 Gz组脾脏Treg细胞占CD4+T细胞比例的统计图;D:对照组和+15 Gz组脾脏CD4+T细胞中Treg细胞数量的统计图。
2.4 +15 Gz暴露对小鼠外周血Treg细胞的影响
为进一步探讨+15 Gz重复暴露是否影响外周血Treg细胞的比例和数量,在完成+15 Gz暴露7 d后,获取小鼠外周血并制备单细胞悬液,通过CD25和Foxp3双阳性表达来确定Treg细胞。对照组和+15 Gz组小鼠外周血Treg细胞流式代表图如图4A~B所示。结果显示,相比对照组,+15 Gz组外周血CD4+T细胞中Treg细胞的比例显著下降(P<0.05),但数量无显著变化。以上结果表明,+15 Gz暴露显著下调小鼠外周血CD4+T细胞中Treg细胞的比例。
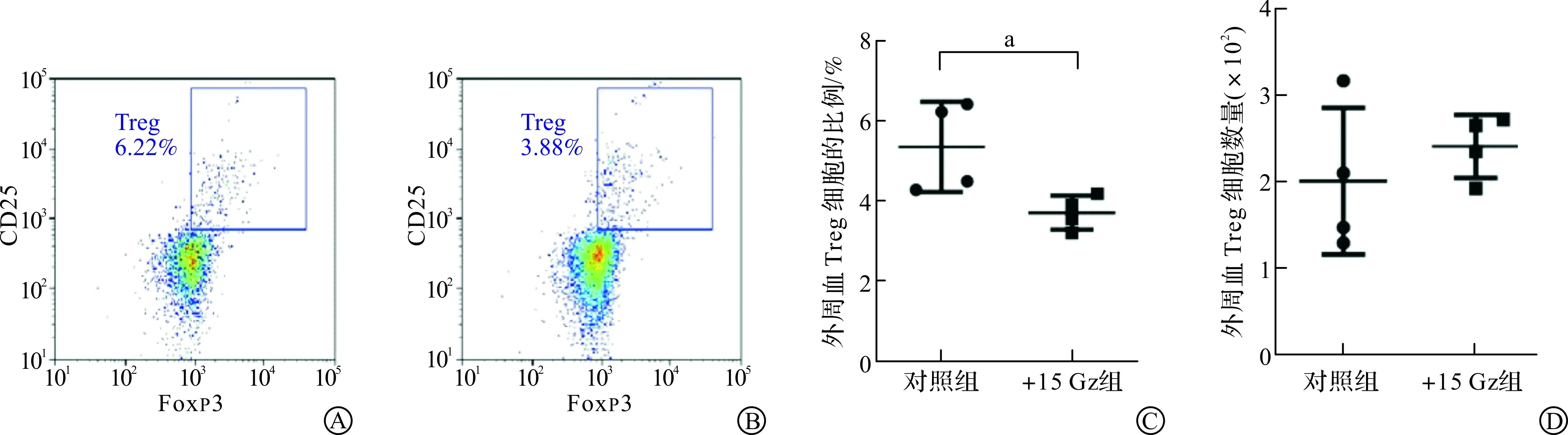
A:流式细胞术检测对照组小鼠外周血CD4+ T细胞中Treg细胞的代表图;B:流式细胞术检测+15 Gz组小鼠外周血CD4+ T细胞中Treg细胞的代表图;C:对照组和+15 Gz组外周血CD4+ T细胞中Treg细胞比例的统计图(aP<0.05);D:对照组和+15 Gz组外周血CD4+ T细胞中Treg细胞数量的统计图。
2.5 +15 Gz暴露对小鼠脾脏Tr1细胞的影响
Tr1细胞是2004年发现的一种重要的Treg细胞亚群,其表型是CD4+LAG-3+CD49b+,能分泌大量IL-10,同时具有免疫抑制作用,因而在免疫稳态维持、移植耐受等中发挥重要作用[15]。为进一步深入研究+Gz是否影响Tr1细胞的比例和数量,在+15 Gz重复暴露7 d后,获取小鼠脾脏并制备单细胞悬液,通过CD49b和LAG-3双阳性表达来确定CD4+T细胞中的Tr1细胞亚群(图5A~B)。结果显示,两组小鼠脾脏CD4+T细胞中Tr1细胞的比例和数量虽有所下降,但无统计学差异(图5C~D),表明+15 Gz对于脾脏CD4+T细胞中Tr1细胞亚群的比例和数量无显著影响。
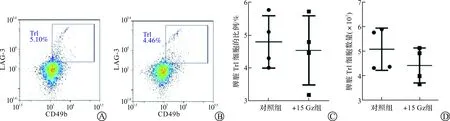
A:流式细胞术检测对照组小鼠脾脏CD4+ T细胞中Tr1细胞的代表图;B:流式细胞术检测+15 Gz组小鼠脾脏CD4+T细胞中Tr1细胞的代表图;C:对照组和+15 Gz组脾脏CD4+ T细胞中Tr1细胞比例的统计图;D:对照组和+15 Gz组脾脏CD4+T细胞中Tr1细胞数量的统计图。
3 讨论
尽管许多研究发现,持续的+Gz暴露会对飞行员的心血管系统、神经系统、骨骼肌肉系统和免疫系统等产生影响[16-18],但关于+Gz对免疫系统影响的研究并不全面,且+Gz影响CD4+T细胞比例和数量变化的研究报道也并不一致[10,13]。CD4+T细胞,又称为辅助性T细胞,通过协调其他免疫细胞和非免疫细胞的功能在机体免疫应答中发挥着重要作用[19]。CD4+T细胞是包含多种细胞亚群的异质性细胞群体,其中的Treg细胞尽管所占比例很低,但其可通过抑制效应细胞的过度应答维持免疫耐受,在机体免疫应答中发挥着重要的免疫调节作用[20-21]。因此,本研究对+15 Gz暴露后小鼠脾脏和外周血中CD4+T细胞和Treg细胞比例和数量的变化进行了初步的探究。
在本研究中,我们发现+15 Gz重复暴露7 d后小鼠脾脏CD4+T细胞和Treg细胞的比例和数量无显著变化,但+15 Gz重复暴露可显著升高外周血CD4+T细胞的数量,尽管+15 Gz组外周血CD4+T细胞比例有所上调,但由于实验条件的限制,每组小鼠数量较少,故无统计学差异。有文献报道,+15 Gz的重复暴露在小鼠体内形成应激的生理环境,胸腺等中枢免疫器官中的T细胞进入外周循环,导致外周血CD4+T细胞比例和数量上调[22];而外周血中Treg细胞所占比例较低,仅占3%~5%[23],外周血CD4+T细胞比例和数量的上调使得Treg细胞的比例相对下调。此外,应激条件可导致CD4+T细胞中的Th1细胞比例上调[24],这也可能是外周血中Treg细胞比例相对减少的原因之一。脾脏作为外周免疫器官,为成熟淋巴细胞定居的场所。尽管+15 Gz在小鼠体内形成应激的生理环境,但7 d的暴露时间较短,T细胞发育成熟后通过外周循环到达脾脏的时间较长[25],因此所检测出的脾脏CD4+T细胞、Treg细胞、Tr1细胞均无显著变化。后续我们将扩大每组样本数量并延长暴露时间,以进一步研究+15 Gz重复暴露对脾脏CD4+T细胞及其亚群变化的影响。Tr1细胞最早于1997年由Roncarolo研究小组明确提出,是CD4+Foxp3-的T细胞(显著区别于天然调节性T细胞),能够分泌大量IL-10[26]。2013年,该研究小组的GAGLIANI等[27]进一步证实Tr1细胞的表型是CD4+CD49b+LAG-3+CD226+,其中CD4、CD49b和淋巴细胞活化基因-3等分子稳定表达在Tr1细胞表面,而CD226分子的表达水平则随Tr1细胞功能状态不同而发生变化。Tr1细胞表型的确定不仅能够用于分离体外培养的Tr1细胞,还可以用于追踪同种异体造血干细胞移植耐受患者外周血中以及其他免疫性疾病患者体内的Tr1细胞,更重要的是有助于进一步研究Tr1细胞的分化、增殖和功能,使得纯化Tr1细胞用于诱导免疫耐受治疗免疫性疾病成为可能[28]。本实验结果发现,在+15 Gz作用下Tr1细胞并无显著变化,可能与暴露时间较短,暂未引起脾脏中该细胞亚群变化有关。
综上所述,本研究在成功构建+15 Gz重复暴露7 d小鼠模型的基础上,初步分析其脾脏和外周血中CD4+T细胞和Treg细胞比例和数量的变化。研究发现,短时间的+15 Gz作用并未显著影响脾脏中CD4+T细胞和调节性T细胞的比例和数量变化;而7 d的+15 Gz重复暴露显著上调外周血中CD4+T细胞的数量,同时显著下调外周血CD4+T细胞中Treg细胞的比例。因此,本研究的结果不仅为高+Gz暴露对机体CD4+T细胞和Treg细胞比例和数量的影响提供了新的实验数据,也为通过检测外周血CD4+T细胞及其亚群比例的变化较早期地了解飞行员免疫系统状态提供了数据参考。

