模拟失重对大肠埃希菌基因表达的影响
李华娴,韩佩君,刘 勇,王文岚
(空军军医大学航空航天医学系航空航天卫生学教研室,陕西 西安 710032)
随着我国航天事业的飞速发展,航天员在空间站工作的时间越来越长,在航天多种特殊环境中,失重一直是研究者们最为重视的一种环境。有研究表明,在航天失重环境中,人体的免疫力会有所下降,使航天员的身体对抗各种致病微生物的能力下降[1]。同时,长期寄居于人体的正常菌群及条件致病菌在航天特殊环境中也同样会受到失重环境的影响。在航天飞行期间,这些细菌可以在失重条件下发生毒力、耐药性变化等,导致其致病性增强[2-3],从而使航天员患感染性疾病的可能性增加,也可对航天环境中的空气、水、食品安全性造成威胁。
大肠埃希菌是寄居于人体肠道内最常见的条件致病菌,在一定条件下可以引起胃肠道、泌尿道等多种局部组织器官感染,对人体健康具有潜在的威胁。既往研究表明,在模拟航天失重环境下,大肠埃希菌、铜绿假单胞菌、沙门氏菌、肺炎克雷伯菌等的基因表达可发生相应的变化,如在模拟失重条件下培养大肠埃希菌K12后,统计分析后发现了16个上调基因和19个下调基因[4];与正常重力组相比,在模拟失重环境下培养肺炎克雷伯菌14 d,共有171个基因表达失调,包括负责3型纤维体及其调节因子的基因,可导致其生物膜形成能力增强[5];一项研究证实,模拟失重诱导了鼠伤寒沙门氏菌163个基因差异表达,包括10个Ⅲ型分泌系统毒力基因(表达下调),以及其他转录调节剂、毒力因子、脂多糖生物合成酶、铁酶利用和功能未知蛋白质的表达差异[6]。寄生于人体内的大肠埃希菌长时间受到模拟失重环境的影响,会引起其基因表达变化,从而导致生物学性状和毒力改变[7-8],继而影响航天员健康和航天器环境生物安全。因此,研究模拟失重环境下大肠埃希菌基因表达的变化及其与生物学性状变化间的联系,可为航天员的身体健康提供保障,为未来的航天生物安全防护打好基础。
1 材料与方法
1.1 材料
1.1.1 菌种 大肠埃希菌(CICC 10389)购自中国工业微生物菌种保藏管理中心。
1.1.2 试剂 胰蛋白胨、酵母提取物、NaCl、RNA保存液、Total RNA Extractor 购自生工生物工程(上海)股份有限公司;Qubit 2.0 RNA检测试剂盒、Qubit RNA检测试剂盒、Qubit DNA检测试剂盒购自美国Life Technologies公司;Ribo-off rRNA Depletion kit(bacteria)、VAHTSTMStranded mRNA-seq V2 Library Prep Kit for Illumina®、VAHTSTMDNA Clean Beads购自南京诺唯赞生物科技股份有限公司。
1.1.3 仪器 Gravite重力控制系统(日本Space Bio Laboratories公司);恒温培养箱(北京科伟永兴仪器有限公司);恒温振荡器(苏州培英实验设备有限公司);恒温振荡培养箱(上海铱晶科技有限公司);生物安全柜(美国Nuaire公司);生物安全型离心机(美国Bio-Rad公司);Qubit 2.0荧光计、Qubit荧光计(美国Invitrogen公司);微型漩涡混合仪(上海沪西分析仪器厂有限公司);台式高速低温离心机(美国Thermo Scientific公司);电泳仪(北京市六一仪器厂);生物电泳图像分析(上海复日科技有限公司);微量分光光度计[美林恒通(北京)仪器有限公司];PCR仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 培养基配置 溶菌肉汤(Luria-Bertani,LB)液体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 5 g,溶解在1 L双蒸水中,121 ℃高压灭菌30 min后,于4 ℃保存。
LB固体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 5 g,琼脂粉20 g,溶解在1 L双蒸水中,121 ℃高压灭菌30 min后,将液体倒入细菌培养皿中,凝固后放至4 ℃保存。
1.2.2 大肠埃希菌培养 为明确模拟失重条件对大肠埃希菌基因的影响,把大肠埃希菌分为两组(正常重力组和模拟失重组)进行比较。先将保存的单克隆甘油菌种接种到LB固体培养基上,37 ℃静置培养12 h后,挑取单克隆菌落接种在装有5 mL LB液体培养基的摇菌管中,37 ℃、200 r/min,过夜活化。将活化的菌液按体积比1∶500接种于装满新鲜LB液体培养基的培养瓶中(体积约73 mL),排空气泡。模拟失重组将接种好细菌的培养瓶放置在Gravite重力控制系统上旋转培养,2 r/min,37 ℃;正常重力组将接种好细菌的培养瓶放置在恒温振荡器中,水平振荡培养,2 r/min,37 ℃。每24 h按体积比1∶500接种于装满新鲜LB液体培养基的培养瓶中进行传代,连续培养14 d。
1.2.3 RNA提取及质检 运用Total RNA Extractor试剂盒,将裂解后样品或匀浆液室温放置5~10 min,使得核蛋白与核酸完全分离。加入0.2 mL氯仿,剧烈震荡15 s,室温放置3 min。12 000 r/min 4 ℃离心10 min。吸取上层水相转移至干净的离心管中,加入等体积异丙醇,混匀,室温放置20 min。12 000 r/min 4 ℃离心10 min,弃上清。加入1 mL乙醇(750 mL/L)洗涤沉淀。12 000 r/min 4 ℃离心3 min,弃上清。室温干燥5~10 min。加入30~50 μL RNase-free ddH2O,充分溶解RNA。将所得到的RNA溶液置于-70 ℃保存或立刻用于后续试验。用Qubit 2.0检测RNA浓度,琼脂糖凝胶检测RNA完整性以及基因组污染情况。质检结果显示样本质量均基本满足建库测序质量要求。
1.2.4 原核RNA转录组建库 该部分委托生工生物工程(上海)股份有限公司完成。具体步骤参照实验说明书。
1.2.5 基因表达差异分析 采用TMM对read count数据进行标准化处理,之后运用DEGseq进行差异分析,为了得到显著差异的基因,我们将筛选条件设为:P≤0.05且|log2(Fold Change)|≥1。
1.2.6 关键靶点的GO和KEGG富集分析 借助GO数据库和KEGG数据库,使用clusterProfiler进行功能富集分析,P<0.05表示该功能存在显著富集情况。
2 结果
为保证实验结果的可靠性,对正常重力和模拟失重两组间差异基因及相应通路进行分析,具体分析步骤参照文献[9-30]进行。
2.1 基因表达差异分析
研究发现,在模拟失重环境下培养大肠埃希菌14 d后,共检测到229个表达差异显著的基因,其中158个基因上调,71个基因下调(图1)。上调基因主要包括参与一些嘌呤嘧啶核苷酸的水解及转运等代谢相关基因(如rihA、xanQ、ghxQ)、DNA结合转录调节因子(如ycaN、allS、feaR、caiF、gadE、dctR、rhaR)、主要构成1型菌毛的相关基因(如fimG、fimH、fimA、fimB)和一些功能未知的蛋白(如yoaL、fxsA、ymcE、ybfB、ytiA、dsrB、yliM)等。下调基因主要包括参与一些氨基酸合成及水解等代谢相关基因(如asnA、ansB、tnaA、asnB)、RNA聚合酶sigma因子(fecI)和生物膜形成调节因子(bssR)等。
2.2 GO基因富集分析结果
经过GO功能注释分析(图2)发现,差异基因在基因的分子功能方面主要集中在分子转运、抗氧化、酶调节、转录因子活性等;在所处的细胞位置方面主要集中在细胞膜、细胞器、含蛋白质分子混合物等;在参与的生物过程方面主要集中在对刺激的反应、细胞杀伤、生化代谢等。
GO基因富集分析结果显示,差异基因富集到3个大类中的14个小类:包括生物过程类6条通路(天冬酰胺、2-氨基-3-氨基甲酰基丙酸的生物合成;氨基酸的N-三甲基衍生物的生物合成;精氨酸的生物合成;阳离子通过膜运输的过程;甘油跨膜转运过程;L-氨基酸转运过程)、分子功能类5条通路(外膜界周质间隙的合成代谢;烷基过氧化氢还原酶复合物的合成代谢;质膜的合成代谢;菌毛的合成代谢;钾离子转运ATP酶复合物)、细胞组分类3条通路(阳离子跨膜转运蛋白活性的代谢;羧酸跨膜转运蛋白活性的代谢;同转运体活性的代谢)。
2.3 KEGG基因富集分析结果
KEGG分析差异基因表达显示,229个差异基因中有69个基因(47个基因上调,22个基因下调)富集于68条通路,且大部分为代谢相关通路,主要以上调基因的富集通路为主,包括甘氨酸、丝氨酸和苏氨酸代谢等氨基酸代谢(图3),果糖和甘露糖等糖类代谢,甲烷、硫、核黄素等代谢,嘌呤、嘧啶代谢,卟啉与叶绿素、抗坏血酸和醛酸代谢,丙酸、丁酸代谢,以及一些化合物的生物合成与降解。
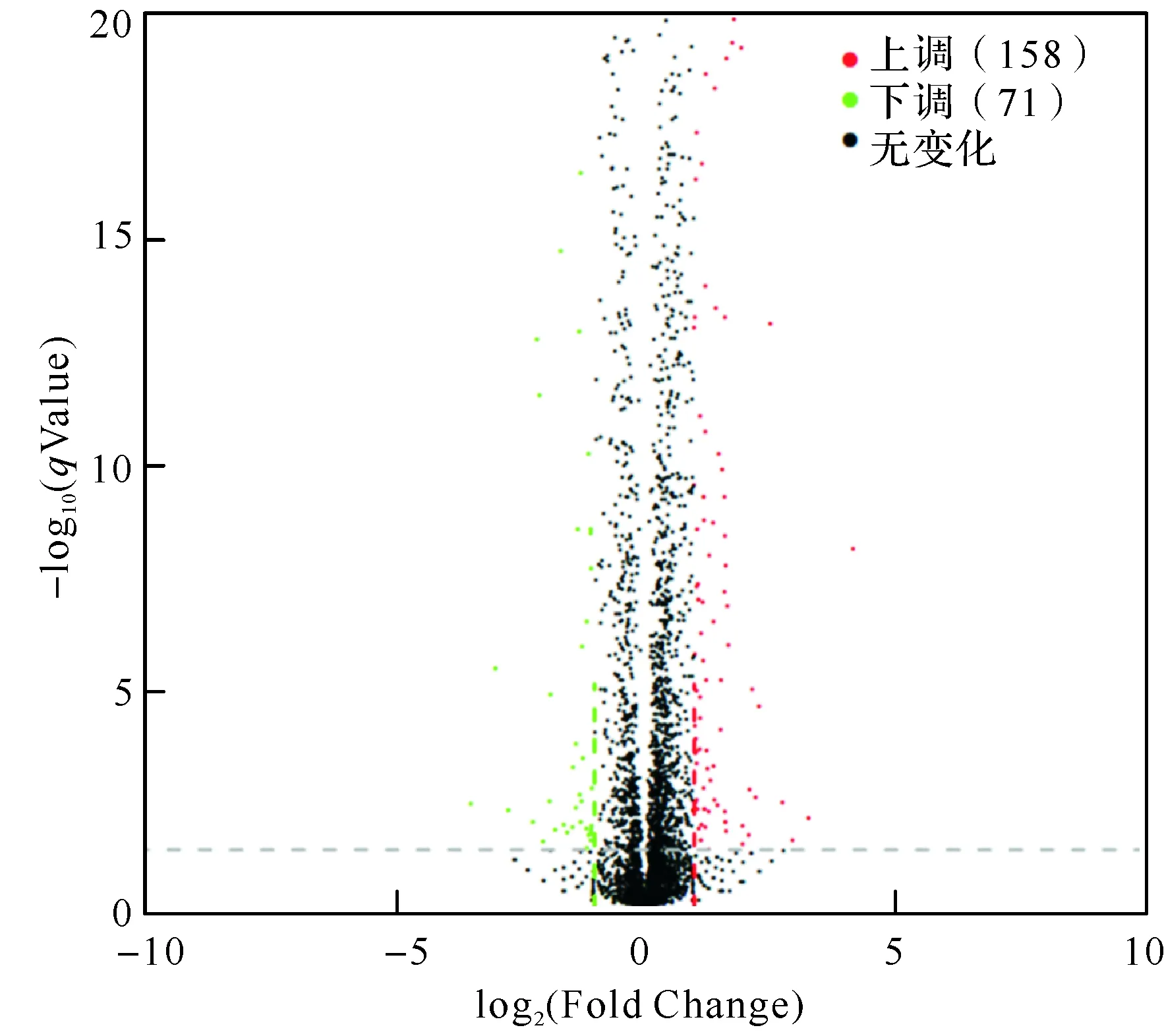
图1 两组间表达差异火山图
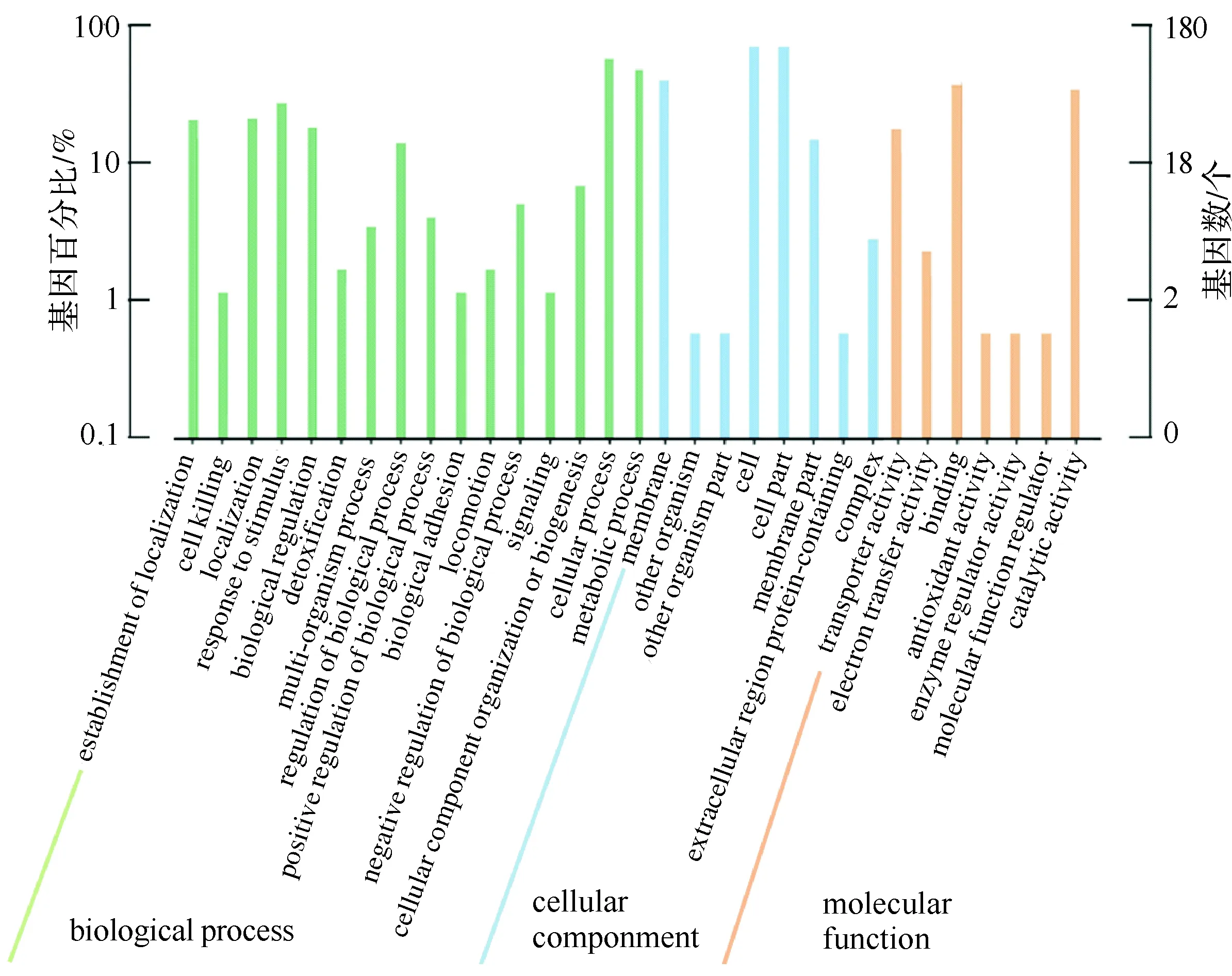
图2 差异基因GO注释分类柱状图
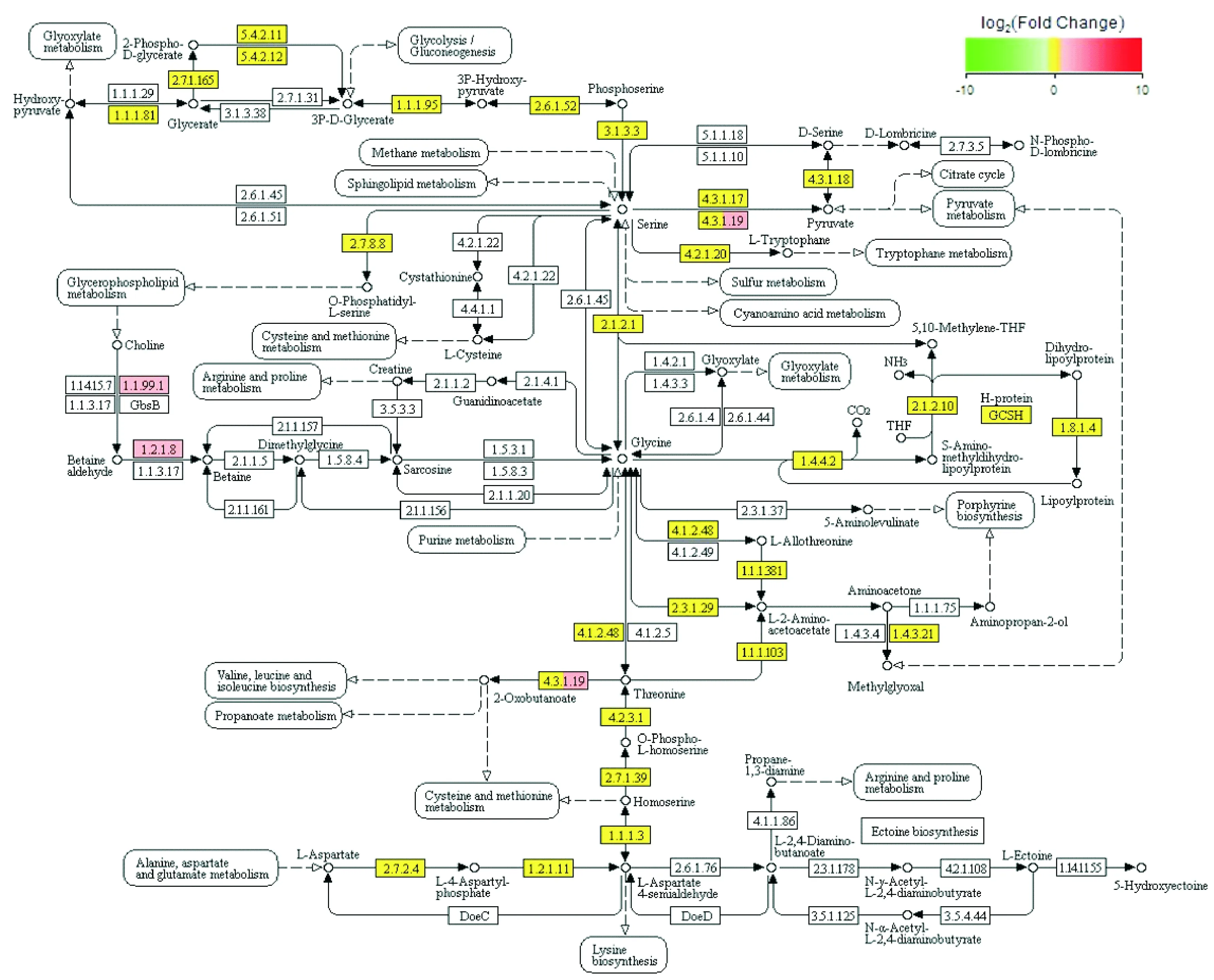
图3 甘氨酸、丝氨酸和苏氨酸代谢等氨基酸代谢通路图
3 讨论
本研究在模拟失重条件下对大肠埃希菌进行连续传代培养14 d后进行转录组测序,结果显示,模拟失重导致大肠埃希菌基因表达差异,共有229个表达差异显著基因(158个基因上调,71个基因下调)。KEGG富集通路结果显示,229个差异基因中共有69个基因(47个基因上调,22个基因下调)能匹配到已知的通路中,这些基因共富集于68条通路,其中52条通路为代谢相关通路,且主要以上调基因的富集通路为主。
过往研究表明,在模拟失重条件下用含有甘油的LB培养基培养后,大肠埃希菌K12共发现100个差异基因(53个基因上调,47个基因下调);KEGG分析结果显示,共有15个差异基因富集到16条不同通路[31]。同时有研究表明,大肠埃希菌K12在模拟失重条件连续传代培养两周后出现基因差异,共有142个基因差异表达,其中58个基因上调(包括一些耐药基因和核苷酸代谢基因),84个基因下调;KEGG分析结果显示共有43个差异基因富集在49条通路中[7]。
这些研究结果均表明,大肠埃希菌在受到模拟失重条件的影响后,会发生基因改变,同时在基因分析中发现上调的基因包括一些参与核苷酸代谢的基因,这与我们的研究结果一致。但所有差异基因及其所富集的通路仍有不同,考虑应为菌株及培养条件不同所致。
在之前的研究中对培养14 d后的大肠埃希菌进行生化代谢检测,发现模拟失重条件培养后的大肠埃希菌对丝氨酸、丙氨酸和天冬氨酸的利用增加,与该研究中KEGG分析结果所发现的差异基因富集在丙氨酸、天冬氨酸和谷氨酸代谢以及甘氨酸、丝氨酸和苏氨酸代谢通路中相符合。
本研究明确了大肠埃希菌在模拟失重条件下培养后出现的差异基因及其所富集的相关通路,下一步我们将在此基础上验证在模拟失重条件下大肠埃希菌在动物体内的毒力变化,同时筛选出与代谢、生物学性状、耐药和细菌毒力密切相关的差异基因,并根据其所富集的相关通路,研究其发生相关表型变化的具体机制,为空间站内的环境消杀提供基础,并为航天员的身体健康提供有力的保障。

