竹刨花-铁耦合体系对低碳氮比污水的脱氮性能
郑力,李志勇,黄剑,程晓夏
1.湖北省自动化研究所股份有限公司
2.武汉江城泽源生态工程技术有限公司
硝氮(NO3--N)是含氮有机物经无机化作用分解的最终产物,水中NO3--N浓度过高,会造成水体污染[1]。生物反硝化被广泛用于污水脱氮,其过程主要指异养反硝化菌利用有机物作为电子供体,在缺氧条件下将NO3--N还原为氮气[2]。生物反硝化需要有机物提供能量与电子供体,但是受污染的农业径流[3]、河水[4]和农村生活污水[5]等常常具有低碳氮比的特点,反硝化过程中普遍存在碳源不足的问题,导致脱氮效果差[6],因此通常需额外投加碳源来提高低碳氮比污水的脱氮效率[7-8]。外加碳源有液相碳源和固相碳源,液相碳源如甲醇等反硝化效率高,但存在二次污染、成本高等问题[9]。而固相碳源分解可产生可溶性和小分子的有机物供反硝化菌利用,同时还能作为微生物附着载体[9-10]。固相碳源主要有天然纤维素类物质、人工合成可降解聚合物等,基于安全性和经济性等方面的优势,天然纤维素日益成为研究热点[11]。Guan等[12]研究了5种农业秸秆材料,发现稻秆与玉米秆都适合作为碳源材料;Yu等[4]将玉米芯引入湿地系统,发现TN去除率从34.2%增至71.9%;Wang等[3]利用芦苇秆作为试验湿地系统碳源,水力停留时间为4 d时TN去除率达74.1%±6%;其他的还包括木屑、稻壳、松皮等[13],都被证实是可行的天然碳源材料。
竹子具有强度高、韧性好等特点,其主要成分为木质纤维素(由纤维素、半纤维素和木质素组成)[14],可作为反硝化碳源。Bucco等[15]成功将竹子培养的反硝化菌液用于地下水NO3--N治理中;Wang等[16]进行的批次与短期(16 d)的连续流试验结果显示,竹丝作为固体碳源可实现较好的反硝化脱氮效果;Liu等[2]将竹粉与可生物降解聚合物(BDPs)混合以降低成本,改善BDPs出水碳源过高问题。纤维状竹刨花是竹框、竹篮制品的废料,具备一定韧性,表面粗糙适合生物附着,纤维相互堆叠形成多层网状结构,不易堵塞,可作为生物填料。铁被广泛用于污水处理,其中Fe0可降低氧化还原电位,创造有利于厌氧菌生长的还原环境,增加生物酶活性与微生物多样性,已有研究者将Fe0与厌氧生物处理耦合起来以提高污染物的去除效果和系统稳定性[17-18]。目前将竹刨花作为固体碳源的研究较为鲜见,同时天然纤维素在应用中存在反硝化速度慢、脱氮不稳定等问题[19]。笔者引入单质铁粉,构成竹刨花-铁耦合体系强化脱氮,以竹刨花作为唯一固体碳源,通过静态试验研究竹刨花释碳、氮特征及适宜的铁粉投加量;设计动态试验,研究竹刨花-铁耦合体系在连续流状态下的长期脱氮性能,以期为污水经济、高效脱氮提供参考。
1 材料与方法
1.1 试验材料
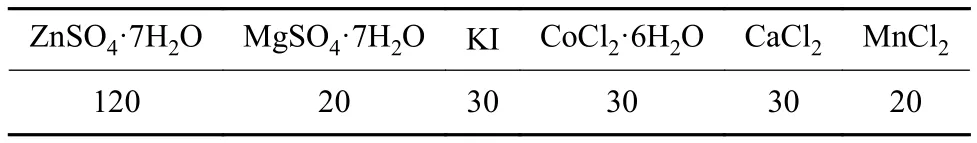
表1 微量元素溶液中物质组成Table 1 Trace element composition in trace element solution mg/L
1.2 试验方法
1.2.1 静态释碳、氮试验
称取10 g竹刨花于500 mL锥形瓶中,加入400 mL去离子水,置于30 ℃、60 r/min恒温振荡箱中,共释放20 d。每天于锥形瓶中取水样约30 mL后彻底换水。测定水样中的总有机碳(TOC)、总氮(TN)浓度,考察竹刨花释碳、氮情况。
1.2.2 静态反硝化试验
静态反硝化试验主要目的通过不同铁粉投加量探索合适的铁与碳质量比(Fe/C),为后续动态试验提供依据。竹中碳含量约占总质量的1/2[21-22],本试验以50%计。分别称取10 g竹刨花和0.1 g复合脱氮菌剂于250 mL锥形瓶中,设计Fe/C分别为0∶1、0.062 5∶1、0.125∶1、0.25∶1、0.5∶1、1∶1(分别加入0、0.313、0.625、1.25、2.5、5 g铁粉),之后加入 200 mL的废水(NO3--N浓度为50 mg/L)并用保鲜膜密封,置于恒温振荡箱中并于30 ℃、60 r/min培养。先浸泡培养7 d,中间换水3次,使竹刨花表面易溶性有机物充分释放,让微生物适应竹刨花-铁耦合体系,此外减少初期铁离子的溶出对测试的影响。之后将锥形瓶中溶液用吸管取出(底部保留约5 mL溶液),另换新鲜废水200 mL,连续培养168 h,在反应的第4、24、48、72、96、120、144、168小时取样 4 mL,测定水中NO3--N、亚硝氮(NO2--N)浓度。
1.2.3 动态反硝化试验
动态试验装置示意如图1所示。反应器主体由有机玻璃制成,柱内径为11 cm,柱高50 cm,从下至上分别为鹅卵石承托层、填料层(高约32 cm)、火山岩层。设置两组试验:1#试验组为只有竹刨花(160 g)填料层的对照组,2#试验组为竹刨花-铁耦合填料(160 g竹刨花+10 g铁粉)试验组,竹刨花分层铺设,铁粉分3次均匀铺洒于填料层1/8~1/2高度处。填料分层装好后先用硝酸盐废水浸泡7 d,之后用硝酸盐废水从底部连续进水。进水TN浓度为(40.13±2.29) mg/L,TP 浓度为(1.16±0.04) mg/L,TOC 浓度小 于 2 mg/L,COD 为 (11.78±3.17)mg/L,NO2--N、NH3-N和总铁浓度低于检测线,pH为7.70±0.36,DO 浓度为(5.48 ±0.39) mg/L。于室温(13~38 ℃)下运行,运行时间为2021年5——8月,进水流量为2 mL/min,水力停留时间约为18 h。定期测定进水和出水中COD与TOC、TN、NO2--N、NH3-N、总铁、TP、DO浓度以及pH。
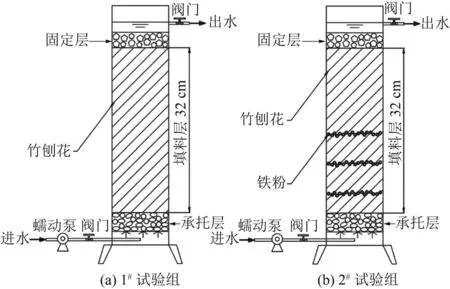
图1 动态试验装置示意Fig.1 Schematic diagram of the dynamic test units
1.3 分析方法
水样中NO3--N浓度采用HJ/T 346——2007《水质硝酸盐氮的测定 紫外分光光度法(试行)》测定,NO2--N浓度采用GB/T 7493——1987《水质 亚硝酸盐氮的测定 分光光度法》测定,NH3-N浓度采用HJ 535——2009《水质 氨氮的测定 纳氏试剂分光光度法》测定,总铁浓度采用HJ/T 345——2007《水质 铁的测定邻菲啰啉分光光度法(试行)》测定,TP浓度采用GB 11893——89《水质 总磷的测定 钼酸铵分光光度法》测定,TOC和TN浓度采用TOC总有机碳/总氮分析仪(Multi N/C®2100,德国)测定,COD 采用 HJ 828——2017《水质 化学需氧量的测定 重铬酸盐法》测定,pH用pH计(PHB-4)直接测定,DO浓度用溶氧仪(JPBJ-608)测定。
1.4 数据处理
静态反硝化试验中NO3--N的降解采用一级动力学拟合分析,静态反硝化试验废水使用自来水配置,由于自来水中NO3--N浓度低于检测线,因此忽略水中NO3--N背景浓度。拟合公式[23]如下:
针对应收款账期变长的问题,某建材公司董事长葛卫立说:“我们公司货款到年底基本也就能收回六七成,而且经常名义上账期是3个月,实际如果给我一张6个月期限的银行承兑汇票,账期就变成了9个月。”

式中:C0为NO3--N初始浓度,mg/L;C为反应t时间剩余的NO3--N浓度,mg/L;t为反应时间,h;k为反应速率常数,h-1。
2 结果与讨论
2.1 竹刨花释碳、氮特征
竹刨花释碳、氮特征如图2所示。由图2可知,试验第1、2天竹刨花的TOC释放量较高,为2.25和1.24 mg/(g·d),之后逐渐降低,10 d后释放量基本稳定,平均释放量为0.12 mg/(g·d)。试验初期竹刨花表层可溶性碳源快速释放,导致水中的TOC浓度升高[13];后期可溶性碳源释放完全后,有机物的释放主要为纤维素、半纤维素的降解[24],其属于结构稳定的大分子有机物,分解相对困难[25],同时去离子水体系中微生物数量较少,因此后期TOC释放量维持在较低水平,这与其他植物碳源释放规律[9,26]类似。氮是竹子的基本组成元素之一[21],竹中蛋白质类物质在水的浸泡和微生物作用下,产生的氨基酸、NH3-N等会进入水中,改变水中TN浓度。竹刨花TN释放量前3 d较高,但基本都低于0.1 mg/(g·d),17 d后释放量基本稳定,平均释放量为0.02 mg/(g·d)。植物纤维素一般都存在初期大量溶出情况,益处是可在初期诱导微生物大量繁殖,为后期系统稳定打下基础,弊端是会造成二次污染。本试验竹刨花有机物释放稳定后释放速率较慢,且氮释放量很少,其作为固体碳源有利于长期应用[27]。
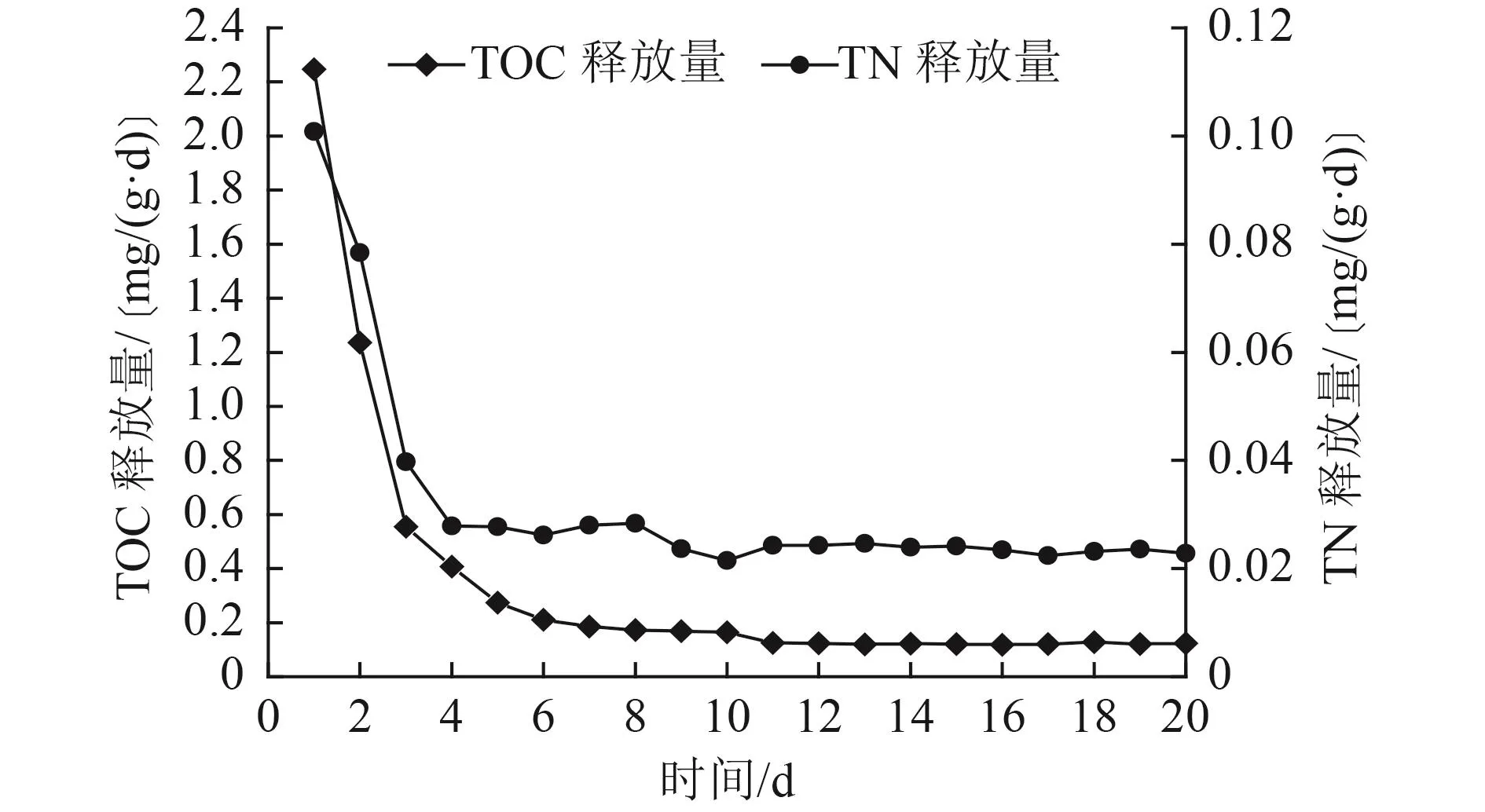
图2 竹刨花释碳、氮特征Fig.2 Carbon and nitrogen release characteristics of bamboo shavings
2.2 Fe/C 对竹刨花体系反硝化脱氮的影响
静态反硝化试验结果如图3所示。由图3(a)可知,不同Fe/C下,6个反应体系NO3--N浓度变化趋势基本一致,反应144 h后,NO3--N去除率分别为87.17% 、91.09% 、97.13% 、96.64% 、97.24%、96.25%。利用一级动力学模型对6个体系NO3--N浓度变化曲线进行拟合,均符合一级动力学(R2>0.98,P<0.000 1),k分别为 0.015 6、0.020 6、0.030 2、0.031 3、0.034 6、0.033 3 h-1。从k可知,耦合体系反应速率均高于单纯竹刨花体系,当Fe/C为0.125:1时,耦合体系的k比单纯竹刨花体系高近1倍,但随着Fe/C进一步增加,k提升不显著。已有研究指出,在微生物-Fe0系统中,单质铁剂量与污染物去除率之间并不遵循线型关系[28]。NO2--N是NO3--N还原反应的第一步产物[29],由图3(b)可知,6个体系在整个反应过程中的NO2--N积累量都较少,均小于1 mg/L,其中耦合体系NO2--N浓度低于单纯的竹刨花体系。综上,从反硝化效果和成本2方面考虑,后期动态试验耦合填料Fe/C定为0.125∶1。
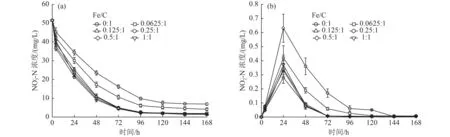
图3 Fe/C对竹刨花体系反硝化脱氮效果的影响Fig.3 Effect of Fe/C ratio on denitrification of bamboo shavings system
2.3 竹刨花-铁耦合体系动态反硝化脱氮效果
2.3.1 出水有机物浓度变化特征
1#和2#试验组有机物释放情况如图4所示。由图4可知,2组的进水TOC浓度小于2 mg/L,COD<15 mg/L,出水TOC浓度均在运行第1天达到最大,之后迅速降低,10 d后基本稳定。运行10~81 d,1#和 2#试验组出水 TOC 浓度分别为(5.70±1.77)、(7.63±3.98) mg/L,其中 2#试验组出水 TOC 浓度相比1#试验组高约34%,但整体浓度都较低。运行50~80 d,两组出水的 COD分别为 (28.58±5.51)和(31.81±5.56) mg/L,均低于 40 mg/L。运行期间,出水TOC浓度和COD均较进水高,这是由于竹纤维释放的部分有机物未被微生物利用,随水流出导致。另外,研究显示,TOC/COD约为0.3~0.5[11],而两组出水TOC浓度基本维持在较低水平,出水COD不高,说明将竹刨花作为固体碳源,有机物释放稳定,二次污染风险较小。本试验有机物释放趋势与邵留等[30]的研究结果类似,其原因如下:1)初期有机物溶出较多,但由于微生物数量有限,只有部分有机物被利用,因此出水TOC浓度较高;随着微生物不断生长,较多的有机物被利用,TOC浓度迅速下降。2)运行约10 d后,竹刨花表层可溶性物质迅速被消耗殆尽,微生物只能分解利用纤维素类物质,且分解与利用基本达到平衡,只有少量有机物随水流出。因此,两组出水有机物浓度在10~81 d稳定维持在较低水平。可能由于耦合体系中铁促进了微生物生长[17],使微生物对有机物的分解作用增强,导致2#试验组出水TOC浓度与COD均略高于1#试验组。
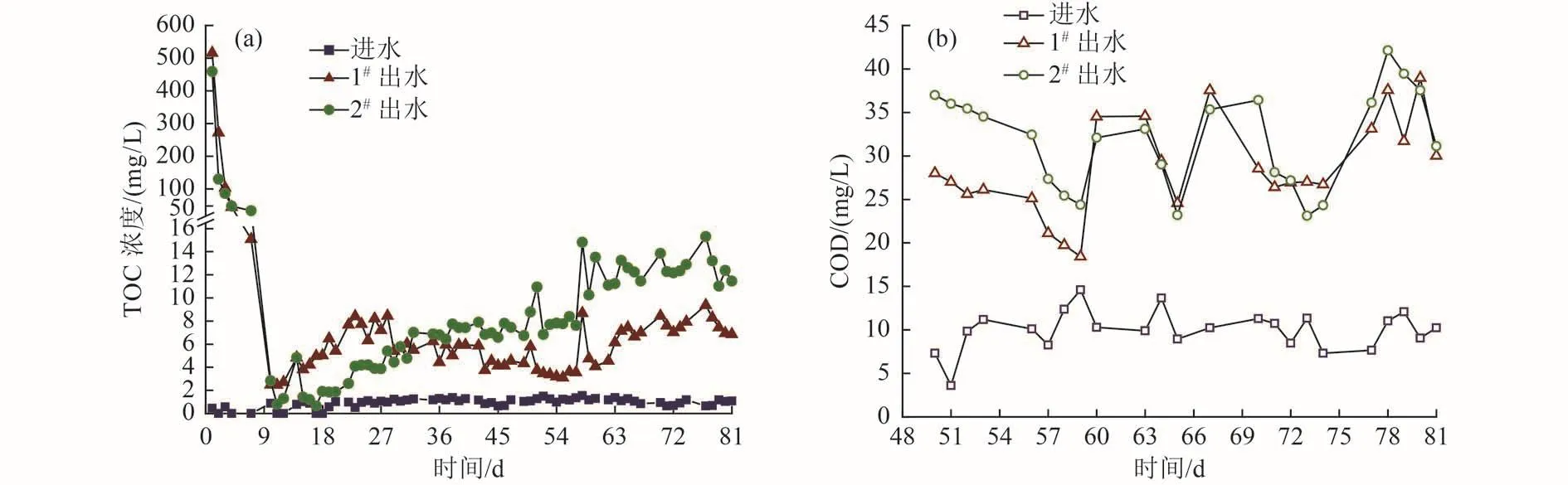
图4 1#、2#试验组进出水TOC浓度与COD变化Fig.4 Variation curves of TOC concentration and COD in the inlet and outlet water of 1# and 2#
2.3.2 TN去除效果
1#和2#试验组的TN浓度变化曲线和去除率如图5所示。由图5可知,运行前12 d两组的出水TN浓度波动较大:第1天两组出水TN浓度均高于进水TN浓度,之后迅速下降;第4天两组出水的TN浓度都降至最低,之后又快速上升,第10~11天达到峰值,之后逐渐稳定。试验初始竹刨花中可溶性有机物大量溶出,所以两组第1天出水TN浓度均高于进水,随着微生物逐渐适应分解纤维素类物质作为电子供体进行反硝化脱氮,运行10~11 d后两组的TN去除效果逐渐趋于稳定。在12~81 d,1#和2#试验组的TN去除率分别为32.99%±8.88%、75.58%±10.06%,耦合体系相比对照组TN去除率提高了129%,且其脱氮效果一直在缓慢上升,从40.45%逐渐增至85.71%。而1#试验组从28 d开始TN去除率有所下降,37 d后去除率只有30%左右。此外,1#和2#试验组出水pH分别为7.53±0.28和7.59±0.38,均呈中性;出水DO浓度分别为(0.56±0.08)和(0.51±0.13) mg/L,说明本试验装置内部环境基本符合生物反硝化要求[31]。孙雅丽等[32]用腐朽木去除水中NO3--N,进水NO3--N浓度为30 mg/L时,其去除率前期大于80%,但运行46 d后逐渐降低,运行至第70天时只有15%左右;李斌等[33]以玉米芯作为反硝化碳源,发现反应初期效果较好,但40 d后NO3--N去除率低至20%。而本试验中竹刨花与铁粉构成的耦合体系,竹刨花作为唯一碳源,当进水C/N<0.05,水力停留时间为18 h,TN浓度为40 mg/L时,TN去除率大于75%,且在运行60 d后持续高于80%而无下降趋势。
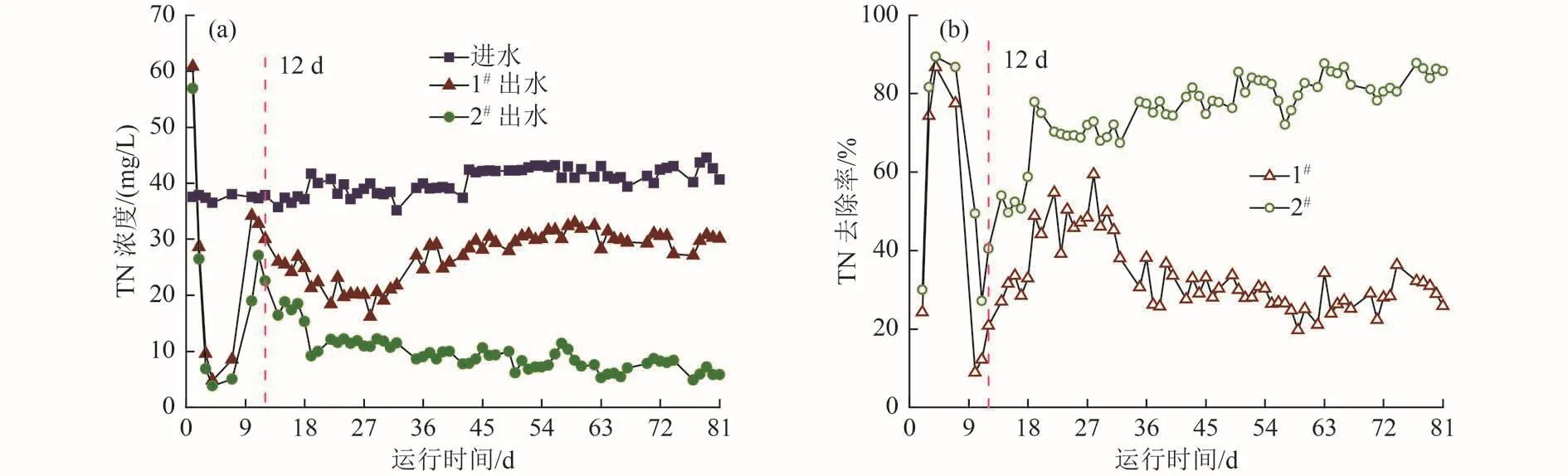
图5 1#、2#试验组运行过程中TN去除效果变化Fig.5 Changes in total nitrogen removal effect during the operation of 1# and 2#
此外,结合图4可知,两组运行0~7 d时,出水TOC浓度均大于15 mg/L,此时2个体系内部有机物非常充足,TN去除率也都达到最大,为86.79%~89.42%。运行稳定后 (10~81 d),两组出水TOC浓度平均值为5.70~7.63 mg/L,其中耦合体系较单纯竹刨花体系高约34%,但耦合体系TN去除率却提高了近1倍。这说明2个体系TN去除效果的差异除了与碳源释放量有关,可能还与碳源降解情况有关,当竹纤维被分解为类富勒维酸等易于降解的有机物时,更加有利于反硝化反应的发生[34]。竹中纤维素与半纤维素质量占比为60%~70%[14],其由葡萄糖或多糖等组成,可被微生物分解,但由于结构复杂,降解相对缓慢;且纤维状竹刨花相比竹条、竹块比表面积更大,其与粉碎的竹屑相比,更多地秉承了竹的韧性、强度特点,因此竹刨花预期可实现长期的碳源释放与脱氮效果。另外,竹刨花与铁的耦合作用大大改善了微生物对竹纤维的分解,使释放出更多易于降解的碳源供反硝化菌利用,大幅提高反硝化效率。同时随着微生物对水质环境的适应,微生物对竹纤维的分解和利用达到平衡,不会造成碳源的过量释放,从而既增强了耦合体系脱氮效果,又保证了脱氮效果的长期稳定性,竹刨花与铁构成的耦合体系对于低碳氮比污水的高效、稳定、绿色、经济脱氮具有重要意义。
2.3.3 NO2--N与NH3-N的积累特征
当有机底物不充分导致反硝化反应不彻底时会出现NO2--N积累[12],而Fe0的还原作用[18]可能导致NH3-N积累。由于进水NO2--N与NH3-N浓度低于检测限,故此处只讨论出水情况。两组装置运行中NO2--N与NH3-N积累曲线如图6所示。由图6(a)可知,两组装置在运行期间都存在一定的NO2--N积累,其浓度呈现先上升后降低再稳定的趋势,整体积累浓度分别为(8.52±5.40)、(4.54±3.47) mg/L,2#相比1#试验组NO2--N积累浓度低约47%;运行60 d后NO2--N浓度基本稳定,分别为(3.80±0.70)、(1.69±0.56) mg/L。结合图4可知,60 d后两组出水TOC浓度均高于前期,但2#中微生物分解出更多的有机底物使反硝化反应更为彻底,从而减少了NO2--N的积累。由图6(b)可知,1#和 2#试验组 NH3-N 积累变化趋势基本一致,初始出水NH3-N浓度较高,参考静态释氮结果,这可能是因为初始几天竹刨花自身释放的含氮有机物经微生物氨化作用导致;随着生物质释放稳定,NH3-N浓度逐渐降低并维持在较低水平,运行10~12 d后两组的NH3-N浓度均低于GB 18918——2002《城镇污水处理厂污染物排放标准》一级A排放限值(5 mg/L),22 d后均小于1 mg/L,说明铁粉的引入基本没有造成NH3-N的积累。
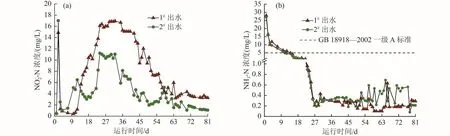
图6 1#、2#试验组运行过程中积累的NO2- -N与NH3-N浓度变化Fig.6 Varaition of concentration of nitrate-nitrogen and ammonia nitrogen accumulated during the operation of 1# and 2#
2.3.4 铁溶出特征
1#试验组的填料层只有竹刨花,且进出水总铁浓度一直低于检测限,故只讨论2#试验组的铁溶出情况。2#试验组出水铁浓度变化如图7所示。由图7可知,1~10 d,出水总铁浓度先迅速增加,第2天达到最大(56.7 mg/L),之后快速减小,10 d后总铁浓度动态维持在较低水平,基本没有出现铁大量逸出的现象。本试验铁溶出规律与张雅君等[35]研究硝酸盐溶液腐蚀铁的情况类似,即初期铁释放较多,之后逐渐减少并基本稳定。由于Fe0性质活泼,初期在水中发生氧化腐蚀[36]与生物腐蚀[37],使大量铁离子溶出。溶出的铁离子迅速扩散到装置各处,促进了微生物生长与聚集,强化了生物膜的形成[38-39]。一方面生物膜的阻隔作用减少了铁腐蚀[40];另一方面,硝酸盐还原菌与铁还原菌的新陈代谢引发Fe2+与Fe3+的循环增加铁氧化物沉淀,会抑制铁腐蚀,但当水中硝酸盐浓度大于10 mg/L时,不稳定的腐蚀产物容易脱落促进腐蚀[35]。总之,基于各种生物化学反应,使得铁粉的腐蚀与抑制腐蚀作用逐渐平衡,因此2#试验组出水中总铁浓度在运行前10 d先迅速增加后降低,之后动态维持在较低的浓度范围内。运行前10 d铁离子的大量释放为系统的成熟奠定了优良的基础,运行10 d后少量而稳定的铁离子释放则可能不断诱导相关功能菌的生长,增强其活性,促进关键酶的合成,导致耦合系统具有更高的脱氮效果与系统稳定性[41]。此外,当进水TP浓度为(1.16±0.04) mg/L时,1#和2#试验组出水TP浓度分别为(0.81±0.20)和(0.49±0.19) mg/L,铁的引入强化了系统对磷的去除。根据铁溶出情况与加入的铁粉量,预计铁与竹的耦合脱氮效应会长期存在。
3 结论
(1)静态释碳、氮试验结果显示,竹刨花有机物释放速率较慢,氮释放量很少,表明竹刨花是一种适合长期应用、二次污染风险低的固体碳源。
(2)竹刨花体系不同Fe/C的静态反硝化试验结果表明,各体系NO3--N去除过程均符合一级动力学,耦合体系的k均高于单纯竹刨花体系,但当Fe/C大于0.125∶1时,k提升不显著。综合经济因素,耦合填料Fe/C定为0.125∶1。
(3)动态试验结果显示,竹刨花-铁耦合体系稳定运行70 d其TN平均去除率大于75%,相比单纯竹刨花对照组提高了近1倍;此外,TN稳定去除期间,基本无有机物二次污染风险,引入单质铁粉的耦合体系并未出现NH3-N明显积累与铁的大量溶出,且NO2--N积累浓度比单纯竹刨花对照组低近50%。

