基于齿状回神经元树突棘形态探讨ROCK2敲减改善APP/PS1小鼠认知功能的作用机制*
刘晓琴, 郭敏芳, 谷青芳, 李艳花 , 李红霞, 魏文悦,张海飞 , 尉杰忠 ,2,3△, 马存根 ,2△
(1山西大同大学脑科学研究所/附属第一医院神经科,山西 大同 037009;2山西中医药大学国家中医药管理局多发性硬化益气活血重点研究室/神经生物学研究中心,山西 晋中 030619;3山西省大同市第四人民医院,山西 大同 037009)
阿尔茨海默病(Alzheimer disease, AD)是一种发病隐匿、进行性发展的神经退行性疾病,它的特征性病理改变为细胞外的β-淀粉样蛋白(amyloid β-protein, Aβ)沉积和细胞内高度磷酸化τ蛋白(phosphorylated Tau protein, p-Tau)的聚集,同时伴有突触和线粒体功能异常、大脑区域性的葡萄糖代谢降低,最终导致神经元萎缩、变性及丢失[1]。在AD的发病过程中,神经元突触数目的减少是导致早期认知功能障碍的主要因素。神经元树突棘作为神经元突触的一个重要结构,其形态的改变必然导致突触结构和功能的改变。临床数据显示,神经元树突棘丢失是AD患者大脑内最先可以观察到的结构改变之一,且早于神经元的丢失和纤维斑块的沉积[2]。在AD模型鼠中,纤维斑块的附近或远端也可观察到树突棘数量的减少,且这些树突的形态异常,树突内p-Tau含量增加[3]。与正常小鼠的神经元树突棘相比,AD模型鼠海马CA3区神经元树突棘的头部更宽大,颈部更短而粗[4]。进一步的研究显示,多聚化的Aβ的很多靶点都与神经递质的传递及突触的功能相关,这些Aβ多聚体可以在细胞膜上形成离子可通过的孔道,从而增加Ca2+的流入,对神经元造成毒性[5]。虽然Aβ产生的突触毒性在AD的发展早期发挥作用,也可能是导致其它神经毒性特征的关键驱动因素,但是其中的具体作用机制仍未得到阐明[6]。
Rho相关激酶(Rho-associated kinase, ROCK)是一类以GTP酶RhoA调控为主的多功能丝氨酸/苏氨酸激酶,通过细胞表面受体接受各种信号激活后,在细胞骨架、细胞迁移和细胞生长等方面起主要调控作用。研究显示ROCKs在AD、帕金森病(Parkinson disease, PD)和多发性硬化(multiple sclerosis, MS)等多种神经退行性疾病中会过量表达,使用Rho激酶抑制剂盐酸法舒地尔(fasudil)或Y-27632,能够有效改善这些疾病的症状,并延缓病程的进展[7-9]。但是,Rho激酶信号通路复杂,fasudil或Y27632对很多激酶存在广泛的抑制作用,如AGC激酶家族中的蛋白激酶A(protein kinase A, PKA)和蛋白激酶C(protein kinase C, PKC)等,从而限制了这些激酶抑制剂在临床治疗中的应用[10]。ROCK有两个异构体:ROCK1和ROCK2,两者氨基酸序列的相似性为65%,N端的激酶结构域的一致性为92%[11],但在组织分布和功能上并不完全相同。ROCK2在大脑的表达量更高,ROCK1主要表达在血细胞和胸腺中[12];在人神经母细胞瘤SH-SY5Y或人胚胎肾细胞HEK293中,敲减ROCK2均能够降低Aβ水平,敲减ROCK1蛋白反而增加Aβ的表达[11]。这些结果提示,在大脑的生命活动及AD等神经退行性疾病的发生发展中,ROCK2发挥着关键的调控作用。
ROCK2通过调节肌动蛋白骨架系统在细胞黏附和运动、平滑肌收缩及神经元突触可塑性等方面发挥着重要作用。研究显示,与野生型(wild-type,WT)小鼠相比,ROCK2敲除小鼠的海马神经元树突棘密度没有变化,但是树突棘的长度增加。而杂合ROCK2缺陷(ROCK2+/-)小鼠海马CA1区神经元的树突棘数目较WT小鼠降低,长度增加,头部变小,无论是ROCK2敲除小鼠还是ROCK2缺陷杂合小鼠,它们的兴奋性突触数量均相应减少[13-14]。但是,在AD的动物模型或细胞模型中,ROCK2的表达显著增加,兴奋性突触数量却显著降低,从而导致AD模型鼠的认知功能下调[15]。那么,在AD模型鼠中敲减ROCK2,神经元突触的树突棘形态怎么改变?兴奋性突触数量有什么变化?AD的典型病理特征是否改善?目前还未见相关报道。基于以上问题,本研究以APP/PS1转基因小鼠为模型,通过行为学实验、免疫荧光技术和Western blot等实验探究ROCK2在小鼠海马齿状回区(dentate gyrus, DG)树突棘形态的调控作用,为今后AD的治疗及药物研发提供参考。
材料和方法
1 动物
雄性8月龄的SPF级C57BL/6小鼠8只和雄性8月龄的SPF级APP/PS1小鼠32只,体重均为(20±2)g,购自北京华阜康生物科技股份有限公司,动物许可证号为SCXK(京)2018-004。动物饲养于山西大同大学脑科学研究所动物室,明暗交替周期为12 h,环境温度为23~27 ℃,湿度为40%~60%,常规饲料喂养。本实验获得山西大同大学动物实验伦理委员会批准。
2 主要试剂
抗ROCK2抗体购自Abcam;抗Aβ抗体购自Millipore;抗Tau抗体来源于ABclonal公司;抗p-Tau(Ser404)抗体、抗GAPDH抗体和抗突触后致密蛋白95(postsynaptic density protein 95, PSD95)抗体、辣根过氧化物酶连接的羊抗兔Ⅱ抗、羊抗鼠Ⅱ抗及Alexa Flour 488购自Cell Signaling Technology;突触结合蛋白1(synaptotagmin 1, Syt1)抗体和囊泡谷氨酸转运体 1(vesicular glutamate transporter 1, VGLUT1)抗体购自 Synaptic Systems;含 4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)的封闭液购买于北京索莱宝科技有限公司;试剂RIPA裂解液购买于上海碧云天科技生物有限公司;腺相关病毒(adeno-associated virus, AAV)和ROCK2敲减病毒由武汉枢密脑科学技术有限公司提供。
3 主要方法
3.1 动物分组 8只C57BL/6小鼠为WT组;32只APP/PS1小鼠随机分为3组,第1组为8只,给予生理盐水治疗,记为NS组;第2组为12只,在小鼠海马区注射腺相关对照病毒(AAV-U6-BBSI-shRNA-CMV-mCherry-pA,AAV9),其中6只小鼠同时注射神经元示踪病毒(AAV-hSyn-EGFP-WPRE-pA),另外6只小鼠不注射,均记为shRNA组;第3组为12只,在小鼠海马区注射ROCK2敲减病毒[AAV-U6-shRNA(ROCK2)-CMV-mCherry, AAV9],其中6只小鼠同时注射神经元示踪病毒(AAV-hSyn-EGFP-WPRE-pA),另外6只小鼠不注射,均记为shROCK2组。
3.2 脑立体定位注射 参考小鼠病毒注射相关文献,对小鼠进行脑立体定位注射病毒[16-17]。采用腹腔注射0.3%的戊巴比妥钠溶液(50 mg/kg),对每只APP/PS1小鼠进行麻醉,待麻醉完全,剪去头顶部毛发,通过调节前夹及小鼠耳杆的位置,轻柔地将小鼠固定到脑立体定位仪上,使其眶上脑部在同一个水平面。用碘伏清洁眶上脑部两次,手术延眶上方约1.5 cm处做矢状位切口,暴露前囟。将微量注射器固定到定位注射槽内,吸入病毒。根据小鼠脑图谱确定注射坐标,以前囟为0点,注射位点为:X=±1.25 mm,Y=-2.18 mm,Z=1.62 mm,注射速度为0.2 μL/min,结束后停留2 min以促进病毒吸收,后缓慢抬起注射器,缝合头皮,碘伏消毒。最后,将小鼠放置于保温环境中适应。实验过程中也要时刻注意给小鼠保温,以提高注射后小鼠的存活率。
3.3 水迷宫和Y迷宫实验 从脑立体定位注射后的第21天开始,对4组小鼠的行为学进行测试。水迷宫和Y迷宫的检测参考之前的实验[7,18],简单介绍如下:水迷宫测试的前5天为训练期,每天上午和下午均进行1次训练,每只小鼠均从同一入水点入水,每次训练用时不超过60 s,若小鼠60 s内无法自行找到平台,则人为引导其到达平台并停留60 s。第6天,撤去平台,对小鼠的空间认知及记忆能力进行正式测试。Y迷宫训练阶段,新异臂入口被阻挡,小鼠从起始臂开始,在起始臂和其他臂中进行10 min的活动。1 h后开始正式测试,此时开放新异臂入口,小鼠依然从起始臂开始,在3个臂中进行5 min的活动,测试小鼠的空间记忆及学习能力。水迷宫和Y迷宫中,小鼠测试的全过程利用SMART 3.0系统进行记录及分析。
3.4 样本采集 脑立体定位注射后的第27天,处死小鼠。每只小鼠使用0.3%的戊巴比妥钠溶液,按照50 mg/kg的量进行腹腔注射麻醉,每组4只小鼠(shRNA和shROCK2组中,有和无神经元示踪的小鼠各取2只)用生理盐水对心脏进行灌注,当肝脏变白时,冰上快速取脑组织,并分离出海马区域,迅速加入400 μL预冷的RIPA裂解液,进行超声:功率30 W,总超声时间20 s,冰上放置10 min后,15 000×g、4 ℃离心5 min,收集上清。分装后冻-80 ℃,用于后续的Western blot检测。每组中剩余的小鼠在生理盐水灌注心脏后,换用4%多聚甲醛进行心脏灌注来固定组织,冰上快速取出脑组织,放入4%多聚甲醛中继续固定24 h,之后进行蔗糖梯度脱水和optimal cutting temperature compound (OCT)包埋。在液氮中制备组织块,使用冰冻切片机对组织进行冠状切割。对于神经元示踪的小鼠,切片厚度为50 μm,用于后续的神经元树突棘形态观察;对于无神经元示踪的小鼠,切片厚度均为10 μm,用于后续的免疫组化分析。
3.5 神经元树突棘形态观察及分析 参考相关文献对神经元的树突棘形态进行分析[19-20]。选取shRNA和shROCK2组的有神经元示踪的50 μm厚度海马区域切片,用含DAPI的封片液进行封片,使用激光共聚焦显微镜FV1000(Olympus)的100倍油镜进行拍照:在1 024×1 024的模式下,扫描速度为12.5幅/s,放大倍数为1.2倍,z轴扫描厚度为每片1.2 μm。图像使用Imairs软件进行3D重构,神经元上的树突及树突棘利用软件中的Filament工具进行手动绘制,在检测树突棘的模块中,树突棘最小的头部直径设置为1 μm,最大长度设置为10 μm,树突棘直径最大不超过5 μm。选择并导出要统计的参数,包括神经元树突棘的密度、长度、直径及树突棘颈的长度和直径。每组样品中最少选择3只小鼠的脑片进行拍照统计。
3.6 免疫荧光染色 选取4组样品中10 μm厚度海马区域切片,用PBS溶液清洗3次,每次5 min,使用含有1%牛血清白蛋白(bovine serum albumin, BSA)和0.3% Triton X-100的PBS室温封闭样品1 h,然后加入对应Ⅰ抗,4 ℃下湿盒中过夜孵育。第2天,去除Ⅰ抗,PBS溶液清洗样品3次,每次5 min,加入对应的488荧光标记的Ⅱ抗,室温孵育2 h。去除Ⅱ抗,用PBS清洗3次,每次5 min,用含有DAPI的封片液进行封片,使用激光共聚焦显微镜进行拍照。使用Image-Pro Plus软件对数据进行分析。
3.7 Western blot实验 具体操作步骤按标准程序进行,简单描述如下:从-80 ℃中取出上述提取的小鼠海马组织的蛋白溶液,充分溶解后,加入蛋白质上样缓冲液,加热变性蛋白,15 000×g离心5 min后取上清液,进行后续的SDS-PAGE、转膜、抗体孵育及曝光拍照。拍照及蛋白定量分析均使用Image Lab软件。
4 统计学处理
数据以平均数±标准误(mean±SEM)表示,使用软件GraphPad Prism进行分析统计,两组间的比较使用t检验,P<0.05时,两组间差异具有统计学意义。
结 果
1 APP/PS1小鼠海马神经元的ROCK2被有效敲减
利用激光共聚焦的10倍物镜对一侧海马进行拍摄,如图1A所示,病毒对海马神经元的侵染效率可以达到80%以上。Western blot的结果进一步证实:与shRNA相比,转染shROCK2能够显著下调小鼠海马组织中的 ROCK2蛋白水平(P<0.05),见图1B。
2 ROCK2敲减改善APP/PS1小鼠的认知功能
利用水迷宫和Y迷宫实验,本实验首先观察了ROCK2敲减对APP/PS1小鼠的认知功能的影响。图2A为训练期间不同组小鼠的运动轨迹代表图,从图中可以看出:WT小鼠游泳路径短,目的性强,能够在短时间内到达平台所在象限;NS组和shRNA组的APP/PS1小鼠游泳路径随机,目的性弱,活动范围大;shROCK2组的APP/PS1小鼠活动范围较NS组和shRNA组缩小,有一定的目的性,更倾向于在平台所在的SW象限附近活动。图2B~2D的结果显示:与WT相比,NS组和shRNA组的小鼠逃避潜伏期、到达平台的平均距离,和首次进入SW (southwest)象限的时间显著增加(P<0.05或P<0.01),而shROCK2组小鼠对应的指标较shRNA组均显著降低(P<0.05或P<0.05)。从Y迷宫的运动轨迹图可以看出:NS组和shRNA组的APP/PS1小鼠在新异臂穿梭的次数较WT小鼠显著减少,而shROCK2组小鼠与WT小鼠在新异臂穿梭的次数相当(图3A)。数据分析显示:WT组小鼠在新异臂的时间占总时间的比例平均为34.4%,自发交替率平均为44.18%;NC组和shRNA组的APP/PS1小鼠的对应数值均显著下调:NS组分别为22.78%和28.86%(P<0.05或P<0.01),shRNA组分别为20.59%和31.01%(P<0.05),而shROCK2小鼠能够有效抑制其下调,分别为32.91%和41.98%(P<0.05或P<0.01),见图3B、C。
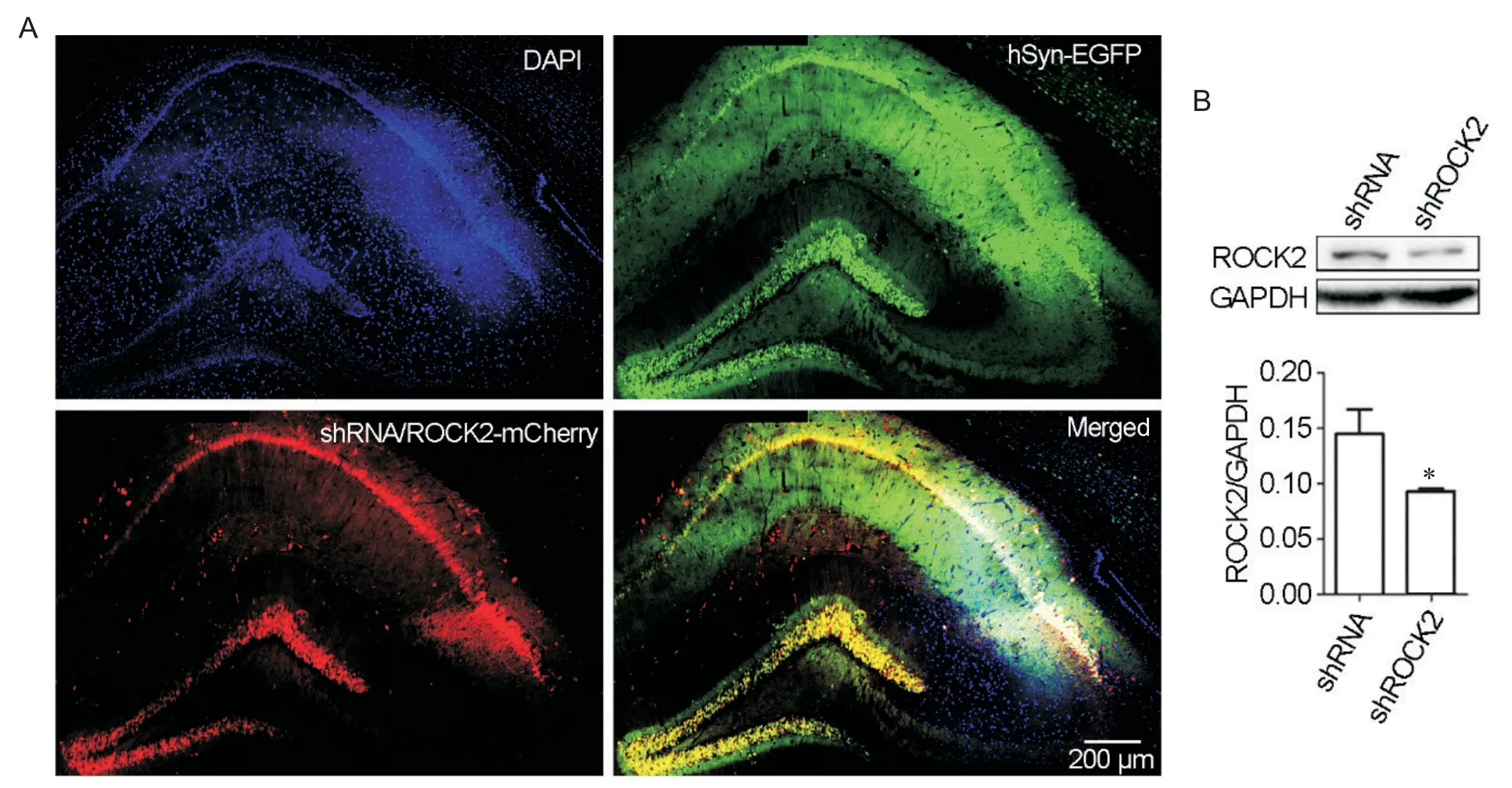
Figure 1. AAV-shRNA-mediated knockdown of ROCK2 in the hippocampus of 8-month-old APP/PS1 mice. A: representative images of the hippocampus after stereotaxic injection of AAV-shRNA/shROCK2 andAAV-hSyn-EGFP in APP/PS1 mice. Neurons co-expressing AAV-shRNA/shROCK2-mCherry(red) and AAV-hSyn-EGFP (green) and DAPI-stained nucleus(blue) in the hippocampus of APP/PS1 mice. B: the expression of ROCK2 in the hippocampus of APP/PS1 mice with injection of AAV-shRNA and AAV-shROCK2, and quantitative analysis of ROCK2 level normalized to GAPDH level by Image Lab software. Mean±SEM. n=3. *P<0.05 vs shRNA group.图1 AAV-shRNA调节的ROCK2在APP/PS1小鼠大脑海马区的敲减
3 ROCK2敲减降低了APP/PS1小鼠脑内Aβ和p-Tau水平
为了进一步评估ROCK2敲减对APP/PS1小鼠认知功能的影响,本实验对AD的典型病理改变Aβ和p-Tau(Ser404)表达水平进行了检测。对Aβ进行的免疫荧光检测结果显示:NS组和shRNA组的APP/PS1小鼠大脑皮质区的Aβ含量较WT小鼠显著增加(P<0.05或P<0.01),shROCK2组中的 Aβ 含量较shRNA组显著减少(P<0.05),见图4。
图5A、B的免疫荧光数据显示:NS组和shRNA组小鼠海马DG区的p-Tau(Ser404)水平显著升高(P<0.01),敲减ROCK2可以显著下调p-Tau(Ser404)在APP/PS1小鼠DG区的表达(P<0.01)。同时通过Western blot检测小鼠海马区Tau蛋白及p-Tau(Ser404)的表达,结果显示:与WT小鼠相比,APP/PS1小鼠及敲减ROCK2的APP/PS1小鼠海马区Tau蛋白总的表达水平无显著差异,但NS组和shRNA组小鼠的p-Tau(Ser404)较WT小鼠显著增加(P<0.05或P<0.01),且p-Tau在总Tau蛋白的占比也显著增加(P<0.05),而在shROCK2组中,p-Tau的增加被显著抑制(P<0.01),p-Tau与Tau的比例显著下调(P<0.05),见图5C~F。
4 ROCK2敲减改变了APP/PS1小鼠海马齿状回区神经元的树突棘形态
使用激光共聚焦对神经元的树突棘进行观察,用Imaris软件对其数量和形态进行分析。图6A为Imaris软件对所拍摄的神经元重构后的代表图,图6B为要分析的树突棘的代表图。结果显示:与shRNA相比,敲减ROCK2后,树突棘的密度有增加的趋势,但统计学上没有显著性差异。树突棘的平均长度显著增加(P<0.01),直径平均长度无显著差异,颈部平均长度显著增加(P<0.01),且颈部平均直径显著减小(P<0.05)。
5 ROCK2敲减增加了APP/PS1小鼠海马区的兴奋性突触数目
为了进一步验证ROCK2敲减对树突棘形态的改变是否会影响兴奋性突触的数目,通过Western blot对不同组小鼠海马区的突触相关蛋白含量进行了检测。与WT组小鼠相比,NS组和shRNA组小鼠海马区中的Syt1、VGLUT1和PSD95的含量显著下调(P<0.05或P<0.01),shROCK2敲减可显著抑制Syt1、VGLUT1和PSD95的下调(P<0.05或P<0.01),见图7。
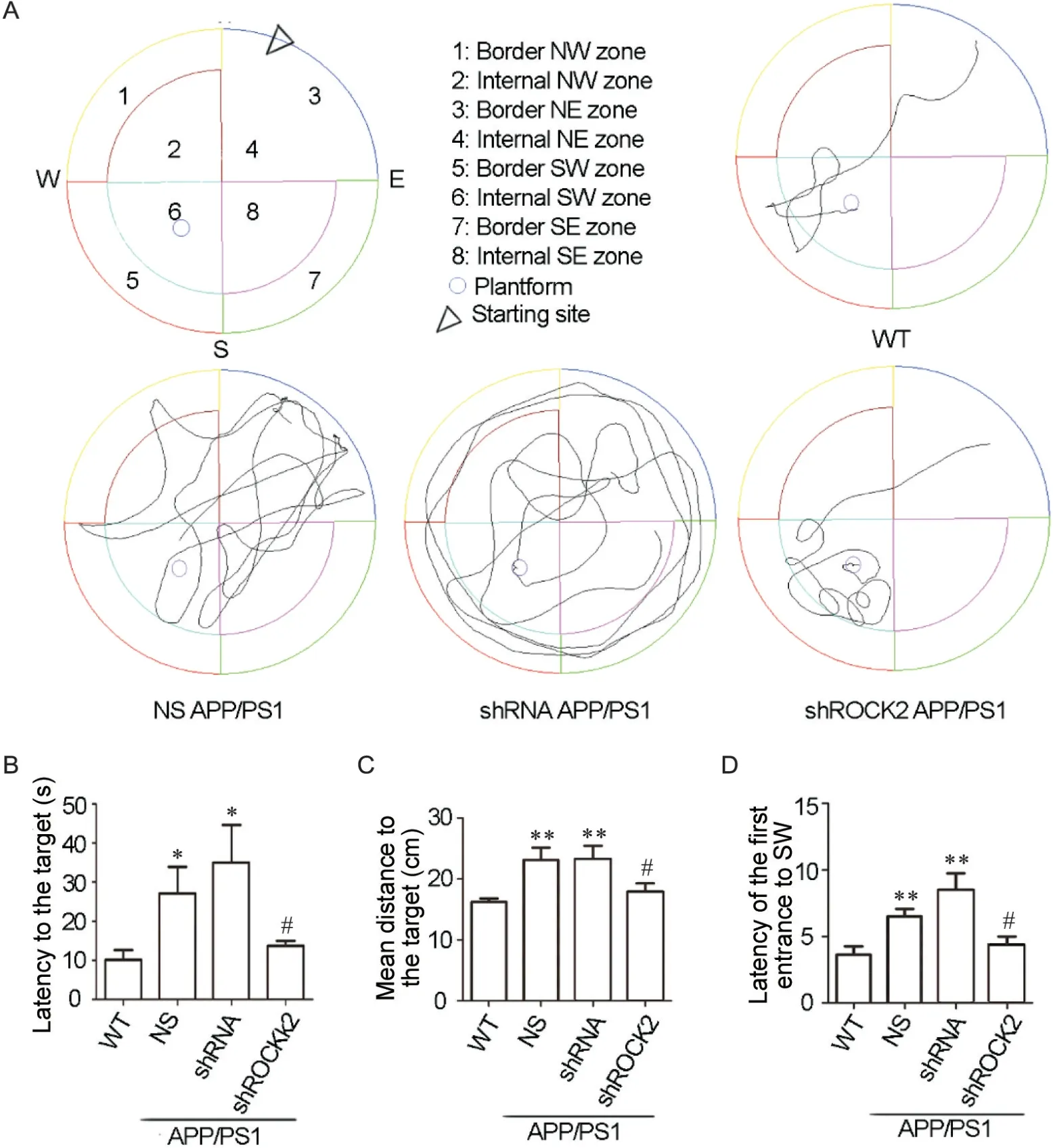
Figure 2. Morris water maze test was performed to detect the spatial memory and learning of the indicated mice. A: representative swimming paths from all mice in 4 groups during the training days and the corresponding parameters; B: latency to the target; C: mean distance to the target; D: latency of the first entrance to SW during the probe trial. Mean±SEM. n=6. *P<0.05, **P<0.01 vs WT group; #P<0.05 vs shRNA group.图2 水迷宫检测所示小鼠的空间记忆及学习能力
讨 论
AD是一种复杂的神经退行性疾病,在其发病过程中,伴随着神经元的丢失及神经再生的功能障碍。大脑海马区在学习、记忆和空间定位方面发挥着重要的作用,海马的DG区是成年动物神经再生的一个主要区域。之前的研究显示Rho激酶的抑制剂能够显著改善AD动物模型的认知功能,促进神经再生[7,21]。但是,Rho激酶抑制剂对很多激酶具有广谱性,是否是主要通过ROCK2来发挥神经保护效果,目前的实验证据较少。本研究通过在APP/PS1小鼠海马区特异性敲减ROCK2,观察APP/PS1小鼠的行为学及DG区神经元的树突棘形态改变,探索内在机制,从而明确ROCK2敲减在APP/PS1小鼠发病过程中对神经元突触可塑性的调控作用。
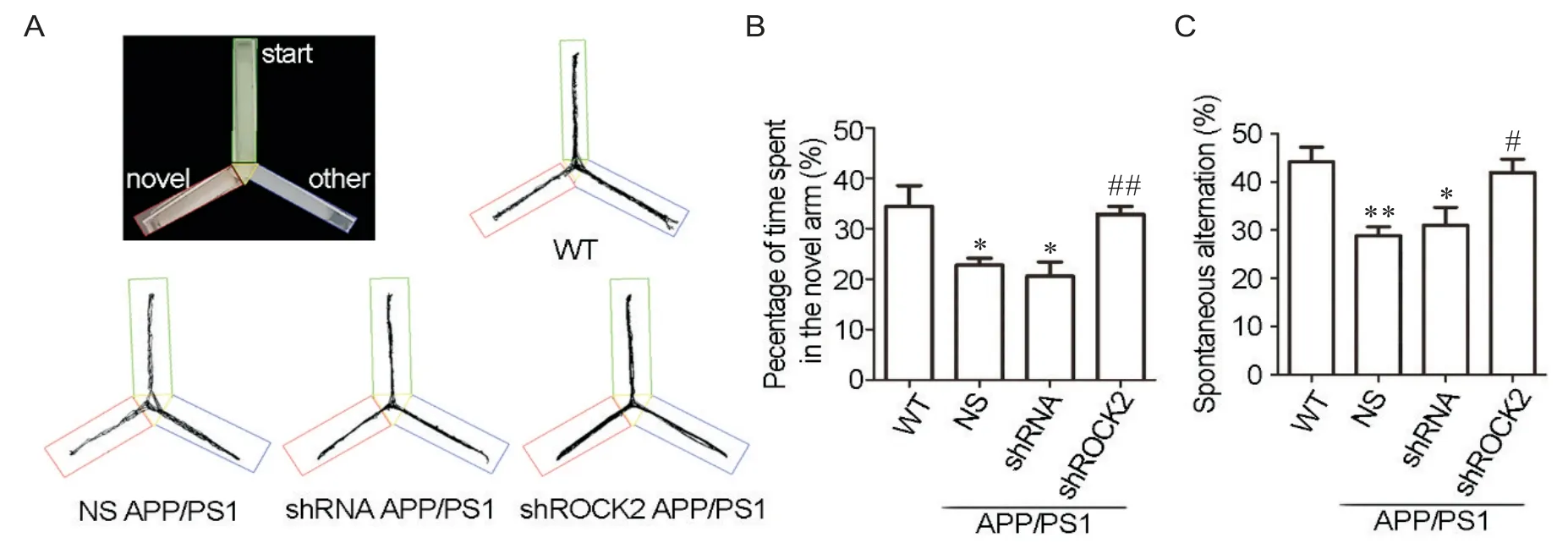
Figure 3. The Y-maze test was performed to detect the spatial learning and memory of the indicated mice. A: illustration of the Y-maze and the typical diagrams of all 4 groups; B: the percentage of time in the novel arm over all the arms; C: the alternation rate in indicated groups in the Y-maze. Mean±SEM. n=6. *P<0.05, **P<0.01 vs WT group; #P<0.05, ##P<0.01 vs shRNA group.图3 Y迷宫检测所示小鼠的空间探索和记忆能力
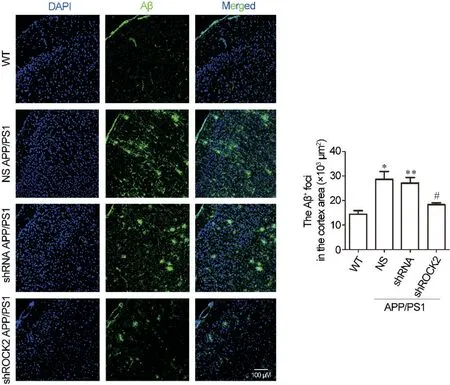
Figure 4. Knockdown of ROCK2 reduced Aβ aggregation in the cortex of 8-month-old APP/PS1 mice. The expression of Aβ (green)in the cortex of mice was detected by immunohistochemistry. Nuclei were stained with DAPI(blue). Scale bar=100 μm.Quantitative analysis of the area (polygon) of Aβ deposits was shown. Mean±SEM. n=3. *P<0.05, **P<0.01 vs WT group; #P<0.05 vs shRNA group.图4 ROCK2敲减减少了8月龄APP/PS1小鼠大脑皮质区Aβ的聚集
ROCK2在多种神经变性疾病中被过度激活,参与免疫炎症、线粒体自噬、神经元凋亡及突触结构及功能等多个方面的调控,被认为是异病同治的重要靶点之一[9]。但是,目前对ROCK2在神经变性疾病中的具体作用机制知之甚少,限制了人们对其进行相关的药物设计及后期的临床应用。本研究的结果显示:利用AAV在APP/PS1小鼠海马区敲减ROCK2后,可以显著改善APP/PS1的空间探索、记忆及学习能力,这与之前报道的使用慢病毒敲低APP/PS1小鼠海马区ROCK2的结果一致[22]。Aβ和p-Tau是AD的主要病理特征,过度的Aβ表达会改变激酶的活性,引起Tau高度磷酸化,最终导致神经缠结的产生[23]。之前的研究显示,利用小分子药物SR3677抑制ROCK2激酶后,能够降低AD鼠脑内Aβ的产生,其可能的机制为:抑制了β位点APP裂解酶1(β-site-APP cleaving enzyme 1, BACE1)的酶活性,从而降低了Aβ的产生;改变了BACE1的胞内转运状态,促进APP在溶酶体内的降解;ROCK2蛋白对APP蛋白654位苏氨酸(threonine, T)的磷酸化在APP的降解过程中发挥着关键的调控作用,下调ROCK2蛋白改变了T654的磷酸化状态,降低了Aβ的产生[11]。本研究则通过AAV直接对ROCK2进行敲减,进一步证实了ROCK2蛋白的下调有利于减少APP/PS1小鼠大脑皮质区的Aβ沉积及DG区的p-Tau表达,从而有利于APP/PS1小鼠的认知功能的改善。
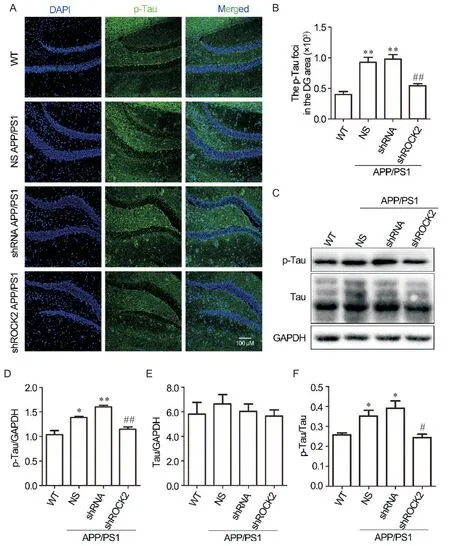
Figure 5. Knockdown of ROCK2 decreased the expression levels of p-Tau in the DG of 8-month-old APP/PS1 mice. A: expression of p-Tau (green) in the DG of hippocampus was detected by immunohistochemistry. Nuclei were stained with DAPI (blue).Scale bar=100 μm. B: quantitative analysis of the area (polygon) of p-Tau deposits by Image-Pro Plus software. C: the p-Tau and Tau levels in the hippocampus of mice were detected by Western blot. D to F: the quantification of p-Tau (D) and Tau(E) levels normalized to GAPDH level and p-Tau level normalized to Tau level (F) by Image Lab software. Mean±SEM. n=3. *P<0.05. **P<0.01 vs WT group; #P<0.05, ##P<0.01 vs shRNA group.图5 ROCK2敲减减少了8月龄APP/PS1小鼠大脑海马区p-Tau的表达
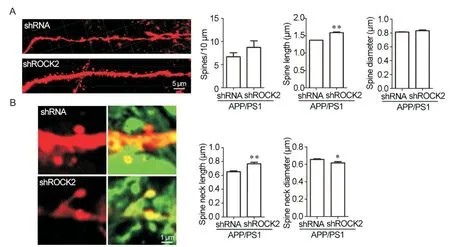
Figure 6. Knockdown of ROCK2 altered the morphology of dendritic spines in DG neurons of 8-month-old APP/PS1 mice. A: representative dendrites of DG neurons of the mice in shRNA and shROCK2 groups(scale bar=5 μm), and quantitative data showing spine density, spine length and spine diameter in the DG of 8-month-old APP/PS1 mice; B: representative dendritic spine of the mice in shRNA and shROCK2 groups [the analyzed spines (yellow) are located on the neurons infected by AAV-shRNA/shROCK2-mCherry(red) and AAV-hSyn-EGFP(green); scale bar=1 μm], and quantitative data showing an increase in spine neck length and a decrease in spine neck diameter in shROCK2 mice compared with shRNA mice.Mean±SEM. n=3. *P<0.05. **P<0.01 vs shRNA group.图6 ROCK2敲减改变了8月龄APP/PS1小鼠DG区神经元树突棘的形态
神经元树突棘是大脑中大多数兴奋性突触的突触后部分,在突触的信号传递和可塑性方面发挥着关键的作用,其形态和数目在不同的生理和病理条件下会发生动态的变化,而且神经元树突棘和突触的结构和功能可塑性对大脑的学习和记忆能力非常重要[24]。树突棘颈部的直径和长度是树突棘区室化形成的关键因素:长而细的树突棘颈部比短而粗的树突棘颈部阻力更大,会限制一些突触信号的扩散,如钙离子。作为树突棘信号传递过程中的一个重要条件因子,钙离子在树突棘中的滞留会导致其浓度增加,从而更有利于下游信号的传导,使突触的可塑性更强[24-25]。而且,神经元树突棘的头部越大,它对信号传递的能力越强[26]。目前,对于ROCK2敲减对神经元树突棘形态的改变,研究结果并不完全一致。研究显示,与野生型相比,ROCK2+/-的杂合子小鼠的海马CA1区神经元树突棘密度显著降低,长度增加,头部变窄[14];ROCK2-/-的纯合子小鼠海马神经元树突棘密度不变,长度增加[13];大鼠海马神经元中敲减ROCK2后,神经元树突棘的头部变宽[27]。这些结果的差异可能是由于不同的动物背景,不同基因突变以及不同的实验方法导致的[14],因此亟待更多的实验证据对其进行论证。在AD发病过程中,ROCK2被异常激活[9],那么在AD模型鼠的背景下,敲减ROCK2对神经元树突棘形态的影响是怎样的呢?本研究利用共表达mCherry及神经元示踪的方法,在APP/PS1小鼠海马区下调ROCK2激酶,检测到敲减ROCK2使APP/PS1小鼠DG区神经元树突棘的密度虽然有增加的趋势,但并无统计学差异。神经元树突棘的总长度及颈的长度显著增加,颈的直径显著减小;同时,由于总的神经元树突棘的直径变化无差异性,推测树突棘的头部直径有增大的趋势。这些结果提示ROCK2敲减更有利于APP/PS1小鼠大脑DG区突触信号的传递,促进突触强度的增加。目前认为ROCK2激酶对神经元树突棘形态的调控与其下游的cofilin的磷酸化有关,ROCK2对cofilin的第3位丝氨酸进行磷酸化,可以调节肌动蛋白的重构,有利于神经元树突棘的成熟,但是抑制ROCK2同样能够促进树突棘的形成及其头部变宽[27]。Cofilin的磷酸化在AD鼠模型和AD病人的脑组织中含量均显著增加。在原代培养的神经元中,Aβ多聚体也能够诱导cofilin发生磷酸化,利用Fasudil抑制ROCK2能够降低cofilin的磷酸化,同时减轻Aβ多聚体引起的突触毒性,如抑制了兴奋性突触的减少[28]。本研究进一步对兴奋性突触相关蛋白进行了检测。PSD是调节树突棘形态的关键组成部分,其中,PSD95就是兴奋性突触中主要的PSD支架蛋白之一,也是突触后的主要标志物[25,29];Syt1在突触前神经末梢神经递质释放过程中发挥关键作用[30]。谷氨酸盐是中枢神经系统中主要的兴奋性神经递质,谷氨酸系统的稳态是由突触囊泡膜上的转运蛋白维持的,其中,VGLUT1是转运蛋白中含量最高的一个蛋白[31]。本研究的数据显示:NS和shRNA组中APP/PS1小鼠海马区中的Syt1、PSD95和VGLUT1表达量较WT显著下调;但是,在APP/PS1小鼠海马区下调ROCK2表达后,Syt1、PSD95和VGLUT1表达量显著增加,说明ROCK2敲减能够增加APP/PS1小鼠海马区兴奋性突触的数量,促进突触信号的传递。综上结果表明,ROCK2敲减改变了APP/PS1小鼠DG区树突棘形态,进而增加了兴奋性突触的数量,减轻了Aβ和p-Tau对小鼠的毒性作用,从而有利于改善APP/PS1小鼠认知功能。
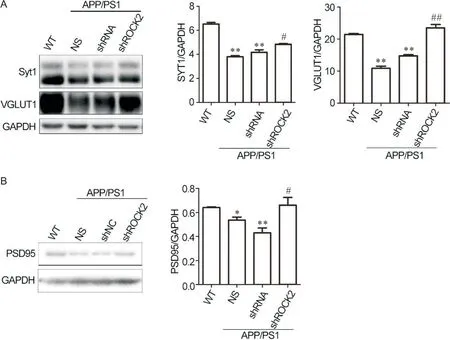
Figure 7. Knockdown of ROCK2 increased the number of excitatory synapses in the hippocampus of 8-month-old APP/PS1 mice. A:the levels of SYT1 and VGLUT1 in the hippocampus from mice of the 4 groups were detected by Western blot; B: the level of PSD95 in the hippocampus from mice of the 4 groups was detected by Western blot. The quantitative analysis of SYT1,VGLUT1 and PSD95 levels normalized to GAPDH level was performed by Image Lab software. Mean±SEM. n=3. *P<0.05, **P<0.01 vs WT group; #P<0.05, ##P<0.01 vs shRNA group.图7 ROCK2敲减增加了8月龄APP/PS1小鼠海马区兴奋性突触的数量
本研究通过AAV特异性的对AD模型鼠APP/PS1小鼠海马区的ROCK2进行敲减,探索了ROCK2敲减对APP/PS1小鼠的治疗作用及其相关的分子机制。ROCK2敲减能够显著提高APP/PS1小鼠的学习、记忆及空间探索能力,降低大脑内累计的Aβ斑块及p-Tau表达水平,并能够改变DG区神经元树突棘的形态,显著增加海马区兴奋性突触的数量。本研究明确了ROCK2敲减对APP/PS1模型鼠认知功能、基本病理改变及DG区树突棘形态的调控作用,肯定了ROCK2在AD病理过程中对树突棘形态调控的重要性,为深入揭示其中的分子机制提供了研究基础。

