慢性不可预见性应激致大鼠髁突软骨组织学变化的自然转归
刘杨, 刘晓波, 李强, 赵雅娟, 陈永进
1.军事口腔医学国家重点实验室 国家口腔疾病临床医学研究中心 陕西省口腔疾病国际联合研究中心 第四军医大学口腔医院急诊与综合临床科,陕西 西安(710032); 2. 广州市中西医结合医院口腔科,广东 广州(510800)
颞下颌关节紊乱病(temporomandibular disorders,TMD)是口颌系统最常见的疾病之一,典型症状包括口腔颌面部、颞下颌关节区持续的疼痛和下颌功能障碍,严重影响患者的正常生活[1-2]。临床研究显示,与健康人群相比,慢性TMD 患者的心理失调情况如焦虑和抑郁情绪的发病率更高[3-4];同时患有TMD 和心理疾病的患者,在联合给予心理干预和药物治疗时,颞下颌关节疼痛和下颌运动受限的症状有所改善[5]。由此可见,心理应激是影响TMD 发生、发展以及预后的重要因素。
长期的慢性应激可导致实验动物明显的焦虑抑郁样行为,并且颞下颌关节髁突软骨超微结构出现显著的损伤与破坏[6]。在去除应激因素后,经过一段时长的恢复,髁突软骨受损的表面超微结构能够得到较好的自我修复[7]。炎性因子白细胞介素-1(interleukin-1,IL-1)的局部高表达很可能在慢性应激导致的髁突软骨损伤中发挥重要作用,造成其出现骨关节炎样病变[6,8-9]。IL-1 的高表达可进一步激活基质金属蛋白酶(matrix metalloproteinases,MMPs),导致细胞外基质的渐进性降解,并对髁突软骨组织产生破坏[10-11]。
慢性不可预见性应激是一种用于诱导啮齿类动物焦虑及抑郁样行为的经典动物模型。因其给予的刺激因素多样且不可预知,动物较难产生条件性适应,从而产生焦虑抑郁样行为。因此,本研究拟通过对动物施加慢性不可预见性应激后,观察颞下颌关节超微结构与组织学的变化,进一步明确慢性不可预见性应激导致髁突软骨损伤的自然恢复状况;并观察软骨中炎性因子与MMPs 表达水平的变化趋势。旨在更深入地探究慢性不可预见性应激导致的髁突软骨损伤的自然转归特征以及自我修复的内在机制。
1 材料和方法
1.1 主要试剂及设备
雄性SD 大鼠(空军军医大学实验动物中心,SCXK(陕)2019-001,中国);自制束缚器;Bw-dfs201型强迫游泳实验系统(上海软隆科技发展有限公司,中国);大鼠皮质酮(corticosterone,CORT)、大鼠促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、ELISA 试剂盒(江苏科特生物科技有限公司,中国);1∶200 兔抗IL-1α、1∶200 兔抗MMP-3(Abcam Bio 公司,USA),全波段酶标仪(Infinite M200 Pro NanoQuant,TECAN 公司,瑞士);场发射扫描电镜(JSM-6000型,JEOL公司,日本);低温离心机(GTR16-2 型,北京时代北利离心机有限公司,中国);光学显微镜(DM1000,Leica 公司,德国);氧化物酶/二氨基联苯胺(Diaminobenzidine,DAB)(sigma公司,美国);Pierce BCA 蛋白检测试剂盒(Rockford,IL,美国)。
1.2 实验动物及饲养环境
60 只雄性SD 大鼠(SPF 级,8 周),饲养条件:温度(24 ± 1)°C,湿度40% ~60%,12 h 光/暗循环,背景噪声<60 dB。所有动物实验经第四军医大学口腔医院实验动物管理伦理委员会批准(批准号:2020 伦审字081 号)。
1.3 实验分组
大鼠随机分为5 组:空白对照组(Control)、应激组(Stress)、应激去除2 周组(2 week post stress,2w ps)、应激去除4 周组(4w ps)、应激去除8 周组(8w ps),每组12 只。
1.4 大鼠慢性不可预见性应激模型建立
对照组大鼠正常状态下饲养,不受应激刺激。其他4 组的大鼠接受慢性不可预见性应激(chronic unpredictable moderate stress,CUMS)[12-13]。
CUMS 主要包括7 种刺激因素:24 h 潮湿垫料、12 h倾斜饲养(饲养笼倾斜30 度角)、4 h 噪音(白噪音80 分贝)、昼夜颠倒、5 min 强迫浸水(水面高度8 cm,大鼠的头部可位于水面上)、10 min 夹尾(距尾端3 cm)、1 h 的束缚应激(大鼠置于弹性钢丝网制成的束缚器中,在束缚过程中,大鼠的四肢不受限制,但不能自由移动)。每天只施加1 种应激方法,1 周为1 个循环。给予各组大鼠8 周的CUMS,其中应激去除8 周组、应激去除4 周组、应激去除2 周组在第8、12、14 周去除刺激因素恢复正常饲养,60只大鼠在16周结束后开始统一进行检测与取材。各组详细应激过程和取材时间如图1 所示。
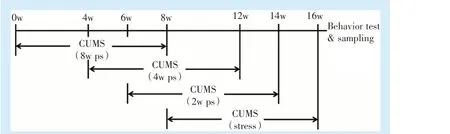
Figure 1 Representative schematic diagrams of detailed procedure of CUMS and sampling time of each group图1 动物慢性不可预见性应激实验流程图
1.5 行为学测试
各组大鼠在实验结束之后的第一天进行行为学测试。①糖水偏好实验(sucrose preference test,SPT)[14]:大鼠自由饮用1%的糖水溶液或纯水以适应1 周。在实验测试之前,大鼠禁食禁水10 h,然后将其单独饲养,并在24 h 内自由饮用1%的糖水溶液或纯水。记录大鼠消耗糖水和饮用水量,并计算出糖水所占比率。②强迫游泳实验(forced swim test,FST)[14]:将大鼠放入一个含有自来水的玻璃圆筒(直径30 cm,深40 cm)中6 min,强迫其游泳,观察大鼠的“行为绝望状态”。前2 min 为适应阶段,后4 min 用摄像机记录大鼠活动状况,并记录其“不动”时间。
1.6 血清学检测
各组大鼠在实验结束之后的第二天取血及取材。大鼠腹腔注射1%戊巴比妥钠50 mg/kg 麻醉,心脏采血1.5 mL,冰浴静置30 min。在4 ℃,3 000 rpm下离心30 min 后分离血清。ELISA 方法检测血清促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)和皮质酮(corticosterone,CORT)水平。
1.7 超微结构和组织学观察
各组大鼠在实验结束之后的第三天进行超微结构和组织学观察。各组取6 只大鼠腹腔注射1%戊巴比妥钠50 mg/kg 进行麻醉,用颈椎脱位法处死,取出双侧髁突。一侧髁突软骨用于超微结构观察:用0.01 mol/L 磷酸盐缓冲液(PBS,pH 7.3)冲洗髁突,然后置于4 ℃的3%戊二醛中固定48 h,在1%的锇酸中固定1 h,乙醇梯度脱水和喷金,在扫描电镜下进行观察;另一侧用于苏木精和伊红(hematoxylin-eosin,HE)染色:将髁突软骨置于4%聚甲醛中浸泡48 h,在15%EDTA 中脱钙6 周,石蜡包埋,取矢状面切片(厚5 μm)进行HE 染色,光镜下进行组织学观察。
1.8 免疫组织化学检测
各组取6 只大鼠按照HE 染色方法收集单侧髁突软骨组织并进行包埋切片,0.01 mol/L PBS 冲洗,0.3% H2O2处理10 min,羊血清37 ℃孵育5 min。加入兔抗IL-1α 和MMP-3,4 ℃过夜;PBS 漂洗后,加入辣根过氧化物酶标记的山羊抗兔二抗孵育1 h,使用DAB 显色5 min,苏木精复染1 min。封片后用光学显微镜观察并拍照,观察髁突软骨后1/3 和中1/3 处的正方形区域并拍照。
1.9 Western blot 检测
取出另一侧髁突软骨,12 000 rpm 离心10 min后匀浆,取上清液,在100 ℃下加热5 min 并冷却。然后用BCA 蛋白检测试剂盒进行蛋白定量。将样品加入10%SDS-PAGE 凝胶上电泳,转膜(100 mA,40 min)。将转膜结束的PVDF 膜置于封闭液中1 h,加入一抗:兔抗IL-1α 和MMP-3,4 ℃孵育过夜,以及鼠抗β-actin(1∶5 000)。次日取出PVDF 膜漂洗后,加入二抗室温孵育2 h。清洗后进行ECL 发光,并采用Image Lab 软件分析蛋白印迹的光密度。
1.10 统计学分析
用SPSS 19.0 软件分析,数据用均数±标准差表示,组间比较用单因素方差分析,并采用Bonferroni检验进行两两比较,P<0.05为差异有统计学意义。
2 结 果
2.1 血清学检测
应激组大鼠血清中CORT 和ACTH 水平与对照组相比明显升高(P<0.000 1);在应激去除2 周组中,CORT 和ACTH 水平有下降趋势,但仍高于对照组(P= 0.030 7,P= 0.000 3);应激去除4 周和8 周后,血清CORT 和ACTH 水平恢复正常,与应激组相比差异有统计学意义(P<0.000 1)(图2)。
2.2 行为学变化
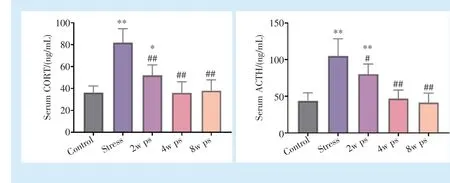
Figure 2 Serological detection before and after removal of chronic unpredictability stress in rats图2 大鼠慢性不可预见性应激去除前后血清学检测
与对照组相比,应激组大鼠糖水偏好率降低(P=0.000 1),强迫游泳的静止时间增加(P<0.000 1);应激去除2 周和4 周,大鼠糖水偏好率有升高的趋势,但仍低于对照组(P=0.002 5,P=0.047 5),强迫游泳的静止时间呈减少趋势,但仍高于对照组(P=0.006 7,P=0.041 0);应激去除8 周后,糖水偏好率和强迫游泳静止时间接近对照组,与应激组相比差异有统计学意义(P= 0.006 3,P<0.000 1)(图3)。
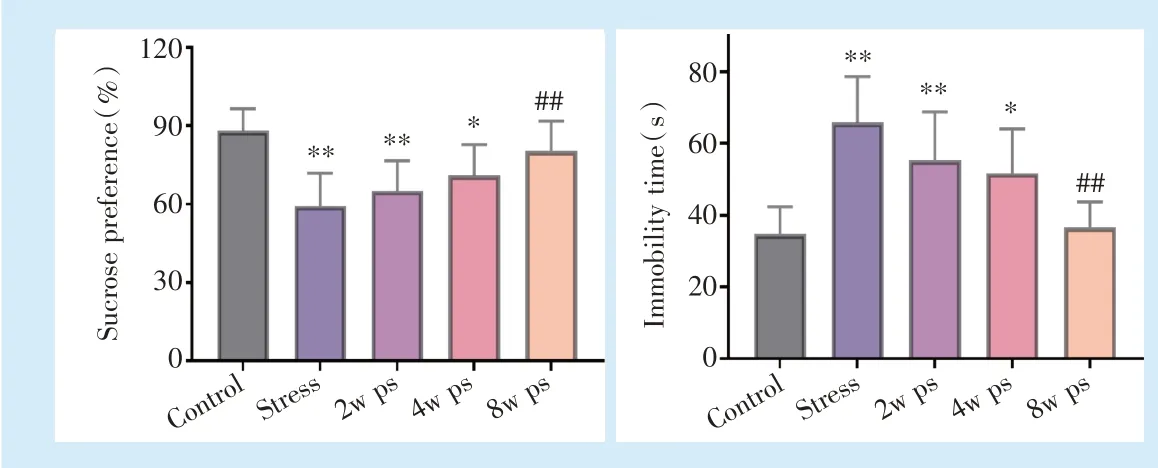
Figure 3 Behavioral detection before and after removal of chronic unpredictability stress in rats图3 大鼠慢性不可预见性应激去除前后行为学检测
2.3 超微结构和组织学观察
髁突软骨表面的扫描电镜结果如图4 所示。在对照组中,髁突表面的纤维排列整齐,并覆盖了一层波浪状的凝胶状物质(图4a);应激组髁突表面凝胶样物质消失,下层的胶原纤维暴露,呈排列紊乱状态(图4b);应激去除2 周后,仍可看到松解的胶原纤维(图4c);应激去除4 周后,仅观察到少量的胶原纤维,髁突表面明显变平(图4d);应激去除8 周后,髁突表面凝胶样物质增加,再次呈现波纹状(图4e)。
大鼠髁突软骨横切面的HE 染色见图5。对照组观察到有4 层,包括纤维层、增殖层、成熟软骨细胞层和肥厚层(图5a);应激组纤维层表面可见纤维碎片和游离细胞,增殖层结构紊乱(图5b);应激去除2 周后,关节腔内仍可见纤维碎片,而增殖层内可见一些无细胞区(图5c);应激去除4 周和8 周后,纤维层表面光滑、增厚,增殖层仍见无细胞区(图5d、5e)。
2.4 IL-1α 和MMP-3 的表达
各组髁突软骨中IL-1α 表达的免疫组织化学染色和Western blot 结果见图6。在软骨细胞、细胞质和细胞外基质中IL-1α 均有表达(图6a ~6e 虚线标出部分),应激组髁突软骨中IL-1α 表达升高(P<0.000 1);在应激去除2 周后,IL-1α 的表达呈下降趋势,但仍高于对照组(P= 0.000 2);在应激去除4 周和8 周后,IL-1α 的表达继续下降,与应激组相比差异有统计学意义(P<0.000 1,P<0.000 1),与对照组差异无统计学意义(P>0.05)。
各组髁突软骨中MMP-3 表达的免疫组织化学染色和Western blot 结果见图7。在软骨细胞的细胞质和细胞外基质中出现MMP-3的表达(图7a ~7e虚线标出部分)。应激8 周后,MMP-3 的表达明显高于对照组(P<0.000 1);应激去除后2 周和4 周,MMP-3 的表达逐渐下降,但仍高于对照组(P<0.000 1,P<0.000 1);应激去除8 周后,MMP-3 表达趋于正常,与应激组相比差异有统计学意义(P<0.000 1),与对照组差异无统计学意义(P>0.05)。
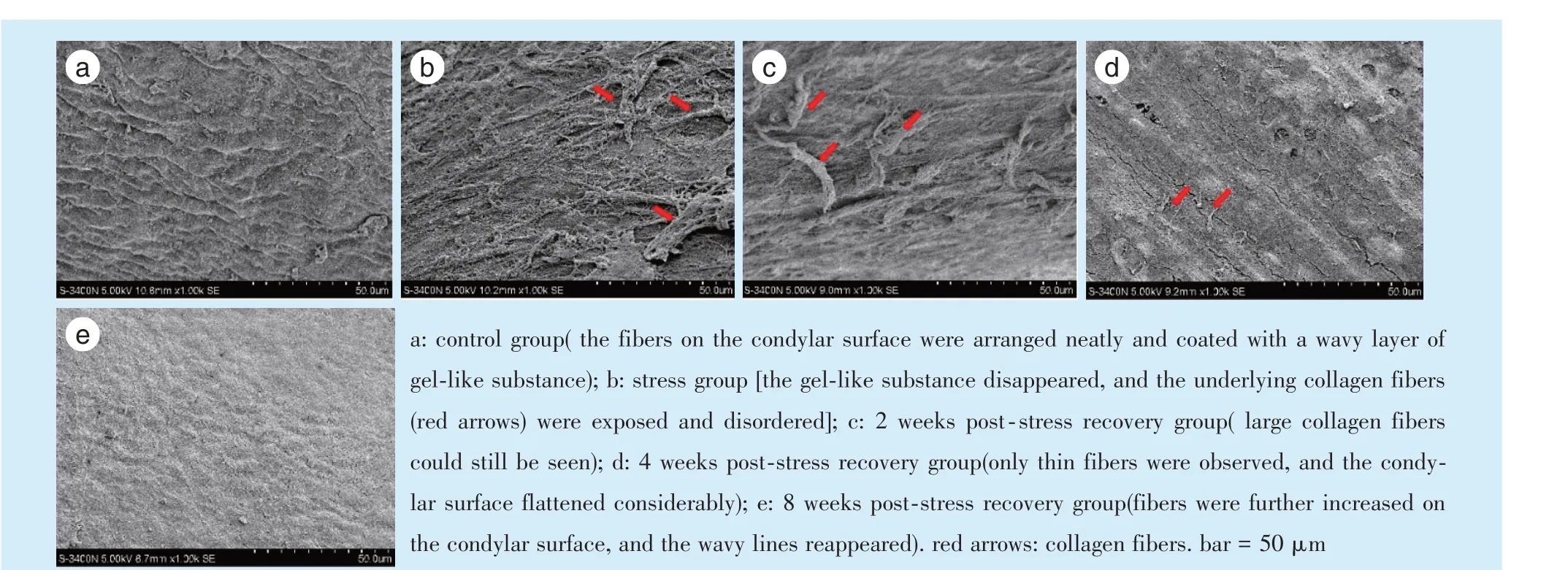
Figure 4 Scanning electron microscopy images of the ultrastructure of the condylar cartilage before and after removal of chronic unpredictable moderate stress in rats(1 000×)图4 大鼠慢性不可预见性应激去除前后髁突软骨扫描电镜结果(1 000×)

Figure 5 HE staining of condylar cartilage before and after removal of chronic unpredictable moderate stress in rats(200×)图5 大鼠慢性不可预见性应激去除前后髁突软骨HE 染色(200×)
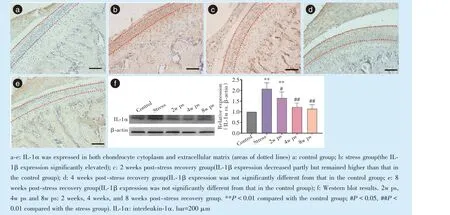
Figure 6 Immunohistochemical staining(200×)and Western blotting results of IL-1α expression in condylar cartilage before and after removal of chronic unpredictable moderate stress in rats图6 大鼠慢性不可预见性应激去除前后髁突中IL-1α 表达的免疫组织化学染色(200×)和Western blot 结果
3 讨 论
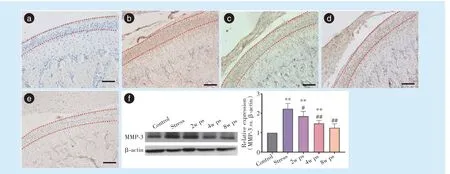
Figure 7 Immunohistochemical staining(200×)and Western blot results of MMP-3 expression in condylar cartilage beforeand after removal of chronic unpredictable moderate stress in rats图7 大鼠慢性不可预见性应激去除前后髁突中MMP-3 表达的免疫组织化学染色(200×)和Western blot 结果
大量研究证实,心理因素在TMD 的发生、发展和预后中起着重要作用。国际TMD 诊断标准联盟已明确提出:心理-社会因素的轴Ⅱ诊断是评估TMD 发生与持续可能性的重要指标[2,15]。本课题组前期研究中采用CUMS 来模拟人类日常生活中受到的慢性应激[16-17],连续给予8 周后,动物可出现显著的抑郁样情绪[13]。本研究结果也显示,CUMS 应激8 周后,大鼠血清中CORT 和ACTH 水平显著增高,行为学表现为摄糖减少、FST 实验中“不动”时间延长,说明出现了明显的快感缺失、抑郁、绝望情绪,证明CUMS 模型建立成功。一般认为,应激可导致机体下丘脑-垂体-肾上腺(HPA)轴被激活,诱导糖皮质激素水平发生变化,进一步调控下丘脑神经元表达促肾上腺皮质激素,对神经系统中神经元的损伤、修复和神经递质的兴奋、抑制都发挥着重要作用,从而影响着机体社会行为学的变化[18]。而应激去除4 周后,血清学变化恢复到正常水平,应激去除8 周后,行为学变化也恢复到正常水平,可能是应激去除后,HPA 轴活动逐渐恢复正常,异常分泌的CORT 和ACTH 也降低至正常状态,启动神经内在保护机制,经过恢复时间的延长,大鼠异常行为学也得到恢复。因此,笔者认为CUMS 激发的这种神经内分泌和行为学反应可以恢复。
髁突软骨组织由于其特殊的组织结构[19],是颞下颌关节相对较为脆弱的部分。在髁突软骨的各层中,软骨细胞是软骨的核心成分,并表现出不同的形态和生物学功能。本研究通过对髁突软骨的组织学和超微结构观察发现,经CUMS 应激8 周后,髁突软骨表现出明显的退行性改变,软骨表面胶原纤维排列紊乱,蛋白多糖合成减少。其中的原因可能如下:①心理应激导致下颌骨肌肉过度活动,导致髁突软骨受到过度压力[14],软骨细胞出现代谢异常[20],最终导致软骨损伤;②心理应激引起的内分泌和免疫系统异常反应促进髁突软骨分泌炎症因子和蛋白酶,导致软骨基质发生降解[6]。
本研究通过对软骨组织学的观察发现,CUMS引起的髁突软骨损伤在8 周后均局限于软骨表面和中间层,并未发生严重的软骨下骨的损伤,未发生不可逆损害。因此,去除应激因子后,软骨损伤能逐渐出现自我修复过程,增殖层细胞呈代偿性增殖,出现无细胞区。这与以往关于软骨损伤恢复过程的研究结果相似[21]。通过扫描电镜观察,发现髁突表面的胶原纤维排列紊乱呈下降趋势。因此,笔者认为CUMS 应激8 周后引起的TMJ 髁突软骨损伤在一定程度上是可逆的。这也与之前的研究结果一致,即CUMS 导致的髁突损伤仅有细胞的蛋白多糖合成减少、纤维结构保持完整,而此种类别的关节损伤可以自然修复[22]。
以往研究证实,炎性因子在颞下颌关节退行性变的进展中起着重要作用。颞下颌关节骨关节炎往往伴随着髁突软骨中炎性因子IL-1 的分泌增多,进一步加重了局部的组织炎症反应[23]。并且,IL-1 可介导软骨细胞产生多种对软骨具有破坏性作用的胶原酶和蛋白聚糖酶,如MMP-3[24],对软骨基质的合成有抑制作用。MMP-3 是最重要的软骨降解酶之一,与Ⅱ型胶原和聚集蛋白聚糖的降解密切相关。有研究表明,在骨关节炎患者的软骨中出现了MMP-3 的高表达[25]。本研究结果显示,在正常的髁突软骨中,只有少量的IL-1α 和MMP-3表达,其中大部分在软骨肥厚层表达;应激8 周后,髁突中的IL-1α 和MMP-3 在各层软骨的胞内和细胞外基质中均有表达,且表达水平显著升高。这表明CUMS 引起的组织IL-1α 和MMP-3 的局部高表达与髁突软骨损伤密切相关,可能是诱发髁突软骨基质逐渐降解,最终促使细胞崩解的直接原因之一[26],从而导致髁突软骨的组织学损伤。而在去除应激因素后,IL-1α 和MMP-3 的表达水平出现明显的下降趋势,其中IL-1α 水平在去除应激4 周后与对照组达到一致,而MMP-3 的表达恢复稍慢,在去除应激因素8 周后恢复到正常水平。可能由于MMP-3 的产生部分是由IL-1α 介导,因此MMP-3 的表达变化存在滞后效应。IL-1α 和MMP-3 的表达水平在恢复期的显著下降,也提示应激引起的软骨局部炎症反应和基质破坏在应激去除后逐渐减轻,影响组织修复的不利因素明显减弱,可能也是破坏的软骨组织得到了较好的修复的因素之一[27]。
综上所述,本研究表明CUMS 造成的髁突软骨组织学和超微结构损伤在去除应激因素后8 周可得到较好的修复;软骨组织中IL-1α 和MMP-3 的表达水平在去除应激因素后明显降低,可能是调控髁突软骨自我修复过程的内在机制之一。研究者在认识TMD 的病因、发生机制时不能忽视心理因素的重要作用,及时去除应激对机体的影响可以逆转或者预防TMD 患者颞下颌关节发生的不可逆性改变。
【Author Contributions】 Liu Y and Liu XB performed the experiments and wrote the article. Li Q revised the article. Zhao YJ and Chen YJ designed the study. All authors read and approved the final manuscript as submitted.

