基于 Ca2+-CaMKII 信号通路的济川煎治疗阳虚便秘的作用及分子机制
刘 聪,张 悦,张润涛,荆 然,郭丁丁,倪 艳,康 永
(山西省中医药研究院中药方剂研究所,山西 太原 030045)
阳虚便秘(Yang deficiency constipation)属中医便秘症范畴,相当于现代医学的结肠慢传输型便秘(slow transit constipation,STC),为功能型便秘的主要分型之一。多数是由于结肠传输能力减弱、肠神经系统功能紊乱所诱发,主要表现以便次减少、腹胀、排出困难、便意缺乏、大便干燥、久蹲难下为特征的顽固型排便障碍[1],同时伴有不同程度的情绪低落、易激惹、失眠、焦虑等抑郁症状。随着病程的迁延不愈会继发器质性病变,也是结肠癌、直肠癌、大肠癌的重要危险因素之一。近年来,随着人们生活节律及饮食结构的改变,我国阳虚便秘的发病率逐年攀升且呈年轻化趋势[2]。研究证实,钙调蛋白依赖性激酶Ⅱ (calmodulin-dependent protein kinases Ⅱ,CaMKⅡ)调节胃肠平滑肌收缩的作用是由钙离子(Ca2+)诱发,胃肠神经释放递质促进Ca2+与钙调蛋白(calmodulin,CaM)结合形成 Ca2+- CaM 复合物与 CaMKⅡ 调节区结合使其构象改变,致使 CaMKⅡ 失活,导致不规则慢波诱发的动作电位,使胃肠道平滑肌产生不规则收缩运动,结肠运动迟缓[3]。
济川煎为治疗阳虚便秘的代表方剂之一,出自明代医家张景岳的《景岳全书》,具有温肾益精、润肠通便功能,主要治疗由肾阳虚弱、精津不足所致的大便秘结、畏寒怕冷、精神不振等症,为著名的“寓通于补之剂”,疗效确切;并于2018年收入国家中医药管理局会同国家药品监督管理局共同制定的《古代经典名方目录(第一批)》(63#)。济川煎课题组前期研究证明,济川煎具有一定的雄性激素样作用,可纠正模型动物的肾阳虚状态及明显的促排便作用,均与机体激素分泌、环核苷酸系统紊乱存在密切关系[4-5]。本研究通过建立阳虚便秘大鼠模型,结合相关蛋白差异表达,分析济川煎调控Ca2+- CaMKII 信号途径达到治疗阳虚便秘作用及分子机制,从而为济川煎临床治疗阳虚便秘提供新靶点、新途径及可靠的科学理论依据。
1 材料与方法
1.1 实验动物健康SD大鼠,SPF级,120只,♀♂各半,体质量(200±20) g,购自斯贝福(北京)生物技术有限公司,SCXK(京)2016-0002,批号:1103241911021763。动物饲养环境为SPF级,室温维持在(20~25) ℃,相对湿度40%~45%,昼夜明暗交替时间12/12 h。实验动物用常规颗粒饲料喂养;实验动物用水为纯净水;实验动物垫料为木质刨花垫料;饲养笼和饲养垫料每周更换1次,期间对饲养笼采取清洗灭菌处理。
1.2 药物与试剂济川煎(JCJ,肉苁蓉 9 g、当归 9 g、牛膝 6 g、枳壳 3 g、泽泻 4.5 g、升麻 3 g),药物饮片购自于山西省中医院中药房,生药水溶液最终浓度为1.725 kg·L-1,分装,-20 ℃保存备用。枸橼酸莫沙必利片(鲁南贝特制药有限公司,批号:215130511,规格 5 mg × 24 片);复方地芬诺酯片(仁和堂药业有限公司,批号:190202,规格:100 片/瓶);白醋(总酸度为 6 g / 100 mL,上海宝鼎酿造有限公司生产,批号:20191203);活性炭粉末(河南省淼源水处理材料有限公司生产,批号:20190405);RNA提取试剂盒(QIAGEN/Gmb,Lot:163048069);Transcriptor First Strand cDNA Synthesis Kit(Roche,Lot:43112721);QuantiNova SYBR Green PCR Kit(500)(QIAGEN/Gmb,Lot:163039888);增强型RIPA裂解液(武汉博士德生物工程有限公司,Lot:15G23C02);BCA蛋白浓度测定试剂盒(武汉博士德生物工程有限公司,Lot:15F08A46);飞克特超敏ECL发光液(Meilunbio,Lot:MAO186-Dec-31E);鼠单抗β-actin(武汉博士德生物工程有限公司,BM0627)、兔多单抗CaMKⅡβ(Abcam,ab34703)、鼠单抗CaMKⅡγ(Abcam,ab201966)、鼠单抗CaMKⅡδ(Abcam,ab181052)、鼠单抗CaMKⅡ(Abcam,ab22609)、HRP标记羊抗鼠二抗(武汉博士德生物工程有限公司,BA1051);Rat cAMP ELISA Kit(Bioswamp,Exp:202102);Rat cGMP ELISA Kit(Bioswamp,Exp:202102)。
1.3 仪器Cytation-5多模式微孔板检测仪(美国BioTek);Navios 10 COLORS/3 LASER流式细胞仪(美国贝克曼);PM.10AD光学显微镜(日本Olympus);T25数显高速匀浆机(德国IKA);WT-L6K 迷你离心机(湖南湘仪实验仪器开发有限公司);Veriti-96 PCR(美国ABI);7500 Real-Time PCR System(美国ABI);Allegra X-30R centrifuge(美国ABI);HD2高能成像分析仪(美国阿尔法);Mini-sub Cell电泳系统(美国BIO-RAD);Mini-sub Cell水平电泳槽(美国BIO-RAD);凝胶成像仪 (日本Fuji);全能型蛋白快速转膜仪(美国BIO-RAD)。
2 方法
2.1 模型制备健康SD大鼠120只,♀♂各半。取100只大鼠,按每只首剂量5 mL给予4 ℃白醋(总酸6%)灌胃,从第二次开始按 15 mL·kg-1体质量给予4 ℃白醋,两次间隔1 d,共9次。在每次给予白醋后d 2,按25 mL·kg-1体质量灌胃给予每只大鼠 16.67 mol·L-1的0 ℃活性炭冰水(活性炭300目),亦9次;于造模开始d 14,每只大鼠在灌胃结束3 h后加灌复方地芬诺酯(20 mg·kg-1),连续5 d[6-7]。同时满足两条判定标准视为模型成功:①根据造模大鼠一般评分标准,大于2~3分;②首粒黑便排出时间大于空白组均数。
2.2 分组及给药济川煎一日临床推荐口服生药量为34.5 g,按人60 kg体质量计算,34.5 g/60 kg=0.575 g·kg-1,则大鼠等效剂量(中剂量)为:0.575 g·kg-1×7.5倍=4.31(生药)g·kg-1,得到高剂量8.62(生药)g·kg-1,低剂量为2.16(生药)g·kg-1。将模型成功大鼠随机分为5组,即模型对照组、莫沙必利组(1.88 mg·kg-1)、济川煎高(8.26 g·kg-1)、中(4.31 g·kg-1)、低(2.16 g·kg-1)剂量组,每组10只,灌胃给药每日1 次,连续7 d;另取10只健康大鼠为空白组。空白组和模型组给予等体积的生理盐水。末次给药结束,室温制备血清,-20 ℃保存备用并摘取结肠组织制备结肠平滑肌单细胞悬液。
2.3 一般状态观察实验开始后观察各组动物形体、皮肤毛发、行为状态、情绪反应、大便数量、性状等变化,并按表(Tab 1)评分每天记录每只实验动物的一般状态及末次体质量。
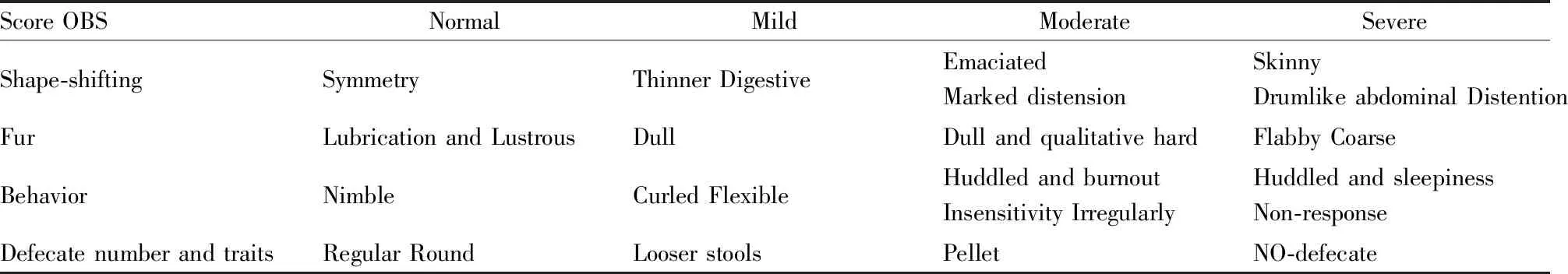
Tab 1 Score sheets by performance status of rats
2.4 排便功能测定末次给药结束,禁食不禁水12 h,称质量,定量给予各组大鼠16.67 mol·L-1的0 ℃活性炭冰水灌胃,立刻将实验动物逐只置于代谢笼内进行观察,记录首粒排黑便时间及6 h内排黑便粒数。
2.5 大鼠结肠平滑肌钙离子(Ca2+)浓度测定把经过分离处理的结肠平滑肌细胞置入负载液内(由0.2 g·L-1Pluronic F-127与8.5μmol·L-1的 Fluo-3AM 混制而成),在37 ℃条件下,置于细胞培养箱(95% O2,5% CO2)内孵育1 h后在1 000 r·min-1条件下进行5 min的离心处理,弃上清。选择无染料的PBS对细胞进行冲洗,离心弃上清,洗2次。在37 ℃条件下,把经过负载处理的细胞置于细胞培养箱内孵育0.5 h,然后选择流式细胞仪作检测处理:发射光、激光波长分别为528 nm、488 nm,采用Cell Quest 软件进行数据采集、分析。
2.6 RT-PCR法检测各组大鼠结肠组织中CaM、CaMKII亚型收集细胞,离心2 000g,5 min,去上清液,标记细胞样本放置-20 ℃备用。按照RNA提取试剂盒说明书配置工作液并标记日期,样本常温融化后用200 μL PBS重悬,加入400 μL Lysis Binding Buffer,涡旋15 s后将样本转移至组合套管内,离心10 000r,弃废液,每个样本加入100 μL混合液(DNaseI incubation 90 μL+DNaseI 10 μL),常温孵育15 min 后加入500 μL wash Buffer I,离心弃液,加入500 μL wash Buffer Ⅱ,离心弃液,加入200 μL wash Buffer Π,离心3 min,17 000r,弃液,将内管转至去盖的1.5 mL离心管中,打开内管的盖子3~5 min后加入60 μL Elution Buffer,常温孵育5 min,离心2 min,后收集内管的总RNA,置于-80 ℃保存。按照反转录试剂盒,常温融化试剂和样本,配置工作液按照说明书加入液体,在Veriti 96 PCR仪器进行反转录,得到的cDNA 置于-20 ℃保存。用PCR-water 按照说明稀释目标引物至10 μmol·L-1,按荧光定量PCR检测试剂盒说明书加入试剂,扩增,共40个循环(95 ℃,10 s 和59.5 ℃,34 s),引物序列见Tab 2。

Tab 2 Primer sequence of target gene
2.7 Western blot检测各组大鼠结肠组织中 CaM、CaMKⅡ 亚型按照比例将蛋白酶抑制剂和细胞裂解液加入装有结肠平滑肌细胞的 EP 管中,4 ℃,12 000 转 离心15 min,取上清,即得总蛋白。采用BCA法进行蛋白浓度测定。调整各组蛋白为统一浓度,用 4×SDS缓冲液稀释(按照3 ∶1比例)取出的上样量后,100 ℃煮沸10 min,将电泳缓冲液加入电泳槽内,然后缓慢加入样品,参照蛋白Maker位置,当目的条带到达最佳凝胶分离区时,停止电泳,立刻转印至PVDF膜,转膜结束后将膜置入5%脱脂奶粉的封闭溶液中封闭2 h。加入 CaM、CaMKII亚型的一抗中4 ℃摇床孵育过夜,次日取膜,洗膜脱3次,每次5 min。后将膜放入相应二抗中,室温孵育1 h。之后再次TBST摇床洗脱每次5 min,3次。将配置好的发光液均匀加到PVDF膜上,暗室发光。利用ImageJ软件进行灰度分析。
2.8 ELISA法检测大鼠血清中 cAMP、cGMP含量-20 ℃取出大鼠血清,室温溶解,按照 ELISA 试剂盒说明书进行预处理,每孔设置复孔,微孔板检测仪450 nm进行测定。
3 结果
3.1 一般状态观察Tab 3结果显示,造模期间,空白组皮毛光亮,活动自如、灵敏,体质量增长持续、稳定;实验组大鼠造模开始后出现明显腹胀、反应迟钝、活动减少、倦怠蜷缩,随着造模时间增长继而出现摄食饮水量减少,排便减少,腹胀的表现,同时饲养笼垫料湿度明显增大,评分明显升高(P<0.01);在造模d 14加灌复方地芬诺酯后,实验组出现排便粒数骤减的状况,大便干硬状若米粒,体质量降低明显(P<0.001),提示模型成功。济川煎的高、中剂量组给药后状态缓解(P<0.01),体质量增长明显(P<0.05)。
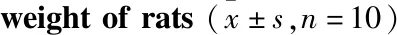
Tab 3 Effect of JCJ on performance status and
3.2 排便功能测定Tab 4结果显示,模型组大鼠的首粒排便时间推迟,6 h内排便粒数明显减少(P<0.01);莫沙必利组及济川煎各剂量组首粒排便时间明显缩短,排便粒数明显增加(P<0.05或P<0.01)。
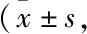
Tab 4 Effect of JCJ on defecation function of rats n=10)
3.3 大鼠结肠平滑肌细胞的免疫荧光鉴定如Fig 1鉴定结果显示,红色荧光为α-SMA阳性,阳性率>90%,即:结肠平滑肌细胞纯度>90%,提示可以进行后续实验。

Fig 1 Cells from colonic smooth muscle of rats and identified by immunofluorescence staining
3.4 济川煎对模型大鼠结肠平滑肌细胞Ca2+浓度的影响Tab 5结果显示,模型组[Ca2+]i明显升高(P<0.01);经过不同剂量的济川煎干预,结肠平滑细胞内[Ca2+]i明显下降(Fig 2),且呈剂量依赖性 (P<0.05或P<0.01)。

Tab 5 Effect of JCJ on intracellular Ca2+ concentration from colonic smooth muscle cells of rats
3.5 济川煎对模型大鼠结肠平滑肌细胞内CaM、CaMKⅡ 亚型 mRNA 表达的影响Tab 6 结果显示,模型组CaM及CaMKⅡ β、γ、δ亚型mRNA表达较空白组明显升高(P<0.05或P<0.01);济川煎各剂量对模型大鼠进行干预治疗后,CaM及CaMKⅡ β、γ、δ亚型mRNA都明显降低(P<0.05或P<0.01)。
3.6 济川煎对模型大鼠结肠平滑肌细胞CaM、CaMKⅡ亚型蛋白表达的影响Tab 7结果显示,模型组CaM及CaMKⅡ β、γ、δ亚型蛋白表达较空白组明显升高(P<0.01);济川煎各剂量组给药后,CaM及CaMKⅡ β、γ、δ亚型蛋白表达均明显降低(Fig 3),尤以中、高剂量组明显(P<0.05或P<0.01)。

Tab 6 The mRNA expression of CaM and CaMKⅡ subtypes analyzed by RT-PCR

Tab 7 The protein expression of CaM and CaMKⅡ subtypes analyzed by Western blot
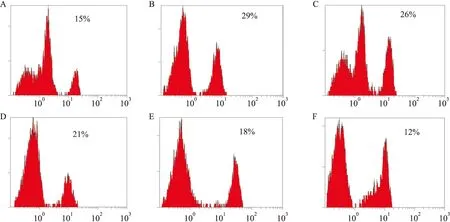
Fig 2 Effect of JCJ on intracellular Ca2+ concentration from colonic smooth muscle cells of ratsA:Normal group;B:Model group;C:Mosapride citrate group ( 1.88 mg·kg-1);D:JCJ low-does group ( 2.16 g·kg-1);E:JCJ middle-does group( 4.31 g·kg-1);F:JCJ high-does group( 8.26 g·kg-1).
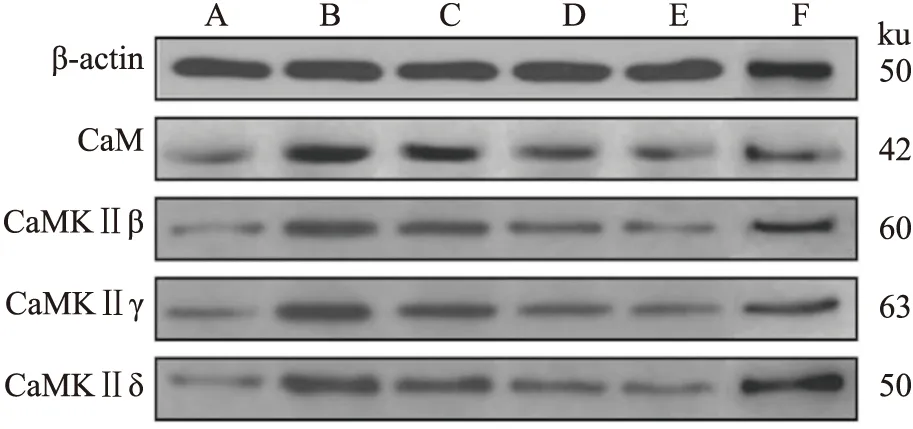
Fig 3 Effect of JCJ on protein expression of CaM and CaMKⅡ subtypes in colonic smooth muscle cells of ratsA:Normal group;B:Model group;C:JCJ low-does group( 2.16 g·kg-1) ;D:JCJ middle-does group( 4.31 g·kg-1);E:JCJ high-does group( 8.26 g·kg-1);F:Mosapride group( 1.88 mg·kg-1).
3.7 济川煎对模型大鼠血清中cAMP、cGMP含量及其比值的影响Tab 8 结果表明,与空白组相比,模型组cAMP含量明显下降,cGMP 含量明显升高(P<0.01);给药后,济川煎中、高剂量组可增加cAMP含量,减少cGMP的含量,cAMP/cGMP比值增加明显(P<0.05或P<0.01)。

Tab 8 Effect of JCJ on content of cAMP,cGMP in serum of rats
4 讨论
4.1 流行病学及病因病机阳虚便秘证以女性及老年人为主要高发人群,是由于肾脏受邪,虚而津液枯燥,致令肠胃干燥,传导糟粕能力减弱,故大便难下。大量的基础和临床研究表明,导致阳虚便秘的危险因素主要包括:精神压力、滥用药物、运动量减少、胃肠传输功能减弱、肠神经递质分泌合成受阻、肠道菌群功能紊乱等,其中胃肠传输功能减弱是引起该疾病的主要原因。所以,针对由于胃肠传输功能减弱引发的且症状轻微者进行药物导泻治疗,长期使用会出现毒副作用,并对药物产生明显耐受;对症状严重的患者进行手术治疗,但术后并发症的产生或无明显症状改善等情况时有发生,不仅严重影响患者的生活质量及精神状态,还会加重患者家庭及社会负担。因此,寻找新的治疗阳虚便秘的靶向药物至关重要,而中医药在治疗阳虚便秘上显示出独特优势。
4.2 阳虚便秘与阴阳“二元论”关系阳虚便秘主要是指肾阳虚便秘,与HPA轴、甲状腺轴及性腺轴的紊乱密切相关[8]。本实验采用白醋与0 ℃活性炭冰水联合复方地芬诺酯片复制肾阳虚便秘大鼠模型。造模后,大鼠出现体质量下降、被毛疏松、精神倦怠、弓背蜷缩、肢凉尾冷、自主活动减少、排便骤减且质硬等明显的“阳虚及便秘体征”。研究证明,环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP)参与细胞反应的调节,具有相互拮抗作用,CAMP和cGMP的相对平衡有益于维持机体的稳定生理状态,据此提出生物控制二元论,即阴阳学说[9-10]。本实验中,模型组cAMP明显降低,cGMP明显增加,且cAMP/cCMP比值明显降低,表明大鼠机体环核苷酸系统失衡,肾上腺皮质系统受到抑制;给予济川煎后,血清cAMP含量明显升高,cGMP明显降低,cAMP/cGMP比值明显升高,表明济川煎可以改善机体环核苷酸系统失衡状态及肠道传输功能,增加排便量。
4.3 CaMKⅡ 与阳虚便秘密切相关CaMKⅡ是一种多功能、作用底物广泛的丝氨酸/苏氨酸磷酸化蛋白激酶,具有α、β、γ、δ 4个不同转录亚基,主要调节神经元活动、肌肉收缩、细胞周期控制等。研究发现,CaMKⅡ的4种亚基进行选择性拼接可以形成同源多聚体和异源多聚体,且功能强大,由3个单元域组成,即高度保守的氨基端催化域、变化较多的中间连接域及羧基端结合域,其中羧基端结合域与4种亚基会形成六元环结构对CaMKⅡ感受Ca2+信号的振幅和频率产生重要影响;中间连接域大小发生的变化影响CaMKⅡ对钙信号的频率敏感性;氨基端催化域呈放射结构对蛋白与CaMKⅡ的结合起到关键作用[8]。当胞内 Ca2+浓度升高形成Ca2+-CaM复合物,导致CaMKⅡ的β、γ、δ亚基发生快速磷酸化激活 CaMKⅡ 产生活性[9-10];当Ca2+浓度下降或CaM从CaMKⅡ解离后,而发挥抑制功能[12]。本实验中,采用FCM技术对济川煎干预阳虚便秘模型大鼠的结肠平滑肌细胞中Ca2+浓度进行测定,发现模型组Ca2+浓度较空白组明显升高,推测是由于 Ca2+- CaM 复合物增多,直接或间接激活CaMKⅡ产生活性,导致结肠平滑肌收缩障碍;给予济川煎后,胞内Ca2+浓度下降明显,表明济川煎能够有效降低结肠平滑肌胞内Ca2+增多现象,而莫沙必利组则对胞内Ca2+变化无明显的调节作用。随后,采用 RT-PCR及Western blot法对胞内CaM、CaMKⅡ亚型蛋白进行检测,发现模型组 CaM、CaMKⅡ的β、γ、δ亚型确有在结肠平滑肌细胞中表达,且较空白组均明显增多,在给予济川煎后下降明显,表明济川煎对 CaM、CaMKⅡ的β、γ、δ亚型具有明确的直接或间接的调节作用;同样,莫沙必利组对CaMKⅡ的β、γ、δ亚型较空白组无明显的调节作用,推测莫沙必利促进胃肠蠕动与调节 CaMKⅡ无关。
本研究结果表明,济川煎作用于阳虚便秘模型大鼠,可明显缓解造模出现的明显腹胀、反应迟钝、活动减少、倦怠蜷缩及排便减少状态,缩短排便时间,增加排便粒数;并明显降低模型大鼠结肠平滑肌细胞内Ca2+浓度、CaM、CaMKⅡ β、γ、δ的表达;济川煎还能明显恢复机体环核苷酸系统紊乱状态。提示,济川煎可能是通过调控Ca2+-CaMKⅡ信号通路达到治疗阳虚便秘的目的,或成为阳虚便秘潜在的临床生物标志物,但其可行性尚需进一步研究证实。

