毛喉素对猪卵母细胞降脂及冷冻保护效果研究
蔡绍莉,徐皆欢,何孟纤,张德福,孙玲伟,张树山,李婉君,吴彩凤,主 性,戴建军*
(1.贵州大学动物科学学院,贵阳 550025; 2.上海市农业科学院畜牧兽医研究所上海市农业遗传育种重点实验室,上海 201106; 3.农业农村部畜禽资源(猪)评价利用重点实验室,上海 201106; 4.上海种猪工程技术研究中心,上海 201302)
自1972年Whittingham等[1]实现小鼠卵母细胞玻璃化冷冻保存以来,该技术已在牛、羊、兔、大鼠等二十多个物种上推广应用。与之相比,猪卵母细胞因脂质含量高、渗透性差,阻碍了渗透保护剂对水分的充分置换,导致其冷冻时胞内水分形成冰晶而发生机械性损伤。目前,猪卵母细胞冷冻效率仍很低[2],直到2014年[3]和2015年[4]才分别自GV期与MII期冷冻卵母细胞中获得了存活后代,但冷冻效率尚不足以推广至生产应用。已有研究证实,猪卵母细胞对低温极其敏感,15 ℃下15 min基本丧失存活能力[5]。大量研究表明,猪卵母细胞胞内的高浓度脂肪颗粒是造成其对低温敏感的主要原因[6]。尽管通过对卵母细胞或胚胎进行离心去脂处理,可提高冻后存活率[7],但高速离心和显微操作会造成透明带受损,导致潜在的病原感染风险[8],且成本高、技术难度大,不适用于生产应用。另外,卵母细胞内脂肪参与了氧化磷酸化、糖酵解、三羧酸循环等产能途径,为细胞提供所需能量,是卵母细胞成熟及胚胎发育的重要能源物质。离心和去脂处理对脂肪颗粒分布、卵丘-卵母细胞复合体的完整性和能量供给均产生较大负面作用,严重影响卵母细胞减数分裂进程[9]。
一些天然化合物,如左旋肉碱[10]、毛喉素[11]等已被证实可在不影响卵母细胞成熟的情况下降低其脂质含量,但目前尚未在冷冻保存中得到应用。毛喉素是一种自毛喉鞘蕊花中分离得到的天然降脂物质,不仅能促进脂质分解,还可调节细胞生理进程与新陈代谢[12]。有研究发现,在猪胚胎培养基中加入毛喉素可降低其胚胎中的脂质含量[11,13]。基于此,本研究拟利用非侵入式的化学降脂方法,通过在卵母细胞成熟培养过程中添加毛喉素,成熟后检测细胞内脂滴含量、超微结构、线粒体膜电位、卵母细胞活性氧水平、冻后存活率及发育潜能等多方面的变化,评价毛喉素的降脂效果和对猪卵母细胞抗冻能力的影响,促进卵母细胞冷冻保存技术在猪保种中的应用。
1 材料与方法
1.1 试验分组
猪卵母细胞分组处理如下:经体外成熟培养的MII期卵母细胞组(Fresh)、成熟培养期间经毛喉素处理的MII期卵母细胞组(Forskolin)、未经毛喉素处理的MII期卵母细胞冷冻-解冻组(Vitirfied)、经毛喉素处理的MII期卵母细胞冷冻-解冻组(Vitirfied+Forskolin)。
1.2 试剂
Medium-199 with HEPES、胎牛血清(foetal bovine serum,FBS)、青链霉素(penicillin streptomycin)及丙酮酸钠(sodium pyruvate)购自美国Gibco。乙二醇(ethylene glycol,EG)购自美国Fluka。人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)及孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)购自宁波第三激素制品有限公司。毛喉素(Forskolin)、二乙酸萤光素(FDA)、25 mL·L-1戊二醛(电镜专用)及尼罗红购自上海源叶生物科技有限公司。活性氧检测试剂盒、JC-1膜电位检测试剂盒、Annexin-V细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。猪卵泡液(porcine follicular luid,pFF)由本实验室自制。其他试剂购自美国Sigma。
1.3 卵母细胞成熟培养与毛喉素处理
自屠宰场采集新鲜猪卵巢,39 ℃保温,1 h内送至实验室。利用10 mL注射器抽吸卵巢表面2~6 mm卵泡,收集卵泡液,沉淀30 min以上,弃上清,沉淀置于倒置显微镜下挑选卵丘-卵母细胞复合体(cumulus- oocyte complexes,COCs),Medium-199洗涤3次,置于成熟培养液中培养44 h,培养条件39 ℃、50 mL·L-1CO2和饱和湿度。成熟培养液(IVM)配方:取1 mL FBS、1 mL pFF、100 μL 1 000 IU·mL-1PMSG、100 μL 1000 IU·mL-1hCG、100 μL双抗、100 μL 6.9 mg·mL-1L-Cys、10 μL 10 μg·mL-1EGF溶于7.6 mL Medium-199中混匀。培养后的COCs置于1 mL·L-1透明质酸酶中反复吹打,直至颗粒细胞完全洗脱,Medium-199洗涤3次后备用。参照Prates等[14]研究报道,本研究试验组为在体外成熟培养液中添加终浓度为10 μmol·L-1的毛喉素。
1.4 冷冻-解冻
卵母细胞于冷冻平衡液(每10 mL中含0.75 mL EG、0.75 mL DMSO和2 mL FBS,Medium-199定容至10 mL,混匀)中平衡5 min,移入玻璃化冷冻液(每10 mL中含1.36 g蔗糖、1.5 mL DMSO、1.5 mL EG和2 mL FBS,Medium-199定容至10 mL,混匀),30 s后装载至Cryotop载杆,立即投入液氮,于液氮下插入冷冻套管中,转移至液氮罐冻存2周。解冻时,将Cryotop细胞装载区提出液氮面并立即置入39 ℃解冻液I(每10 mL中含1.026 g蔗糖,2 mL FBS,Medium-199定容至10 mL,混匀)中,5 min后将卵母细胞移入解冻液II(每10 mL中含0.513 g蔗糖,2 mL FBS,Medium-199定容至10 mL,混匀)孵育5 min,再移入孵育液(100 mL·L-1FBS的Medium-199溶液)中洗涤3次后孵育2 h,获得冷冻-解冻卵母细胞。
1.5 卵丘扩散及卵母细胞成熟率检测
经成熟培养后,于镜下检测卵丘扩散程度。洗脱颗粒细胞后,观察卵母细胞第一极体排出情况,排出第一极体视为卵母细胞成熟。
1.6 脂滴数量及面积检测
卵母细胞置于含10 μmol·L-1尼罗红Medium-199中39 ℃孵育15 min,Medium-199洗涤3次,压片,封片,激光扫描共聚焦显微镜观察卵母细胞内脂滴数量及面积(激发波长410 nm,发射波长455 nm;扫描时选取卵最大横截面进行脂滴数量及面积统计)。
1.7 超微结构观察
卵母细胞于25 mL·L-1戊二醛中4 ℃固定2 h,预冷的PBS缓冲液洗涤2次,每次10 min。于10 mL·L-1锇酸(4 ℃)中固定2 h,4 ℃双蒸水洗涤2次,每次10 min;乙醇逐级脱水,环氧丙烷置换2次,每次10 min,再用Epon 812浸透,60 ℃烘箱内包埋48 h,切片,枸橼酸铅电子染色,自然干燥后于透射电子显微镜(HITACHI H-7650)下观察、拍照。
1.8 线粒体膜电位检测
利用JC-1检测试剂盒(碧云天)检测卵母细胞的线粒体膜电位(ΔΨm)。卵母细胞于含2 μmol·L-1JC-1的Medium-199中39 ℃孵育20 min,洗涤3次,压片,封片。激光扫描共聚焦显微镜检测荧光强度,红(JC-1聚合物最大激发波长为585 nm,最大发射波长为590 nm)/绿(JC-1单体最大激发波长为514 nm,最大发射波长为529 nm)荧光强度比值即为ΔΨm。
1.9 活性氧(ROS)水平检测
利用活性氧(reactive oxygen species,ROS)试剂盒(碧云天)检测卵母细胞ROS水平,将卵母细胞置于含10 μmol·L-1DCFH-DA的Medium-199中,39 ℃孵育20 min,Medium-199洗涤3次后于荧光显微镜下拍照,统计荧光强度值。
1.10 细胞早期凋亡检测
利用Annexin V细胞凋亡试剂盒(碧云天)检测卵母细胞早期凋亡。将卵母细胞置于含50~100 μL Annexin V-mCherry的Binding Buffer中室温避光孵育30 min,孵育结束后置于冰浴中,Medium-199洗涤3次,荧光显微镜观察,红色荧光即为发生早期凋亡的卵母细胞。
1.11 冻后存活率检测
利用二乙酸荧光素(Fluorescein diacetate,FDA)荧光探针检测卵母细胞冻后存活率。卵母细胞于含5 μg·mL-1FDA的Medium-199中39 ℃孵育10 min,PBS洗涤3次,荧光显微镜观察,绿色荧光即为存活的卵母细胞。
1.12 卵母细胞冻后胚胎发育能力检测
卵母细胞于电激活液[15]中洗涤3次,移入铺有电激活液的0.5 mm激活槽中电激活,激活参数为1.2 kv·cm-1、30 μs,一次脉冲。电激活后,卵母细胞经胚胎培养液(PZM-3)洗涤3次,移入PZM-3中39 ℃、50 mL·L-1CO2饱和湿度下培养,2 d观察卵裂、5 d观察桑椹胚、7 d观察囊胚形成情况。
1.13 数据统计
每个试验至少重复3次,每个重复使用30个卵母细胞。采用Image-Pro Plus 6.0量化荧光值,采用SPSS l7.0 (SPSS Inc,Chicago,IL,USA)对数据执行单因素方差分析,LSD多重比较,结果以“平均值±标准误”表示,P<0.05代表组间差异显著,P<0.01代表组间差异极显著。
2 结 果
2.1 毛喉素对猪卵母细胞体外成熟的影响
图1结果表明,经毛喉素处理后,Fresh组和Forskolin组的卵母细胞体外成熟培养后卵丘均匀扩散,且在第一极体排出率上差异不显著(88.00%vs.92.00%,P>0.05)。
2.2 毛喉素促进冷冻猪卵母细胞脂滴降解
体外成熟卵母细胞中脂滴荧光定位及统计结果如图2所示。与Fresh组相比,成熟培养过程中添加毛喉素极显著降低了猪卵母细胞内脂滴数量(192.34±14.15vs.459.86±25.53,P<0.01)及相对面积(0.62±0.05vs.1.00±0.05,P<0.01)。与Fresh组相比,Vitrified组卵母细胞内脂滴数量(245.87±36.72vs.459.86±25.53,P<0.01)和脂滴相对面积(0.50±0.039vs.1.00±0.054)极显著下降(P<0.01)。Vitrified+Forskolin组的卵母细胞脂滴数量(140.07±11.09)和脂滴相对面积(0.33±0.031)均显著低于Vitrified组(245.87±36.72和0.50±0.039)(P<0.01)。结果显示成熟培养过程中添加毛喉素可显著降低冷冻前后卵母细胞内脂质含量。
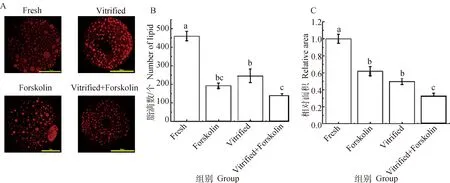
A.尼罗红染色荧光影像。尼罗红染色后卵母细胞内的脂滴可被检测到红色荧光,标尺=50 μm。B.卵母细胞脂滴数量统计学分析。C.卵母细胞脂滴相对面积统计学分析。柱上不同字母代表组间差异极显著,P<0.01,下同A. Fluorescent images stained with Nile red. Red fluorescence can be detected in lipid droplets in oocytes after Nile red staining, Scale bar=50 μm. B. Statistical analysis of the number of lipid droplets in oocytes. C. Statistical analysis of relative area of lipid droplets in oocytes. Different letters on the column represent extremely significant differences, P<0.01, the same as below图2 卵母细胞脂滴数量与定位Fig.2 Number and location of lipid droplets in oocytes
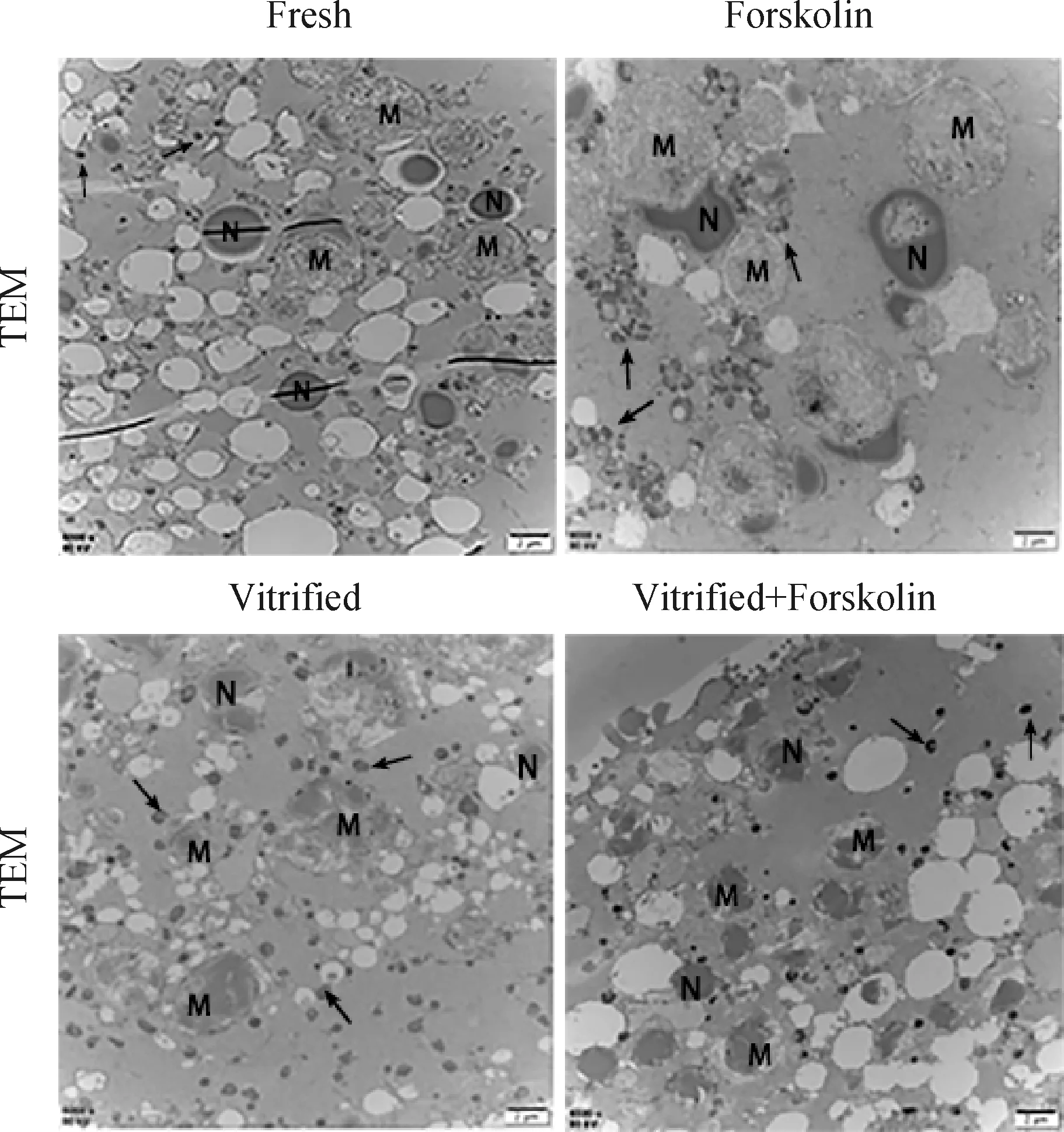
M. 非均质脂滴;N. 均质脂滴;黑色箭头指向线粒体;标尺=2 μmM. Heterogeneous lipid droplets; N. Homogeneous lipid droplets; Black arrows point to mitochondria; Scale bar=2 μm图3 卵母细胞超微结构观察Fig.3 Ultrastructural observation of oocytes
2.3 毛喉素对冷冻猪卵母细胞脂滴及线粒体超微结构的影响
超微结构观察发现,卵母细胞内存在两种脂滴形态,分别为非均质脂滴和均质脂滴,非均质脂滴呈球形并伴有许多透亮的线状条纹。冷冻前,Fresh组中非均质脂滴的数量要略高于均质脂滴,且非均质脂滴的大小比均质脂滴大,线粒体均匀分布于胞质中,线粒体嵴明显;经毛喉素处理后,卵母细胞中非均质脂滴与均值脂滴的数量比例则进一步扩大,且比均质脂滴更大,线粒体成簇分布在非均质脂滴的周围,线粒体嵴明显。
卵母细胞经玻璃化冷冻后,细胞内的非均质脂滴明显增加;与Vitrified组相比,经毛喉素处理的冷冻卵母细胞非均质脂滴的比例进一步增加,均质脂滴减少甚至是消失,脂滴大小进一步下降。冷冻后的卵母细胞线粒体模糊或消失,脂滴周围空泡化程度加剧。
2.4 毛喉素缓和猪卵母细胞冻后线粒体去极化
卵母细胞线粒体膜电位检测结果见图4。无论是毛喉素处理卵母细胞,还是未处理卵母细胞,冷冻后其线粒体膜电位值均极显著低于其对应的未冷冻卵母细胞(P<0.01),说明冷冻会导致卵母细胞线粒体膜电位显著降低;与Vitrified组相比,Vitrified+Forskolin组的线粒体膜电位显著提高(1.04±0.53vs.0.51±0.03,P<0.01),说明毛喉素处理可显著改善冻后卵母细胞的线粒体功能。
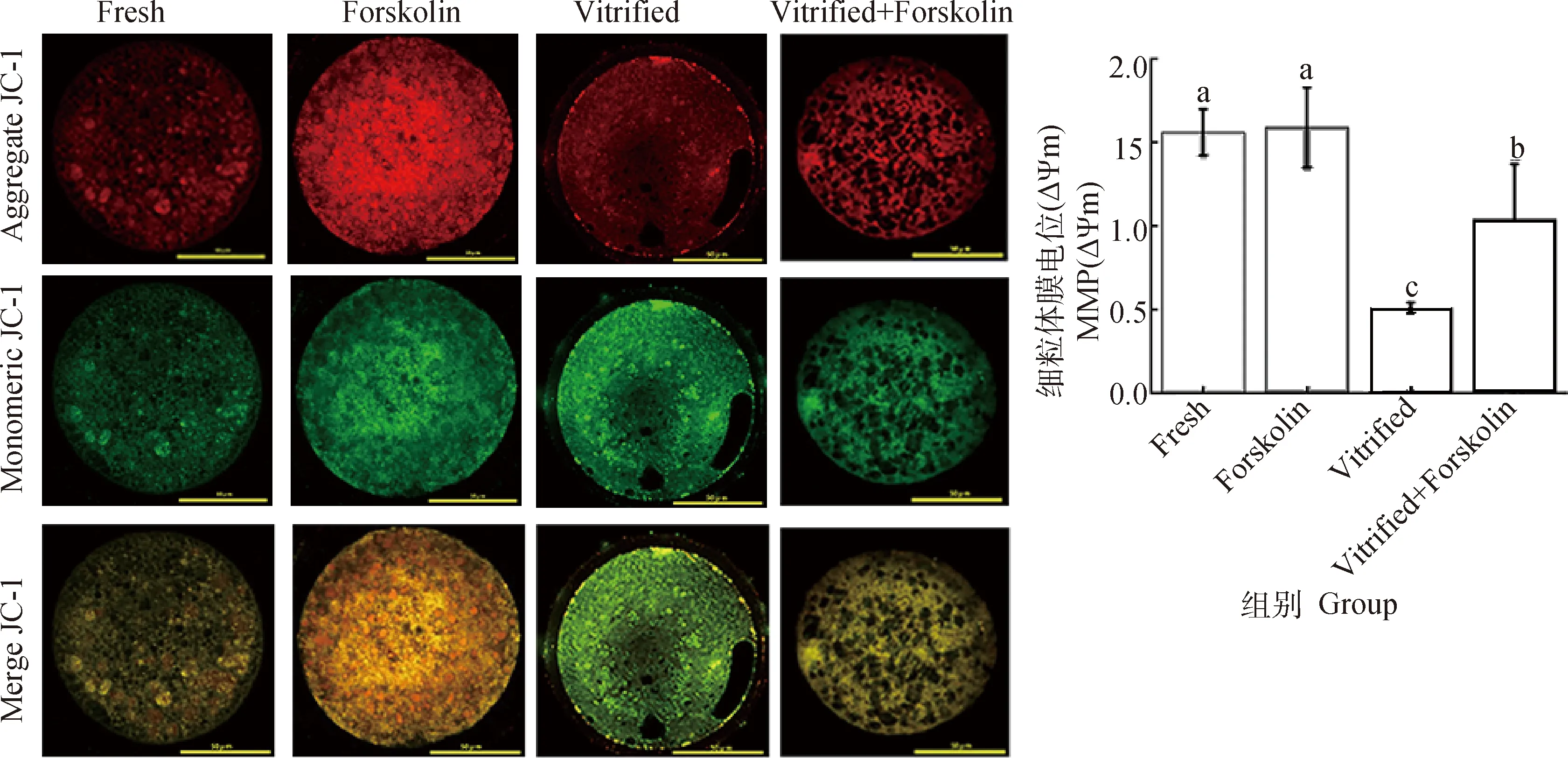
A.卵母细胞线粒体膜电位检测。线粒体处于高膜电位时,JC-1聚合物呈红色荧光;低膜电位时,JC-1单体呈绿色荧光,标尺=50 μm。B. 线粒体膜电位结果统计学分析A. The determination of oocyte ΔΨm. Red florescence of poly-JC-1 can be monitored when ΔΨm is high, while green florescence of mono-JC-1 is monitored when ΔΨm is low, Scale bar=50 μm. B. Statistical analysis of ΔΨm图4 卵母细胞线粒体膜电位检测Fig.4 Determination of oocyte mitochondrial membrane potential
2.5 毛喉素减轻猪卵母细胞冻后氧化应激
卵母细胞活性氧检测结果见图5。无论是毛喉素处理卵母细胞,还是未处理卵母细胞,冷冻后卵母细胞的ROS荧光强度值均极显著高于未冷冻组(P<0.01),表明玻璃化冷冻加剧了卵母细胞氧化应激。与Vitrified组相比,在成熟培养液中添加毛喉素极显著降低了冻后卵母细胞ROS水平(11.57±0.58vs.22.77±2.23,P<0.01)。表明成熟培养期间添加毛喉素能减缓冷冻对卵母细胞造成的氧化应激。
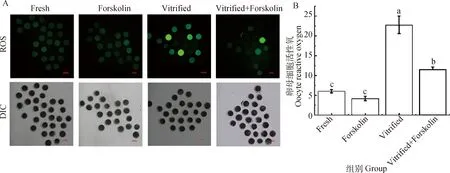
A. DCFH-DA染色荧光影像。DCFH-DA染色后,含有ROS的卵母细胞可被检测到绿色荧光,标尺=100 μm。B. 卵母细胞活性氧水平统计学分析A. Images of DCFH-DA staining. After stained by DCFH-DA, oocytes containing ROS can be monitored in green florescence, Scale bar=100 μm. B. Statistical analysis of oocyte ROS level图5 卵母细胞活性氧检测Fig.5 Determination of ROS level in oocytes
2.6 毛喉素抑制冷冻猪卵母细胞早期凋亡
卵母细胞早期凋亡检测结果见图6。结果显示,成熟培养过程中添加毛喉素对成熟卵母细胞早期凋亡率指标没有显著影响(6.00%vs.5.57%,P>0.05);经玻璃化冷冻后,Vitrified组和Vitrified+Forskolin组的早期凋亡比例与未冷冻组相比均极显著上升(P<0.01),表明冷冻极易引起冻后卵母细胞凋亡。与Vitrified组相比,成熟培养过程中添加毛喉素可极显著抑制卵母细胞冷冻后的早期凋亡率(68.30%vs.86.03%,P<0.01)。结果表明,添加毛喉素可显著降低冷冻引起的卵母细胞早期凋亡。
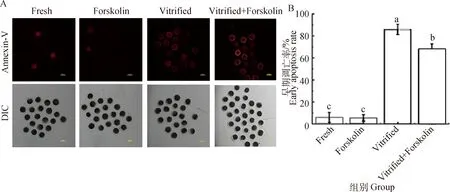
A. Annexin-V染色荧光影像。Annexin-V染色后,出现早期凋亡的卵母细胞可被检测到红色荧光,标尺=100 μm。B. 卵母细胞早期凋亡统计学分析A. Images of Annexin-V staining. After stained by Annexin-V, early apoptotic oocytes can be monitored in red florescence, Scale bar=100 μm. B. Statistical analysis of oocyte early apoptosis rates图6 卵母细胞早期凋亡检测Fig.6 Determination of oocyte early apoptosis
2.7 毛喉素提高猪卵母细胞冷冻存活率
卵母细胞存活率检测结果见图7。结果显示,新鲜卵母细胞中毛喉素处理对卵母细胞的冻前存活率(98.67%vs.95.90%)无显著影响(P>0.05)。经玻璃化冷冻后,毛喉素处理组的冻后存活率由51.47%提高至71.17%(P<0.01)。表明冷冻会导致卵母细胞死亡率升高,在成熟培养期间添加毛喉素能上调冷冻后卵母细胞的存活率。
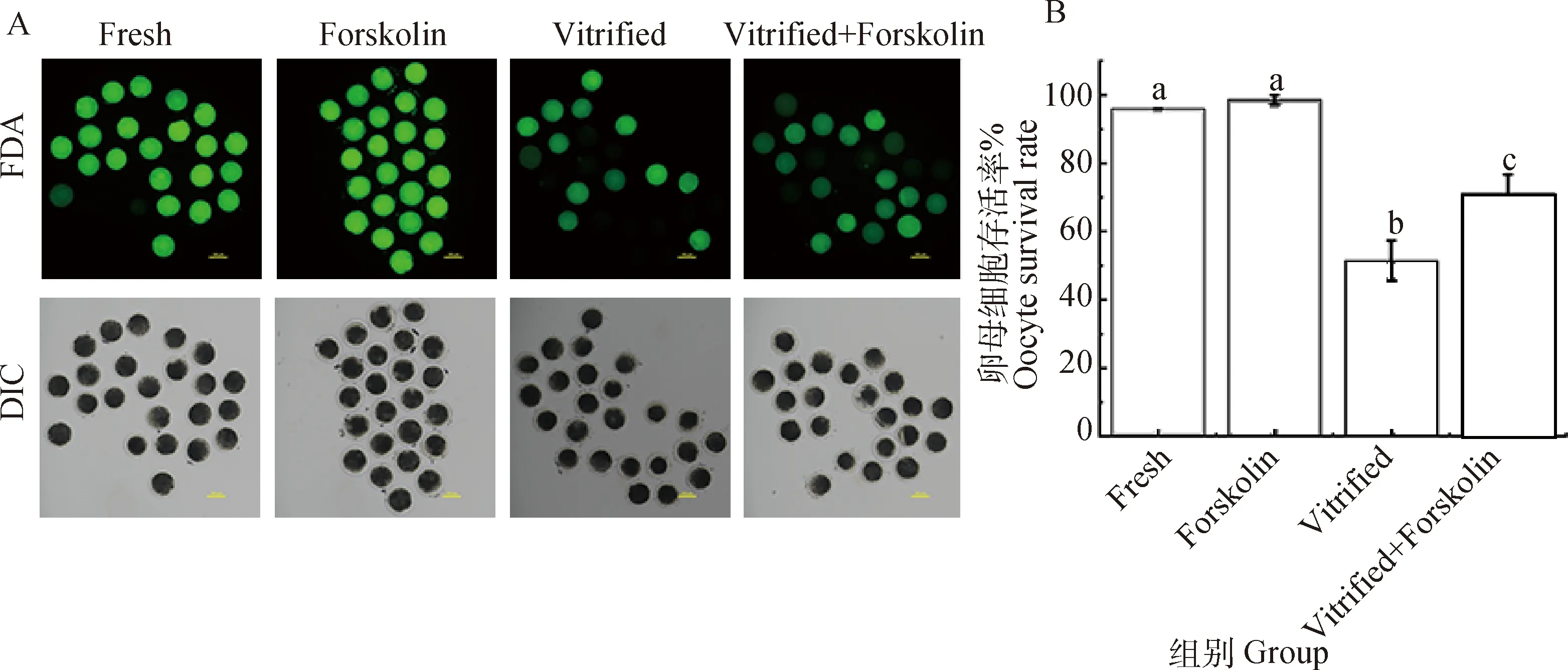
A. FDA染色荧光影像。FDA染色后,具有细胞活性的卵母细胞可被检测到绿色荧光,标尺=100 μm。B. 卵母细胞存活率统计学分析A. Images of FDA staining. After FDA staining, green fluorescence can be detected in living oocytes, Scale bar=100 μm. B. Statistical analysis of oocyte viability图7 卵母细胞存活率检测Fig.7 Determination of oocyte viability
2.8 毛喉素提高猪卵母细胞冷冻体外发育能力
卵母细胞体外发育能力检测结果见图8及表1。结果显示,新鲜卵母细胞中毛喉素处理对卵母细胞的冻前孤雌激活卵裂率(91.37% vs. 86.13%)无显著影响(P>0.05),而在桑椹胚率(62.21% vs. 53.19%)和囊胚率(19.57% vs. 5.05%)上差异显著(P<0.05)。经玻璃化冷冻后,毛喉素处理组的冻后孤雌激活卵裂率由8.23%提高至16.63%(P<0.05),毛喉素处理组的冻后孤雌激活桑椹胚率和囊胚率差异性不显著,但有升高的趋势。表明在成熟培养期间添加毛喉素能上调冷冻后卵母细胞的孤雌激活卵裂及冻前桑椹胚率和囊胚率。
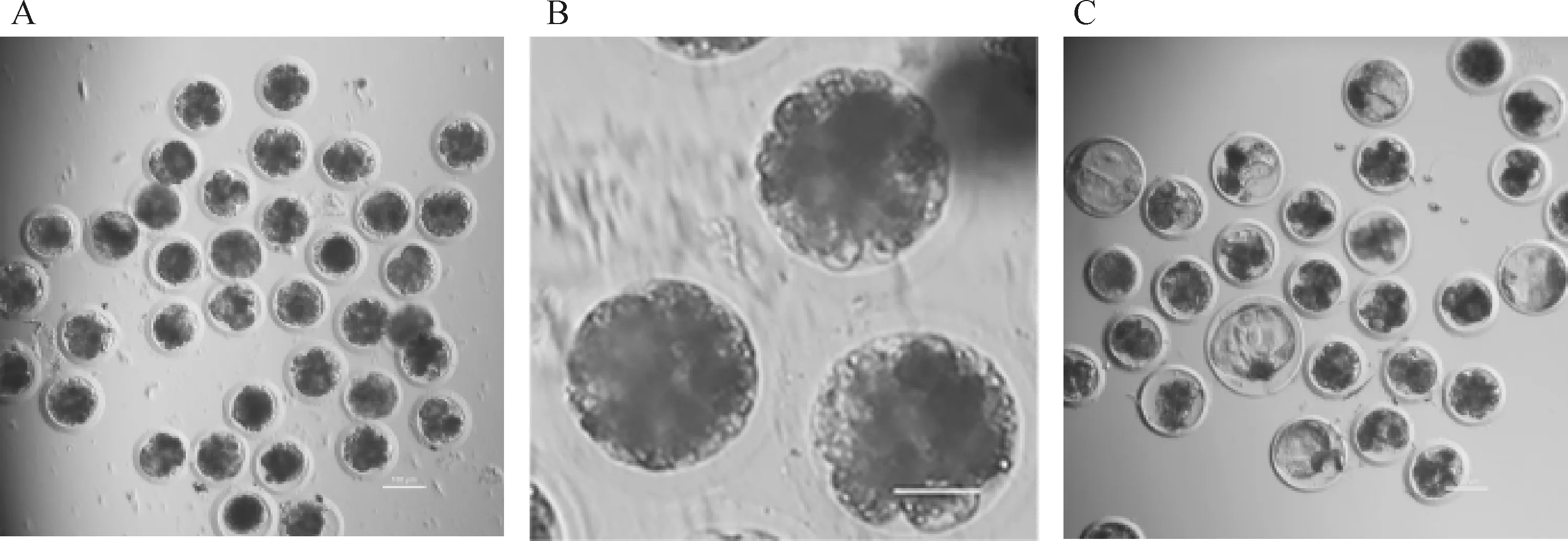
A. 2 d卵裂图,标尺=100 μm。B. 5 d桑椹胚图,标尺=50 μm。C. 7 d囊胚图,标尺=100 μmA. Image of cleavage at 2 d, Scale bar=100 μm. B. Image of morula at 5 d, Scale bar=50 μm. C. Image of blastocyst at 7 d, Scale bar=100 μm图8 卵母细胞发育能力检测Fig.8 Detection of oocyte development ability
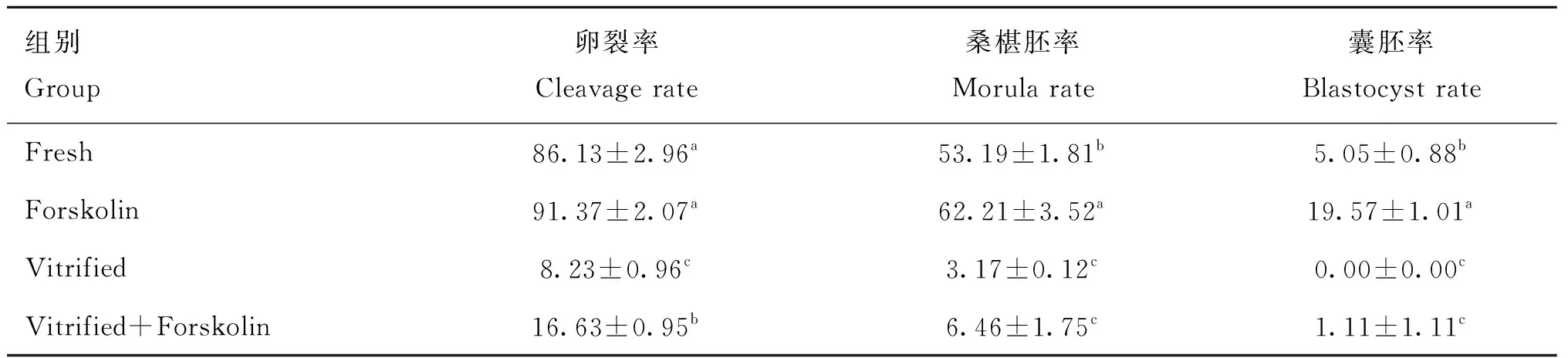
表1 卵母细胞发育能力检测Table 1 Detection of oocyte development ability %
3 讨 论
猪卵母细胞内脂质含量过高,一直被认为是制约猪卵母细胞冷冻效率提高的重要原因。尽管目前冷冻猪卵母细胞复原后可获得存活后代[4-5],但尚不足以推广应用。降脂或去脂已成为提高猪卵母细胞冷冻效率的一个重要途径。毛喉素是一种自毛喉鞘蕊花中分离得到的天然降脂物质,具有促进脂质分解、调节细胞生理进程与新陈代谢的作用。因此推断,在卵母细胞成熟培养过程中添加降脂剂毛喉素可降低卵母细胞内的脂质含量。Prates等[14]研究证实,在体外成熟过程中毛喉素可通过改变脂滴的分布与形态,降低猪卵母细胞内脂质含量。本研究通过在猪卵母细胞体外成熟培养过程中添加10 μmol·L-1毛喉素,极显著降低了成熟卵母细胞中的脂滴数量、大小和面积,降脂效果明显,该结果与上述研究结果相似,再次证实了毛喉素可有效降低猪卵母细胞中的脂肪含量。
毛喉素降脂处理是否会影响卵母细胞成熟和体外发育也是本研究关注的重点。毛喉素是一种引起cAMP升高的腺苷酸环化酶的激动剂,傅国栋等[16]研究发现,成熟前毛喉素短期预处理时能够刺激猪卵母细胞体外成熟,且这种作用是与卵丘细胞的存在有关。本研究显示,成熟过程中全程添加毛喉素可部分提高猪卵母细胞成熟率、线粒体膜电位和体外发育能力、降低氧化应激和早期凋亡率水平,但均与未添加组无显著差异(P>0.05)。两者的研究均证实毛喉素不影响GV期卵母细胞向MII期过渡和成熟卵母细胞质量,说明成熟培养期间添加毛喉素调节脂质含量是安全可行的。
由于体积较大,在玻璃化冷冻过程中,猪卵母细胞不可避免地会受到高浓度冷冻保护剂的渗透压和毒性损伤,同时冷冻和解冻过程中温度的剧烈变化,还会导致卵母细胞内多种细胞器的超微结构变化。研究表明,猪卵母细胞中的脂肪酸含量远高于牛、羊等,且这种高的脂肪酸含量主要归之于丰富的甘油三磷脂储量,且其他不饱和脂肪酸储量的种属特异性差异可成为比较猪和反刍动物(牛、羊)卵母细胞冷冻敏感性的基础[17]。Isachenko等[18]报道,猪卵母细胞内含有均质性和非均质性两种形态的脂滴,且均质性脂滴可在低温条件下转化为非均质性脂滴。本研究发现,脂滴在一定条件下会转化为卵母细胞在冷冻-解冻过程所需的能量,对维持卵母细胞生物学功能有一定作用。在此过程中大脂滴会被消耗及分解成小脂滴,小脂滴又会被消耗,是最终造成脂滴数量减少和脂滴相对面积降低的主要原因。同时在冷冻-解冻时细胞内的均质脂滴部分转化为非均质脂滴,还有部分脂滴发生溶解,导致玻璃化冷冻后超微结构内的空泡化加剧,进而造成玻璃化冷冻后猪卵母细胞内的非均质脂滴数量远远多于冻前的均质脂滴和非均质脂滴。该结果与薛梦琦等[19]、武彩红等[20]、王勇杰等[21]在猪冷冻卵母细胞上的研究结果相似。本研究超微结构观察也发现,经毛喉素处理后,无论是新鲜还是冷冻卵母细胞,非均质脂滴所占比例均进一步提高,提示这种脂滴成分的变化可能是毛喉素提高猪卵母细胞抗冻能力的重要因素之一。
细胞内线粒体作为最重要的细胞器之一,与胞内能量供应、细胞呼吸、氧的代谢等有着十分密切的关系,冻后线粒体损伤将引起细胞氧化损伤、凋亡和发育能力下降[22]。本研究还发现,冷冻后出现部分线粒体固缩、线粒体嵴模糊或消失等现象,这与众多研究结果一致[23-24],同时,线粒体在凋亡信号的诱导下,发生膜电位的降低,随之线粒体膜通透性转换孔开放[25]。本研究也证实,玻璃化冷冻后的线粒体膜电位显著降低;与此同时,与冷冻卵母细胞相比,在体外成熟培养期间添加毛喉素处理可极显著上调冷冻卵母细胞线粒体膜电位。可能的原因是卵母细胞在冷冻前的去脂处理,导致冷冻时水分置换更充分,冰晶形成减少,减轻了线粒体受到的机械性损伤,证实了毛喉素能在一定程度上维持冷冻后线粒体稳态,保证了线粒体功能正常。ROS主要由线粒体合成并释放。冷冻引起的线粒体去极化通过改变卵母细胞中几种氧化还原途径而导致ROS的生成增加[26],本研究也证实了卵母细胞冷冻时线粒体发生去极化使这期间胞内平衡失调,导致正常的线粒体功能受到破坏,线粒体过量释放的活性氧造成卵母细胞氧化应激,从而诱发细胞凋亡。细胞早期凋亡的现象是磷酯酰丝氨酸外翻,正常情况下其分布于细胞膜内侧,本研究中卵母细胞冷冻后显著性地诱导早期凋亡,出现了大量磷酯酰丝氨酸外翻现象;与冷冻卵母细胞相比,成熟培养期毛喉素处理极显著的抑制冻后卵母细胞早期凋亡。凋亡是引起细胞程序性死亡的主要途径之一,被认为是冷冻保存失败,冷冻效率低下的直接原因[27-28]。毛喉素通过保护线粒体稳态、防止氧化应激,有效减轻了冻后早期凋亡的发生,这可能是毛喉素提升冷冻效率的关键原因。
本研究证实了通过非侵入式降脂法(降脂剂毛喉素)可有效降低猪卵母细胞内的脂质含量,改善了因冷冻保护剂对水分的不充分置换引起的冻后线粒体机械性损伤,降低了氧化应激与凋亡的发生,从而显著提升冷冻效率。本研究为化学降脂剂毛喉素在猪卵母细胞冷冻中的应用提供了理论和现实依据。
4 结 论
4.1猪卵母细胞体外成熟培养期间添加毛喉素可降低其胞内脂质含量。
4.2体外成熟培养期间添加毛喉素可减轻冷冻卵母细胞氧化应激与早期凋亡。
4.3体外成熟培养期间添加毛喉素可提升冷冻卵母细胞的存活率和发育潜能。

