贝伐珠单抗联合紫杉醇对转移性乳腺癌患者免疫功能的影响
周新华 熊 迎 邱 平 付晶晶
乳腺癌占女性恶性肿瘤的首位,主要是指在多种致癌因子的影响下,导致乳腺上皮细胞增殖失控,早期以乳房肿块、乳头溢液及腋窝淋巴结肿大等症状为主,晚期则会发生远处转移,引起多器官病变,威胁患者生命安全[1]。目前,临床针对乳腺癌多采用化疗方式治疗,虽可缓解症状表现,但长期使用的有效率仅可控制在45%左右。近年来,随着研究的深入,越来越多的研究发现,通过靶向药物治疗可进一步延长乳腺癌患者的生存期,提升预后质量[2]。紫杉醇是临床公认的高效、广谱的天然抗癌药物,可诱导多种癌细胞凋亡。贝伐珠单抗为单克隆抗体,可特异性地与血管内皮生长因子(VEGF)结合,减少VEGF与其受体的结合,从而抑制肿瘤血管形成[3-4]。目前,临床对于贝伐珠单抗与紫杉醇在临床诸多癌症疾病中的治疗效果均有所报道,但联合治疗对转移性乳腺癌患者免疫功能的影响缺乏相关报道[5]。鉴于此,本研究就贝伐珠单抗联合紫杉醇对转移性乳腺癌患者免疫功能的影响进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2022年4月南昌市第三医院收治的100例转移性乳腺癌患者作为研究对象,按随机数字表法分为对照组与观察组,各50例。对照组年龄45~75岁,平均(59.07±4.25)岁;病程1~9年,平均(4.20±1.17)年;病理TNM分期:Ⅲa、Ⅲb、Ⅳ期分别为18例、23例、9例;文化程度:小学、初中及高中分别为6例、32例、12例。观察组年龄43~78岁,平均(59.49±4.75)岁;病程2~8年,平均(4.32±1.15)年;病理TNM分期:Ⅲa、Ⅲb、Ⅳ期分别为15例、25例、10例;文化程度:小学、初中及高中分别为8例、33例、9例。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。
1.2 纳入与排除标准
纳入标准:1)符合乳腺癌相关诊断标准[6],且经实验室、影像学等检查确诊为转移性者;2)TNM分期为Ⅲ~Ⅳ期;3)预计生存期>6个月;4)签署了知情同意书。排除标准:1)其他恶性肿瘤;2)心、肝、肾等脏器功能不全;3)免疫功能障碍;4)对本研究药物过敏;5)近期已接受放化疗治疗。
1.3 治疗方法
对照组给予紫杉醇注射液(四川汇宇制药股份有限公司,国药准字H20203702,规格:5 ml∶30 mg)治疗,于第1天静脉滴注170 mg/m2,1次/d。
观察组在对照组基础上联合贝伐珠单抗(Roche Diagnostics GmbH,德国,注册证号:S20170035,规格:100 mg∶4 ml)治疗,15 mg/kg贝伐珠单抗溶于0.9%氯化钠注射液100 ml中静脉滴注,1次/d。两组均以21 d为一个周期,治疗4个周期。
1.4 观察指标
1)疗效判定标准:病灶完全消失,且维持≥4周视为完全缓解(CR);病灶最长径总和缩小≥30%,且维持≥4周视为部分缓解(PR);未达到PR或PD标准视为疾病稳定(SD);病灶最长径总和增加≥20%视为疾病进展(PD)。疾病控制率(DCR)=(CR例数+PR例数+SD例数)/总例数×100%。2)血清肿瘤标志物:于治疗前后收集两组患者空腹静脉血10 ml,离心10 min(转速为3 000 r/min,半径为6 cm),取上层血清采用电化学发光法检测癌胚抗原(CEA)、糖类抗原125(CA125)、细胞角蛋白19片段(CYFRA21-1)水平。3)免疫功能:采用超高速流式细胞仪行间接免疫荧光法检测免疫功能相关指标,包括骨髓源性抑制细胞(MDSCs)、调节性T细胞(Tregs)、CD3+、CD4+、CD8+,并计算CD4+/CD8+。4)不良反应:统计两组骨髓抑制、肝功能受损、胃肠道反应等发生情况。
1.5 统计学分析
采用SPSS 23.0统计软件进行数据分析,计数资料以百分率表示,组间比较采用χ2检验,计量资料以±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
观察组DCR高于对照组,差异有统计学意义(P<0.05)。见表1。
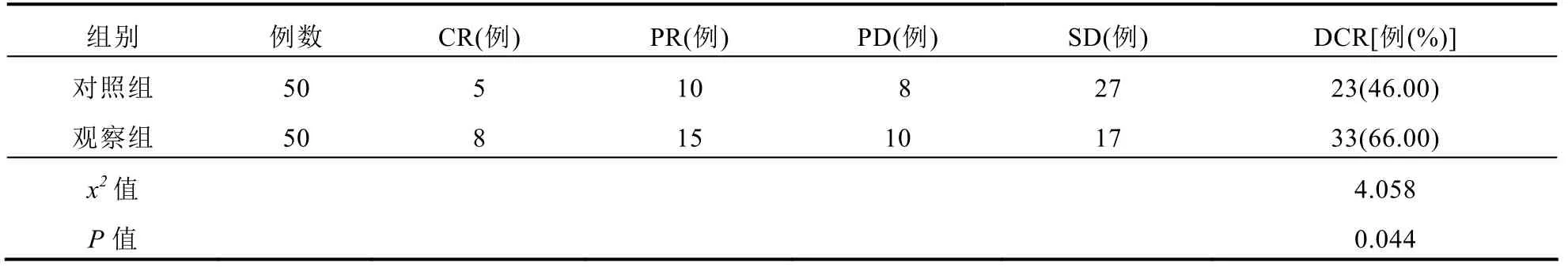
表1 两组患者临床疗效比较
2.2 肿瘤标志物
两组治疗前CEA、CA125及CYFRA21-1水平比较差异无统计学意义(P>0.05);治疗后观察组CEA、CA125及CYFRA21-1水平低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者肿瘤标志物比较(±s)
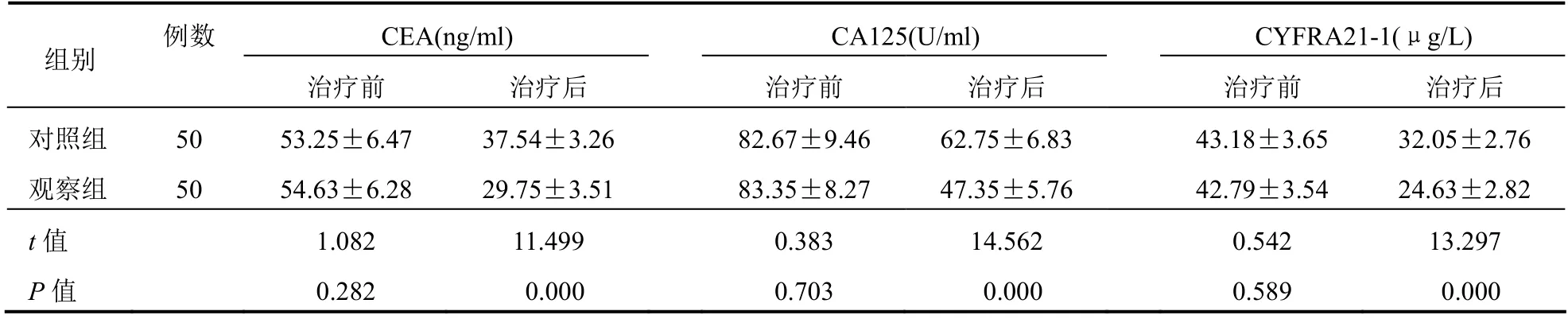
表2 两组患者肿瘤标志物比较(±s)
组别 例数CEA(ng/ml) CA125(U/ml) CYFRA21-1(μg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 50 53.25±6.47 37.54±3.26 82.67±9.46 62.75±6.83 43.18±3.65 32.05±2.76观察组 50 54.63±6.28 29.75±3.51 83.35±8.27 47.35±5.76 42.79±3.54 24.63±2.82 t值 1.082 11.499 0.383 14.562 0.542 13.297 P值 0.282 0.000 0.703 0.000 0.589 0.000
2.3 免疫功能
两组治疗前CD3+、CD4+、CD8+、CD4+/CD8+、MDSCs、Tregs水平比较差异无统计学意义(P>0.05);治疗后观察组CD3+、CD4+高于对照组,CD8+、MDSCs、Tregs低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者免疫功能比较(%,±s)
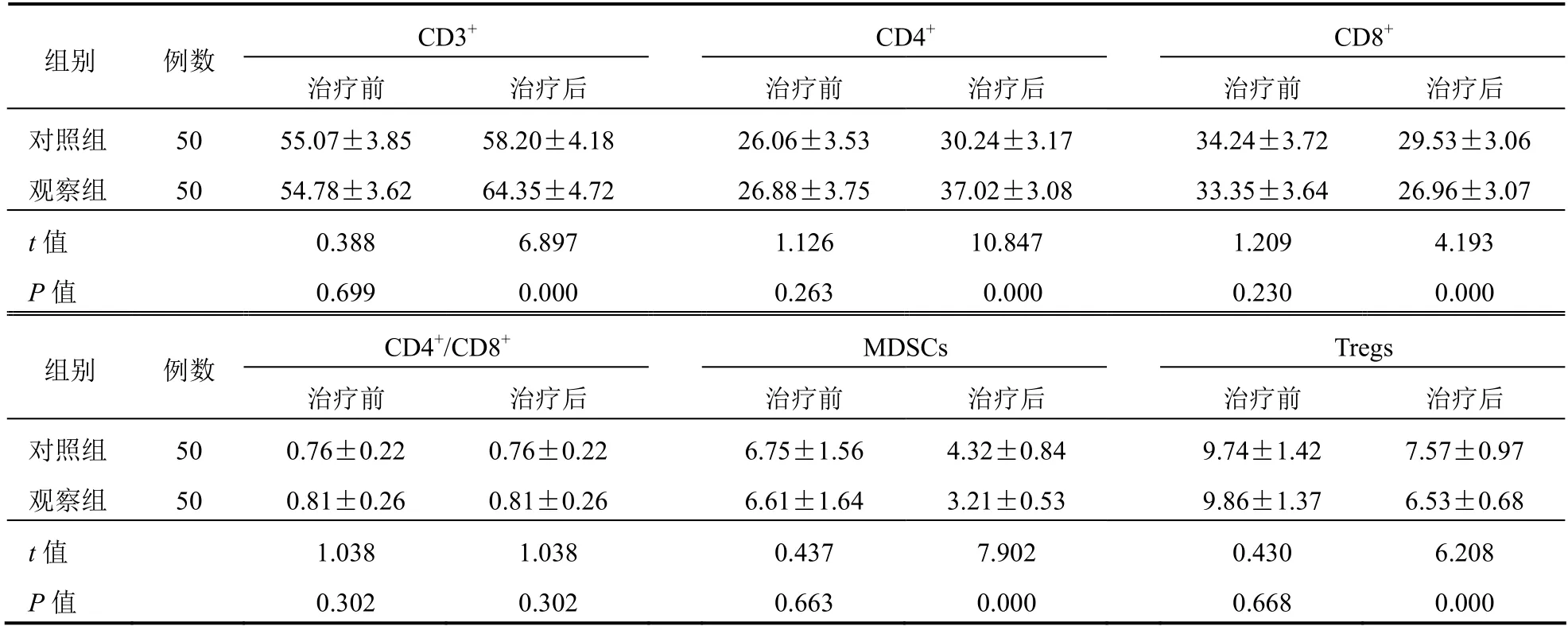
表3 两组患者免疫功能比较(%,±s)
组别 例数CD3+ CD4+ CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 50 55.07±3.85 58.20±4.18 26.06±3.53 30.24±3.17 34.24±3.72 29.53±3.06观察组 50 54.78±3.62 64.35±4.72 26.88±3.75 37.02±3.08 33.35±3.64 26.96±3.07 t值 0.388 6.897 1.126 10.847 1.209 4.193 P值 0.699 0.000 0.263 0.000 0.230 0.000 CD4+/CD8+ MDSCs Tregs 组别 例数治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 50 0.76±0.22 0.76±0.22 6.75±1.56 4.32±0.84 9.74±1.42 7.57±0.97观察组 50 0.81±0.26 0.81±0.26 6.61±1.64 3.21±0.53 9.86±1.37 6.53±0.68 t值 1.038 1.038 0.437 7.902 0.430 6.208 P值 0.302 0.302 0.663 0.000 0.668 0.000
2.4 不良反应
两组不良反应发生率比较,差异无统计学意义(P>0.05)。见表4。
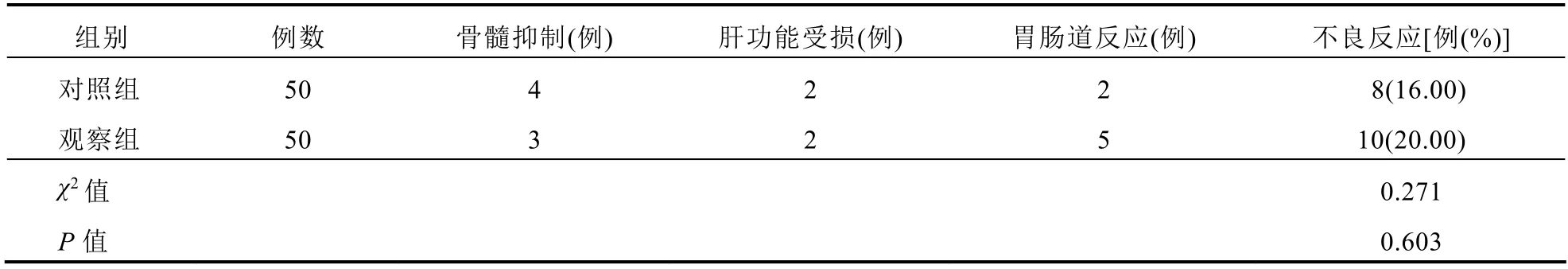
表4 两组患者不良反应比较
3 讨论
根据国际癌症研究机构(IARC)的调查研究显示,乳腺癌在全球女性癌症的发病率中占24.2%,位居女性癌症首位[7]。目前,乳腺癌的病因尚未完全明确,多认为与月经初潮年龄早、绝经年龄晚、雌酮及雌二醇等激素密切相关。乳腺癌病情发展至晚期,癌组织会浸润胸壁,肿瘤细胞发生蔓延及转移,严重威胁患者生命安全。近年来,随着医疗水平的不断提高,乳腺癌已成为目前疗效最佳的实体瘤之一,但通过常规化疗方案治疗仅可缓解临床症状,控制疾病的进展,无法有效提高生存率。
靶向与免疫治疗是目前临床应用较多的治疗方式,可有效延长癌症患者生存时间[8]。CEA是具有人类胚胎抗原特性的酸性糖蛋白,存在于内胚层细胞分化而来的癌症细胞表面,在乳腺癌、肺癌及其他恶性肿瘤患者的血清中有所升高;CA125是一种不均一的黏蛋白样糖蛋白,通常作为卵巢上皮癌的肿瘤标志物,在乳腺癌中也呈异常升高;CYFRA21-1是非小细胞肺癌的首选肿瘤标志物,存在于血浆、胸腔积液和腹水中,其在乳腺癌、宫颈癌等诸多肿瘤中也具有一定的阳性率。本研究结果显示,观察组DCR高于对照组;治疗后观察组CEA、CA125及CYFRA21-1水平低于对照组。提示贝伐珠单抗与紫杉醇联合可降低肿瘤标志物水平,提高转移性乳腺癌的治疗效果,且安全性良好。分析原因:实体肿瘤的生长依赖于新血管的生成,贝伐珠单抗是一种单克隆抗体,作为抗血管生成药物,可特异性与VEGF结合,抑制VEGF与受体的结合,阻断血管生成的信号传导途径,减少肿瘤组织的血流量,从而抑制肿瘤新生血管的形成,抑制转移灶进展,发挥抗肿瘤的作用。紫杉醇是一种从天然植物红豆杉属树皮中提取的二萜生物碱类化合物,具有高效、低毒、广谱性的特点,可通过抑制有丝分裂,从而抑制癌细胞的增殖。贝伐珠单抗与紫杉醇联合应用,可改善异常血管微环境,使天然抗癌药物顺利抵达病灶,在提高临床疗效的同时具有较高的安全性[9]。已有诸多研究表明,在肿瘤发生与发展的过程中会释放激素、抗原等物质,这些物质可能是肿瘤细胞内的代谢产物,与疾病的筛查、鉴别诊断、预后评估等密切相关[10]。本研究结果显示,治疗后观察组CD3+、CD4+高于对照组,CD8+、MDSCs、Tregs低于对照组。表明贝伐珠单抗联合紫杉醇可提高免疫功能。CD3+、CD4+、CD4+/CD8+是反映成熟T淋巴细胞和细胞毒性T细胞增殖水平的指标,淋巴细胞主要负责细胞免疫,具有抵抗病毒和调节机体免疫系统功能的作用。Tregs细胞是CD4+T细胞的一个亚群,是维持机体免疫耐受的重要因素之一,其免疫调节特性能抑制存在于正常机体内潜在的自身反应性T细胞的活化与增殖,阻断抗肿瘤免疫反应,在癌症中会促进肿瘤的进展。MDSCs来源于造血干细胞的未成熟髓系细胞,可以制造免疫抑制微环境,帮助肿瘤细胞逃避免疫监视,病理状态下,机体中骨髓细胞进入异常状态并激活其免疫抑制功能,从而导致MDSCs增殖[11]。此外,MDSCs可以与转移性乳腺癌癌细胞相互作用,通过抑制T细胞、NK细胞功能等方式继续构建免疫抑制微环境,分化为破骨细胞,加速溶骨性破坏,重构细胞外基质,刺激间质向上皮细胞转化,支持转移性生长。紫杉醇是一种细胞周期特异性化疗药物,能有效促进微管的聚集、再生,从而促进肿瘤细胞凋亡。贝伐珠单抗可诱导树突状细胞的成熟,促进T细胞活化,通过逆转VEGF介导的免疫抑制作用,提高T细胞的肿瘤杀伤作用,从而提高免疫功能[12]。另外,贝伐珠单抗还可通过抑制肿瘤新生血管生成,导致肿瘤细胞因缺乏必要的营养物质而凋亡[13]。两者联用能有效提高肿瘤免疫治疗的效果。谭越等[14]对80例晚期乳腺癌患者给予单用紫杉醇与联合贝伐珠单抗的对比研究中发现,联合贝伐珠单抗治疗的疗效明显提升,且可改善患者的免疫功能,降低肿瘤标志物水平,与本研究结果一致。
综上所述,贝伐珠单抗联合紫杉醇治疗转移性乳腺癌疗效确切,可降低肿瘤标志物的表达,提高免疫功能,且未增加不良反应。

