不同免疫状态下细菌性肝脓肿患者临床特点与预后影响因素
杨惠安,原津津,俞晓玲,官升灿,韩荔芬
(福建医科大学孟超肝胆医院 1. 感染科, 2. 药学部,福建 福州 350025)
细菌性肝脓肿(pyogenic liver abscess,PLA)是常见的腹腔内感染局灶性疾病,严重者常导致脓毒性休克、多器官功能衰竭。PLA在亚洲国家发病率较高,每10万人中约有12~18例患者[1],发达国家近年研究报道其病死率为2.6%~9.6%[2-4]。PLA是不明原因发热患者的重要诊断之一,症状非特异,包括发热、右上腹痛、呕吐、恶心和虚弱。PLA感染控制不佳可导致脓毒症、多器官功能障碍乃至死亡,因此,准确诊断PLA并进行合理治疗和管理是一项重大医学挑战[5]。近年来,社会发展变化快,人口老龄化严重,人口流动性大,器官移植、糖尿病、恶性肿瘤、艾滋病等免疫功能低下患者数量增多[6],PLA的病因、致病菌和临床特点随之变化,给临床诊治工作带来新的挑战。目前,免疫功能低下人群并发PLA的相关研究较少,本研究回顾性分析近4年福建医科大学孟超肝胆医院收治的104例PLA患者的临床资料,总结临床特点,分析预后相关危险因素,有助于了解不同免疫功能状态下PLA疾病变化情况,为临床诊治提供参考。
1 对象与方法
1.1 研究对象 筛选2017年11月—2021年11月该院收治的PLA患者,PLA诊断参照相关专家共识[7]。纳入标准:(1)年龄≥18周岁;(2)住院时间≥24 h;(3)确诊为PLA。排除标准:(1)结核性及阿米巴性肝脓肿;(2)临床资料不完整;(3)非初次确诊。本研究经过医院伦理委员会批准。
1.2 研究方法
1.2.1 资料收集 收集患者的一般资料:年龄、性别、既往病史、大量饮酒史(发病前2周内饮酒量大,折合乙醇量>80 g/d[8])、临床表现、入院24 h内首次获得的基线实验室检查[包括白细胞计数、中性粒细胞比例、血红蛋白、血小板计数、C反应蛋白、降钙素原、丙氨酸氨基转移酶(ALT)、天门氨酸氨基转移酶(AST)、总胆红素、血清清蛋白、肌酐]、影像学检查、肝脓液/血病原微生物培养结果、治疗方式、治疗结果、并发症、住院日数、住院死亡等。于入院首日根据标准:收缩压(SBP)≤100 mmHg、呼吸频率(RR)≥22 次/min及格拉斯哥昏迷评分(GCS)<13分,每项各计1分,计算快速序贯器官衰竭(qSOFA)评分(≥2分或<2分)。血或脓液培养确认病原微生物,并进行药敏试验。先根据病情经验性使用抗菌药物:肝脓肿严重感染患者如继发脓毒性休克,使用碳青霉烯类如美罗培南;对轻/中度感染肝脓肿患者常选用β-内酰胺酶类/β-内酰胺酶抑制剂、头孢菌素第三代或联合硝基咪唑类等[9],后根据药敏结果调整抗感染治疗方案。耐药菌指对三种或更多不同类别抗菌药物不敏感的多重耐药(MDR)菌株[10],包括产超广谱β-内酰胺酶(ESBLs)细菌、耐碳青霉烯类肠杆菌目细菌等。
1.2.2 研究分组 根据免疫功能正常与否将患者分成免疫正常组和免疫低下组,分析比较两组的临床特点;根据治疗后疾病转归分为预后良好组(治疗有效组)和预后不良组(治疗无效组),对治疗干预后所致疾病转归进行影响因素分析。
免疫功能低下患者的定义参考最新国外相关指南[11]:(1)人类免疫缺陷病毒(HIV)感染/获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)患者;(2)血液系统恶性肿瘤患者;(3)实体恶性肿瘤患者且接受过正规化学治疗;(4)接受异基因造血干细胞移植或实体器官移植患者;(5)免疫风湿性疾病患者;(6)糖尿病患者;(7)尿毒症患者;(8)行脾切除术患者;(9)长期全身使用肾上腺糖皮质激素的患者,尤其是强的松超过20 mg/d(≥2周)或入院前两周内使用糖皮质激素冲击治疗的患者;(10)中性粒细胞计数<1.00×109/L患者;(11)原发性免疫缺陷病患者,包括经基因确诊的先天性疾病(T细胞或B细胞缺陷,巨噬菌体功能障碍)。
疾病转归判断标准:(1)治疗结果有效,包括症状、体征好转或消失,脓肿缩小或消失;(2)治疗结果无效,包括症状、体征无变化或加重,脓腔无改变、增大,死亡和复发(出院后90 d内再次出现发热等临床症状,伴脓肿变大或新发脓肿形成)。

2 结果
2.1 研究对象人口统计学和基线临床特征 104例病例中,男性71例(68.3%),女性33例(31.7%),男女比例为2.2∶1,平均年龄(56.2±12.2)岁。免疫正常组70例(67.3%),免疫低下组34例(32.7%),包括:17例糖尿病患者,病程>2年,入院糖化血红蛋白均≥7.5%;9例AIDS患者,均确诊艾滋病,入院外周血CD4+T淋巴细胞计数<200个/μL,或既往伴有至少一种艾滋病指征性疾病;肝脏移植术后、原发性肝癌放射治疗和化学治疗及术后、脾切除术后患者各2例,病史均超过1年;非霍奇金淋巴瘤、急性淋巴细胞白血病患者各1例,均接受过放射治疗和化学治疗。
两组间性别、年龄、基础疾病、大量饮酒史、qSOFA评分≥2分分布比较,差异无统计学意义(均P>0.05),免疫低下组住院日数较免疫正常组延长(P<0.05)。临床最常见症状依次为发热、右上腹痛、胃肠不适,两组患者临床症状比较,差异无统计学意义(均P>0.05);实验室指标中,免疫低下组患者血清降钙素原较高、血清清蛋白较低(均P<0.05),白细胞计数、血红蛋白、血小板计数、C反应蛋白水平等其他指标比较,差异均无统计学意义(均P>0.05)。见表1。

表1 免疫低下组与免疫正常组PLA患者人口统计学和基线临床特征比较

续表1 (Table 1, Continued)
2.2 病原微生物和影像学检查结果 血、肝脓液培养各送检104及60份,其中血培养阳性率15.4%(16份),脓液培养阳性率68.3%(41份),6例患者血、脓液培养结果一致且均为单一致病菌,不重复统计,故共49.0%(51份)的患者病原学培养结果呈阳性,其中2例为复数菌感染(1例为大肠埃希菌与屎肠球菌,1例为表皮葡萄球菌与肺炎克雷伯菌)。血培养检出1株凝固酶阴性葡萄球菌,考虑为污染菌,未纳入结果。检出居前2位的病原菌依次是肺炎克雷伯菌、大肠埃希菌,其患者各占30.8%(32份)、7.7%(8份),其中感染ESBLs的肺炎克雷伯菌和大肠埃希菌的患者分别是2、4例,未检出耐碳青霉烯类病原菌。免疫低下组和免疫正常组病原菌、大肠埃希菌、耐药菌阳性率差异均无统计学意义(P>0.05);肺炎克雷伯菌检出率在免疫低下组(84.2%)中更高,差异有统计学意义(P<0.05)。影像学特征比较,两组组间差异均无统计学意义(P>0.05)。见表2。

表2 免疫低下组与免疫正常组PLA患者病原学、影像学比较[例(%)]
2.3 并发症、治疗与转归 在并发症(胸腔积液、肺炎、脓肿远处转移、脓毒性休克)发生率和治疗方式方面,两组患者差异均无统计学意义(均P>0.05)。住院病死率为4.81%(5/104),两组入住重症监护室、住院病死率差异均无统计学意义(P>0.05)。见表3。治疗预后良好(临床治愈和好转)患者共90例(86.5%),预后不良(治疗无效)患者共14例(13.5%),包括复发(4例)、脓肿较前增大(3例)、昏迷自动出院(2例)和死亡(5例)。免疫低下组和免疫正常组患者不良预后率分别为26.5%(9例)、7.1%(5例),差异有统计学意义(P<0.05)。

表3 免疫低下组与免疫正常组PLA患者的并发症、治疗及转归比较[例(%)]
2.4 预后分析 以预后不良为因变量(赋值:阳性=1,阴性=0),纳入表4单因素分析中P<0.05的指标,使用二元logistic回归分析筛选最终危险因素。结果表明,脓肿的最大直径≥10 cm、免疫功能低下、继发脓毒性休克并发症是患者预后不良(治疗无效)的独立危险因素(均P<0.05),见表5。
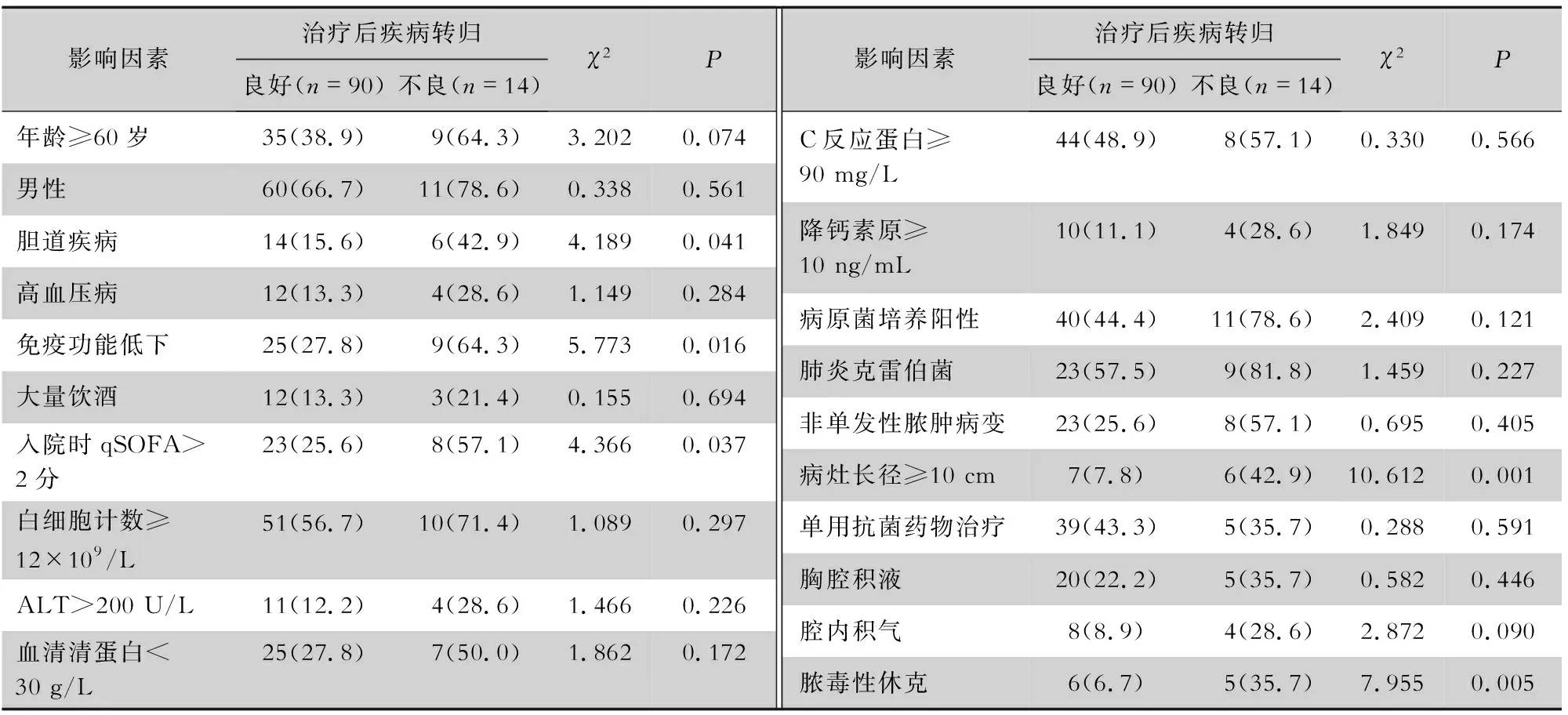
表4 PLA患者预后不良的单因素分析[例(%)]

表5 PLA患者预后不良的多因素logistic回归分析
3 讨论
PLA是腹腔脏器中常见的脓肿类型,在肝脓肿中占80%,近年来发病率逐年上升。越来越多的PLA患者合并糖尿病,且糖尿病、恶性肿瘤、肝移植状态等免疫功能低下患者与PLA发病密切相关[3,7]。本研究根据最新免疫功能低下人群相关指南中的定义,在考虑患者是否合并免疫功能低下基础疾病的基础上,回顾PLA临床资料,首次评价不同基础免疫状态下PLA患者的临床特征差异,分析PLA治疗不良预后的影响因素,有助于全面了解不同免疫功能状态下PLA的变化,对临床诊治决策有重要意义。
高龄、男性、高血压和胆道疾病被视为PLA发病的危险因素[7,12],本研究涵盖了存在这些危险因素的个体,结果显示,免疫低下组与免疫正常组患者在年龄、性别、高血压病和胆道疾病等基础疾病方面没有差异,提示这些潜在危险因素与PLA患者的免疫功能差异并不相关。相较免疫正常患者,免疫功能低下的PLA患者血清降钙素原水平显著升高、营养监测指标白蛋白显著下降、住院日数显著延长(均P<0.05),与相关报道[13]一致,提示免疫功能低下基础病合并PLA患者感染重、营养差、住院时间延长。PLA临床表现缺乏特异性,本研究中,PLA最常见症状依次为发热、右上腹痛、胃肠不适,两组间临床表现没有显著差异。由于免疫缺损程度及易感病原体类型不同,两组患者机体对脓肿炎性反应、免疫应答强度也不同,免疫功能低下患者存在C反应蛋白偏低、白细胞计数偏低、肝功能受损较轻等情况[14]。
PLA分离的病原微生物存在地域差异,欧美发达地区多见大肠埃希菌,东亚地区如韩国、中国以肺炎克雷伯菌为主[7]。本研究中,肺炎克雷伯菌感染数量最多,其次是大肠埃希菌,与既往报道[12-13]类似。PLA耐药菌检出率低,为5.8%(6/104),略低于韩国学者报道[15]的6.6%(55/833),且主要病原体肺炎克雷伯菌仍对大多数抗菌药物敏感。然而,大肠埃希菌ESBLs阳性率达50.0%(4/8),稍高于CHINET的监测报道[16]。免疫功能低下组肺炎克雷伯菌检出率显著偏高(P<0.05),提示该组患者对肺炎克雷伯菌有易感倾向,可能与其免疫细胞功能缺陷、血管内膜异常、高糖环境利于细菌繁殖而造成肺炎克雷伯菌隐源性感染或血流播散感染有关,结果与既往研究[13,14]类似。本研究显示,病原学培养阳性检出率、大肠埃希菌检出率、耐药菌感染没有因免疫功能差异而不同;脓肿位置、数量和分隔情况的组间比较,差异无统计学意义。由于医学技术的进步,使用有效抗菌药物并联合超声引导的经皮引流已经成为主要治疗策略。本研究中,两组不同免疫状态下PLA的治疗方式均以抗菌药物联合局部引流或手术为主,治疗方式未见明显差异,且组间住院病死率无差异,住院总病死率为4.8%(5例)。因医疗环境不同,国内学者研究报告PLA病死率为1.3%~19.4%[5,17],而韩国学者报道[15]PLA总住院病死率为4.1%(34/833)。制定治疗方案时全面考虑患者脓肿病灶大小、基础免疫状态对降低病死率十分必要。本研究进一步发现,脓肿内积气占11.5%(12例),略高于既往报道[5]的9.6%,可能与机体高糖环境或免疫状态低下利于产气病原体繁殖有关[18]。由于免疫功能低下合并PLA患者临床表现缺乏特异性,如影像学检查发现有脓肿内积气表现,应警惕合并PLA可能。
免疫功能异常可影响脓毒症患者预后,免疫低下的患者预后较差[19]。既往研究[2,4,12,17]显示,合并症(糖尿病、恶性肿瘤)、年龄、女性、肝脓肿最大直径、肝脏手术病史与PLA预后不良有关;本研究表明,潜在的免疫功能低下基础疾病、较大的脓肿长径(最大直径)、继发脓毒性休克是治疗后疾病转归不良预后(治疗无效)相关的独立危险因素,但未发现与年龄及性别相关。值得注意的是,免疫功能低下患者感染重、营养状态差,可能对脓肿邻近环境产生不利影响,使全身状况恶化,导致治疗无效或死亡。目前的治疗策略应考虑尽快控制免疫功能低下患者基础病病情,提高机体免疫力,强调使用抗菌药物控制病情。
本研究存在一定局限性。首先,以单个中心进行的回顾性研究可能会增加选择和信息偏差,组间的不同基线特征可能会影响结果;其次,受实验室病原学检测手段限制,病原菌相关数据不充分,如没有报告主要病原体hvKp菌株数据,需要进行毒力测定。最后,作为区域性研究,受就诊人群结构影响,研究对象未能完全覆盖指南列出的所有免疫功能低下人群,若需获得更好的预后评估还有待进行大规模的前瞻性多中心研究。
综上所述,不同免疫功能状态下PLA的流行病学和临床特点存在一定差异,免疫功能低下合并PLA患者感染重、营养差、住院时间延长,情况更复杂,且合并免疫功能低下基础病、脓毒性休克、脓肿的最大长径≥10 cm是PLA预后不良危险因素,故制定治疗方案时应考虑患者的基础免疫状态,制定积极治疗策略,重点监测免疫功能低下的特殊人群。
利益冲突:所有作者均声明不存在利益冲突。

