DSAZn与槲皮素的配位结合及对槲皮素的高灵敏度检测
翟艳珂,潘宜杏,向 浩,徐 黎*,朱泽策,雷 咪
1.湖北中医药大学药学院,湖北 武汉 430072 2.武汉纺织大学化学与化工学院,湖北 武汉 430200
引 言
槲皮素(Quercetin)是最常见的一种生物活性的类黄酮化合物,难溶于水,具有抗炎、降血压、免疫抑制、抗肿瘤、抗血小板聚集和心血管保护等多种药理作用[1]。目前,槲皮素的检测方法包括高效液相色谱法[2]、毛细管电泳-电化学[3]和荧光法[4]等,其中荧光法具有快速响应和操作简单等优势。胡玉斐等采用印迹技术制备了一种槲皮素-AI(Ⅲ)聚合物修饰膜(CIP膜),槲皮素可粘附在CIP膜上,通过记录CIP膜固体表面的荧光光谱对槲皮素进行检测,当存在芦丁等结构相似的药物分子时,CIP膜对槲皮素有选择性,检测限为5 μg·L-1[5]。Wang等合成了具有稳定双发射荧光的硫氮共掺碳纳米带(SNCNRs),向SNCNRs的PBS缓冲溶液中加入不同浓度的槲皮素,槲皮素和SNCNRs之间的电子相互作用使它们形成非荧光类配合物,基于光诱导电子/能量转移或内滤效应荧光猝灭机制,实现对槲皮素的检测,在金属离子存在时,SNCNRs对槲皮素具有选择性,检测限为21.13 nmol·L-1[6]。Sachin Kadian等合成硫掺杂石墨烯量子点(SGQDs),槲皮素和SGQDs形成非荧光基态络合物,通过内滤效应猝灭SGQDs的荧光,实现对红酒样品中槲皮素的检测,该荧光探针在芹菜素等化学结构类似的黄酮类化合物存在时也显示出对槲皮素的选择性,检测限为0.006 μg·mL-1[7]。
槲皮素分子结构具有较高的超离域度、完整的大π键共轭体系、强配位氧原子与合适的空间构型,可与金属离子螯合成稳定的环状配合物[8-9]。如图1所示,槲皮素分子结构中的1个羰基和5个羟基都能提供孤电子对,具有很强的配位能力。在中性介质中,Zn(Ⅱ),Al(Ⅲ)配合物和槲皮素有两个结合位点,且3-羟基-4酮强于3’,4’-二羟基[10-11]。配位作用具有比氢键和静电作用更高的键能,可以在水等质子化溶剂中稳定存在[12]。很多基于配位作用的阴离子受体与靶标的结合常数可以达到106L·mol-1以上[13],因而以配位作用结合的荧光探针可以有效地在水溶液中发挥检测作用。此外,二价锌离子具有全满的3d轨道,与氮氧原子有较强的配位作用,廉价且毒性小,其配合物应用最为广泛。有研究设计了聚集诱导发光(AIE)[14-15]分子TPEZn,以四苯乙烯为荧光发色团,侧链修饰二联吡啶锌配合物,通过配位结合实现了在溶液中对焦磷酸及单链核酸的荧光信号增强响应。
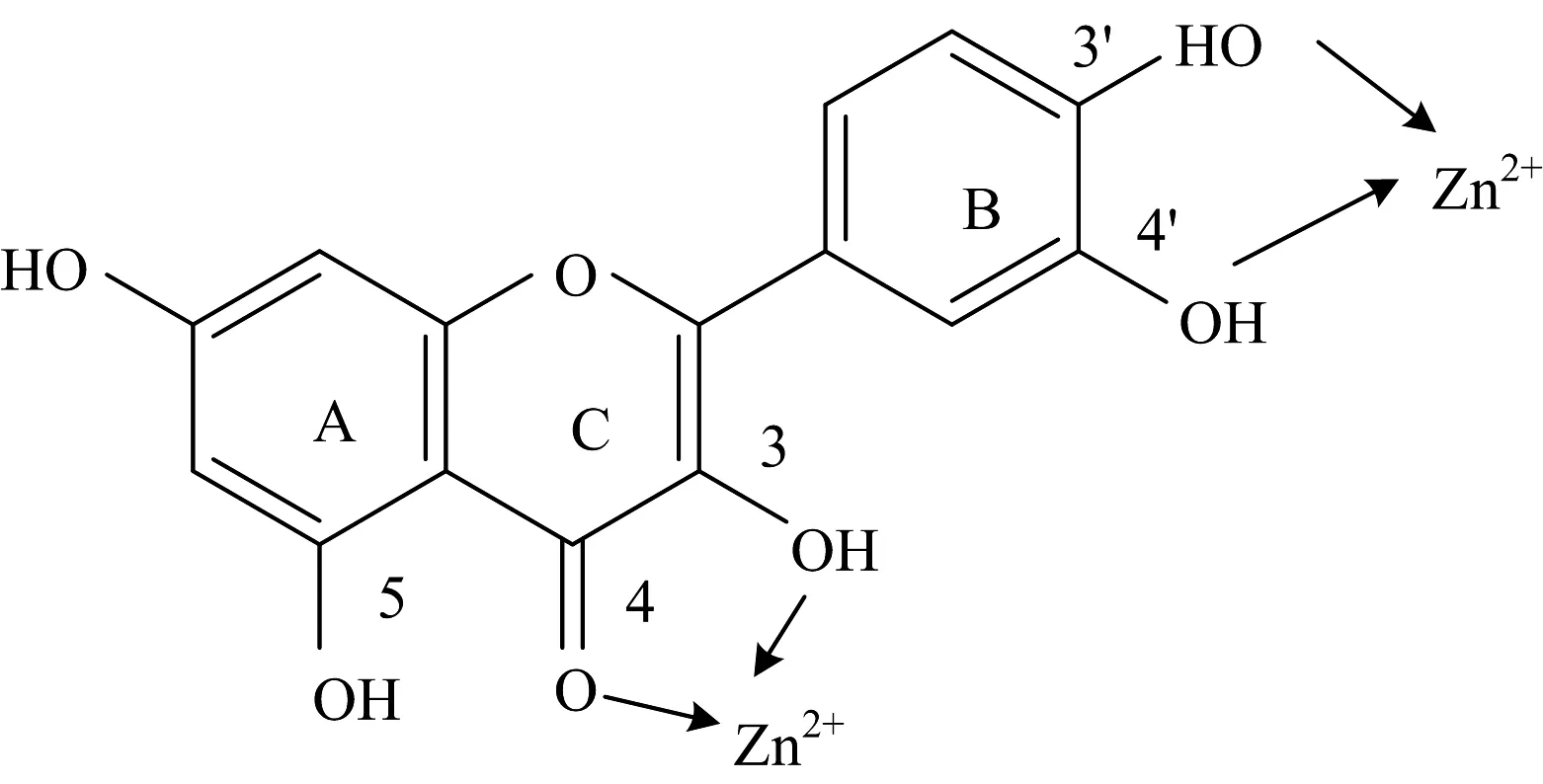
图1 中性介质中槲皮素与Zn(Ⅱ)的配位方式
参考上述研究(见图2),本工作合成了AIE型荧光探针DSAZn[16],研究了DSAZn对槲皮素等五种药物分子的荧光响应,五种药物分子结构如图3所示。该检测方法灵敏度高、选择性好、重现性好,是一种有效测定槲皮素的分析手段。
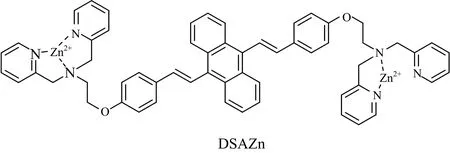
图2 AIE荧光分子DSAZn的结构式
1 实验部分
1.1 仪器与试剂
F-4600荧光分光光度计(日本岛津公司);UV-2600紫外-可见分光光度计(日本岛津公司);pHS-3C酸度计(上海雷磁仪器厂);涡旋震荡仪;电子天平。
槲皮素(Qc)、淫羊藿素(AI)、异鼠李素(Ia)(均购自上海源叶生物有限公司);芦丁(Ru)(上海毕得医药科技股份有限公司);盐酸多巴胺(DA)(上海泰坦科技股份有限公司)各分子结构式见图3(a—e);pH 7.4磷酸缓冲盐溶液(PBS)、二甲亚砜(DMSO),试剂均为分析纯。分别配成2.5 mmol·L-1Qc, AI, Ia, Ru和DA的DMSO溶液,按需求稀释取用。AIE型荧光分子DSAZn根据文献[16]合成,配制浓度为1 mmol·L-1的DMSO溶液。用pH酸度计调节PBS缓冲液的pH至7.0,低温保存在4 ℃冰箱中备用。
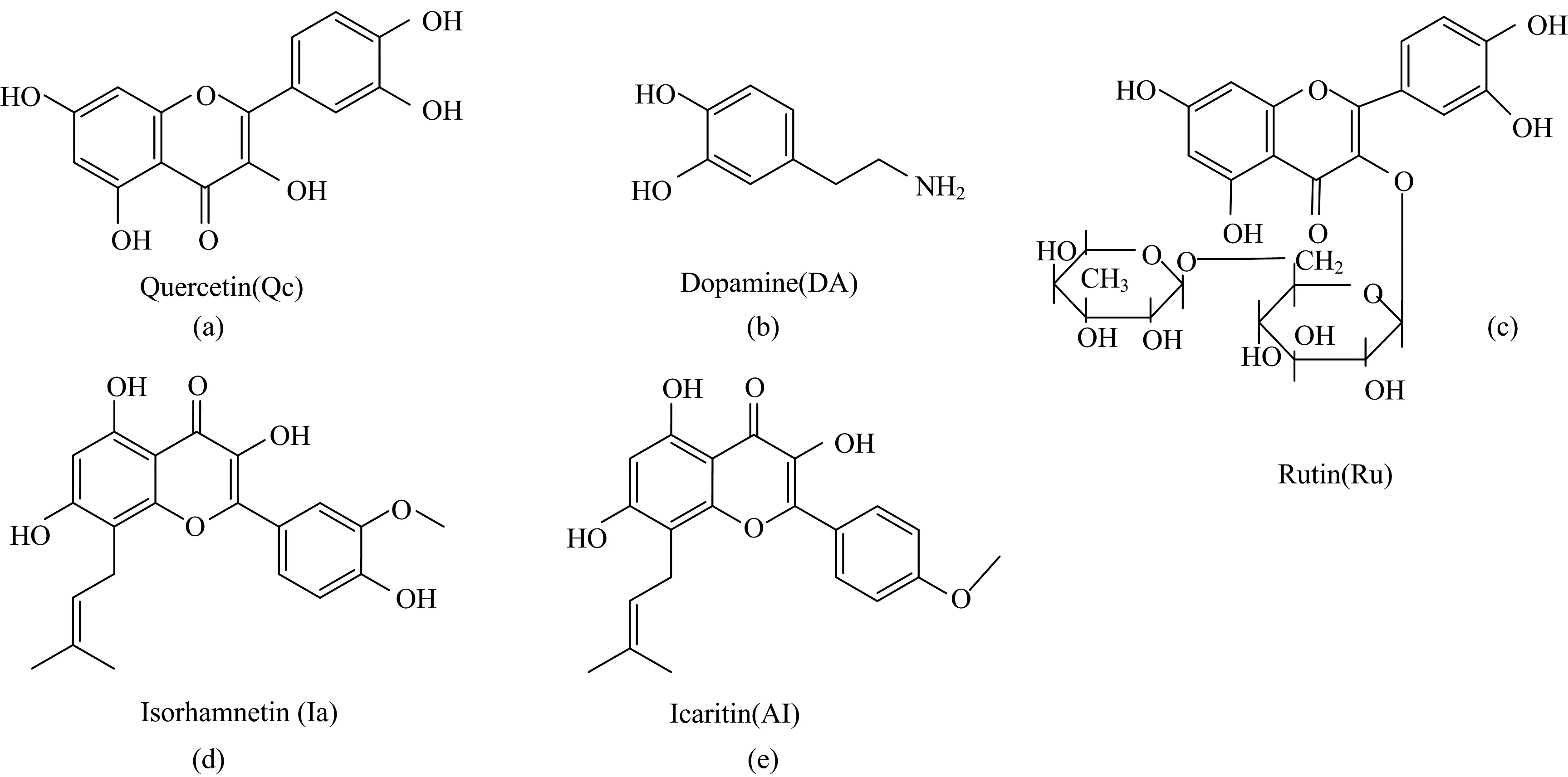
图3 槲皮素(Qc)(a)、淫羊藿素(AI)(b)、异鼠李素(Ia)(c)、芦丁(Ru)(d)、多巴胺(DA)(e)的分子结构式
1.2 方法
1.2.1 检测
准确移取1 mL磷酸缓冲液(PBS,pH 7.0)于荧光比色皿中,加入10 μL DSAZn储备液,再分别加入Qc,AI,Ia,Ru和DA药物溶液,每次加入后涡旋振荡。采用F-4600荧光光度计,激发波长为415 nm,在435~680 nm范围内记录室温下的荧光光谱。
准确移取2 mL pH 7.0磷酸缓冲液(PBS,pH 7.0)于石英比色皿中,检测顺序同荧光检测。采用UV-2600紫外-可见分光光度计,检测250~750 nm范围内室温下的紫外光谱。
1.2.2 数据分析
使用Origin 2018软件绘图,Chemdraw绘制化合物的结构式,使用Microsoft Excel对数据进行统计分析。
2 结果与讨论
2.1 药物分子荧光光谱分析
荧光滴定的结果如图4(a—e)所示,固定DSAZn的浓度,随着药物分子浓度的增加,DSAZn在550 nm处的发射强度下降,发射峰位置和峰形基本保持不变,表明五种药物均能够猝灭DSAZn的荧光。由图4(f)可以看出,Qc对DSAZn的荧光猝灭幅度最大,实现了槲皮素的选择性检测。初始荧光强度(I0)与待测物存在下的荧光强度(It)的比值I0/It-1与槲皮素浓度的线性呈现先快速增长,再缓慢增长最后达到饱和的趋势。当槲皮素浓度达5 μmol·L-1时,DSAZn的荧光几乎被完全猝灭,此时Qc与DSAZn的摩尔比约为1∶2,说明两分子DSAZn配合物结合一分子Qc。此外,荧光检测发现五种药物对DSAZn猝灭效果强弱为Qc>Ia>Ru>AI>DA。推测由于Qc有两个结合位点可形成化合物配位键,且具有很强的给电子能力[6],与DSAZn发生了电子转移,导致DSAZn发生非辐射能量转移,因此荧光猝灭较为完全。而Ru的一个结合位点被糖苷基取代,尺寸排阻作用较大。经自由基清除法(DPPH)测定,Qc与Zn(Ⅱ)形成的配合物抗氧化效率(AE)是Ru与Zn(Ⅱ)形成的配合物抗氧化效率的20倍左右[17]。因此Ru对DSAZn的猝灭效果不如Qc。AI和Ia缺失邻位酚羟基这一结构,只有一个结合位点,据此推测它们与DSAZn的结合能力弱于Qc,猝灭效果也相应减弱。如图4(f)所示,当浓度为5 μmol·L-1时,Qc的荧光变化幅度是其他药物的6.5倍以上,此结果表明DSAZn探针对Qc具有选择性。
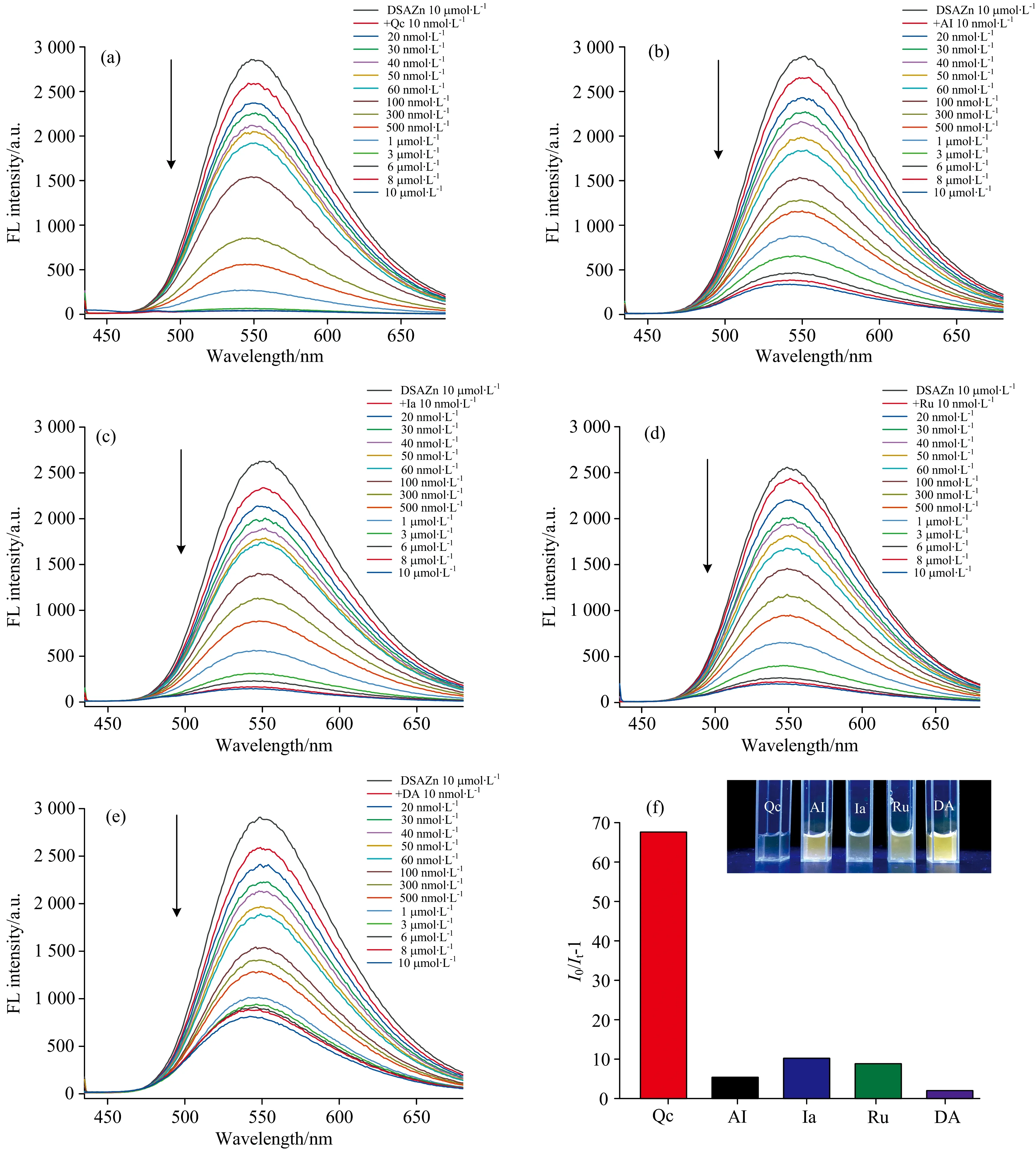
图4 DSAZn在缓冲溶液中的荧光光谱随药物Qc(a),AI(b),Ia(c),Ru(d),DA(e)加入的变化
如图5所示(左上插图为局部放大图),在Qc浓度逐渐增加过程中,550 nm处相对荧光强度(I0/It-1)与Qc浓度在0~5 μmol·L-1范围内呈良好的线性关系,重复性好。其线性拟合方程为y=0.013 4x-0.294 82,其相关系数r=0.994 3,表明本方法可用于Qc的定量检测。采用检测限的计算公式:MDL=3S0/S(S0为标准溶液平行多次检测偏差,S为拟合标准曲线的斜率)。如表1所示,计算得Qc的检测限(LOD)为3.07 nmol·L-1,低于表中文献的参考值,说明本方法有较高的灵敏度。
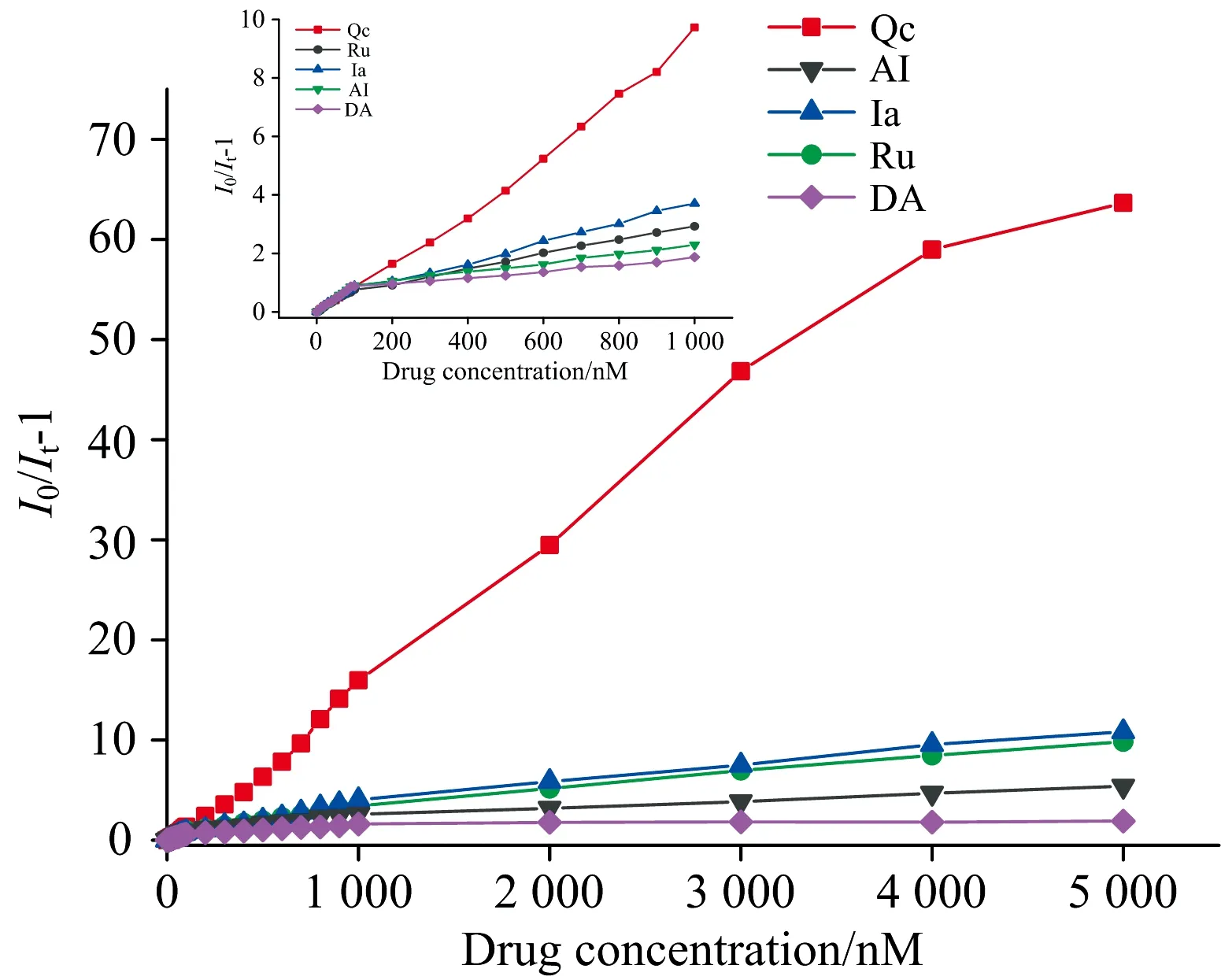
图5 在pH 7.0 PBS缓冲液中,10 μmol·L-1 DSAZn溶液中分别加入5 μmol·L-1五种药物后的相对荧光强度变化(I0/It-1)与药物浓度的关系图

表1 不同检测方法检测槲皮素的性能比较
2.2 槲皮素对DSAZn荧光猝灭机理及结合常数
槲皮素在255和375 nm有两个吸收峰,415 nm处的吸收峰是DSAZn的特征峰。四种药物与DSAZn相互作用的紫外吸收光谱图见图6。由图6(a)可见,固定DSAZn的浓度,加入槲皮素后的复合物体系紫外图谱与DSAZn的紫外图谱不重合,随槲皮素浓度逐渐增加,415 nm吸收峰强度降低,说明槲皮素与DSAZn分子发生相互作用,从而引起DSAZn吸收光谱的改变,证明槲皮素对DSAZn的荧光猝灭为静态猝灭如图6(b, c, d)所示,同理可得到AI,Ia, Ru对DSA Zn的荧光猝灭为静态猝灭。

图6 DSAZn在缓冲溶液中的紫外-可见吸收光谱随药物Qc(a),AI(b),Ia(c),Ru(d)加入的变化
对于静态猝灭,荧光分子和猝灭剂结合形成不发光的基态配合物,根据Stern-Volmer方程[18]:F0/F=1+Kd[Q]计算结合常数。式中[M]0为荧光分子的总浓度,F0和F分别是DSAZn在无猝灭剂和有猝灭剂存在时的荧光强度,Kd为配合物的结合常数。如图7所示,以F0/F对[Q]作图拟合为一条直线,斜率为Kd。计算结果如图7注所示,DSAZn和Qc的结合常数比其他四种和DSAZn的结合常数大一个数量级,达到1.34×107L·mol-1,进一步证明了DSAZn和Qc能特异性结合。
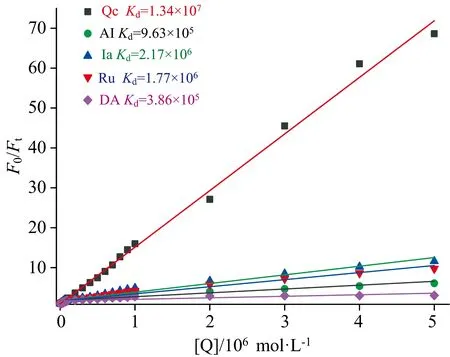
图7 五种药物荧光猝灭DSAZn的Stern-Volmer图
如图8所示,槲皮素的吸收光谱与DSAZn的发射光谱不重叠,排除了荧光共振能量转移(FRET)导致荧光猝灭的可能性。由于Qc是一种强富电子的芳香化合物,通常作为电子给体,推测荧光猝灭由电子转移所引起,如图9所示,Qc和AIE荧光分子DSAZn相互作用并结合为复合物时,发生了电子转移。
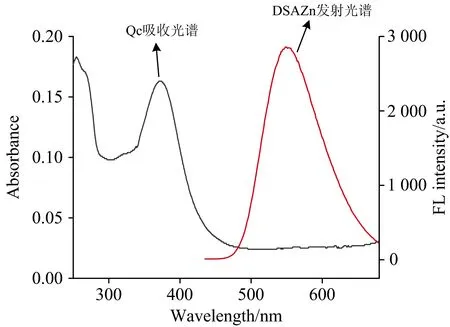
图8 槲皮素的吸收光谱与DSAZn的发射光谱
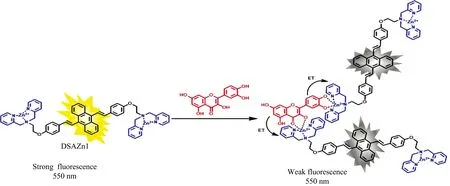
图9 DSAZn对Qc的荧光响应示意图
3 结 论
以水溶性有机分子DSAZn为荧光探针,通过配位作用识别靶标分子槲皮素,并基于激发态电子转移原理猝灭DSAZn的荧光,由此构建了一种AIE型荧光分子对槲皮素的高灵敏度检测方法。此检测法对比了五种药物分子:槲皮素(Qc)、淫羊藿素(AI)、异鼠李素(Ia)、芦丁(Ru)、多巴胺(DA)对DSAZn的荧光响应。采用紫外-可见吸收光谱法分析槲皮素和DSAZn的猝灭类型以及结合机理。本方法具有灵敏度高、选择性好、重现性好等特点,是一种有效测定槲皮素的分析手段。

