磷酸化黑木耳多糖脂质体的表征和抗氧化能力
李雪,李琢伟,李爽,姜欣彤,何思涵,5,刘俊梅,5*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林省农研科技有限公司,吉林 长春 130000;3.长春职业技术学院,吉林 长春 130033;4.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;5.吉林省益尔生物有限公司,吉林 长春 130022)
黑木耳(Auricularia auricula)是一类常见的食用真菌,属担子菌门、木耳科,是药食同源体[1]。从营养学角度分析,黑木耳富含多糖、蛋白质和微量元素,营养价值极高[2-4]。黑木耳多糖(Auricularia auricula polysaccharide,AAP)作为一种重要的天然生物活性物质,组成成分多样、结构复杂,具有多种生物保护活性[5]。在抗氧化、调节免疫、抑菌、防辐射、抗病毒等方面有明显作用[6-10]。AAP作为一种天然多糖,存在溶解性差、分子量大、生物活性较弱等特点。通过对多糖进行磷酸化改性,在多糖残基中引入磷酸基团,可以有效地改善其生物活性[11-14]。但磷酸化改性后的多糖被人体吸收利用前,仍面临被氧化问题,又因目前,人们集中于研究磷酸化黑木耳多糖的结构和生物活性,对于如何提高磷酸化黑木耳多糖的稳定性和利用效能的相关研究鲜见报道。脂质体的成分与生物细胞膜成分极其相似,具有良好的生物相容性,对机体的刺激较低,脂质体的靶向性和安全性可以达到准确低毒的效果,更易被人体吸收[15-16]。脂质体已经成为很多生物医药载体的首选。目前,脂质体在香菇、枸杞、黄芪多糖方面均有所应用,能够起到良好的缓释和保护作用[17-18]。因此,本研究通过磷酸盐化学修饰法,对AAP进行磷酸化改性,以改善其生物活性,并制备磷酸化多糖脂质体,探究磷酸化多糖和脂质体的体外抗氧化能力,进一步提高其稳定性,为解决磷酸化多糖生物利用效能提供可行的理论依据。同时,磷酸化黑木耳多糖脂质体可以提高磷酸化黑木耳多糖的生物活性和人体对磷酸化黑木耳多糖的利用效能,有效提高磷酸化黑木耳多糖的贮藏稳定性,在食品、药品和化妆品领域均具有广阔的应用前景。因此,本研究旨为提高磷酸化黑木耳多糖的稳定性和生物利用效能提供参考。
1 材料与方法
1.1 材料与试剂
黑木耳子实体Aas1502:吉林省华鑫菌业科技有限责任公司;纤维素酶(食品级,5万U/g):上海索莱宝生物科技有限公司;硅片[厚度(650±10)μm,尺寸 5 mm×5 mm]:浙江立晶硅材料有限公司;无水乙醇、丙酮、氯仿、正丁醇、无水葡萄糖、苯酚、硫酸、硫酸钠、磷酸二氢钾、抗坏血酸、钼酸铵、硝酸、过氧化氢、盐酸、过硫酸钾、大豆卵磷脂、氯化钠、三氟乙酸、吡啶、溴化钾、磷钨酸(均为分析纯):国药集团化学试剂有限公司;三聚磷酸钠、三偏磷酸钠、1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picryl-hydrazyl,DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]、胆固醇、吐温 80、磷酸缓冲盐溶液(phosphate buffer saline,PBS)(0.01 mol/L,pH7.2~7.4)、曲拉通 X-100(10%):上海源叶生物科技有限公司;葡聚糖凝胶G-50:上海博美生物有限公司。
1.2 仪器与设备
超微粉碎机(FW-100):北京市永光明医疗仪器有限公司;超声波清洗器(KS-400VDB):昆山洁力美超声仪器有限公司;电热恒温水浴锅(HW·SY11-K):北京长风有限公司;台式高速冷冻离心机(3K15):德国Sigma公司;pH计(ST2100/E):美国奥豪斯仪器有限公司;电子天平(AP224W):日本岛津有限公司;旋转蒸发仪(RE-52):上海亚荣有限公司;冻干机(AIpha 1-4LSC basic):德国马丁克里斯特冻干机有限公司;扫描电子显微镜(EM-30 Plus):韩国COXEM有限公司;酶标仪(PerkinElmer VICTOR Nivo):美国 PerkinElmer公司;透射电镜(H-600):株式会社日立制作所;激光粒度分析仪(Mastersizer-2000):英国马尔文仪器有限公司;电位分析仪(BeNano 180 Zeta):丹东百特仪器有限公司;傅里叶红外光谱仪(Great 10):中科瑞捷(天津)科技有限公司;真空干燥箱(DZF-6034):上海一恒科学仪器有限公司。
1.3 方法
1.3.1 AAP的提取
采用超声辅助纤维素酶法提取AAP。将黑木耳子实体粉碎至100目,按照50∶1(mL/g)的水料比将黑木耳粉与水混合,440 W超声处理20 min。加入1.5%的纤维素酶,在pH4.8、50℃的条件下酶解180 min,将其置于沸水中水浴5 min,4 800 r/min离心20 min,浓缩上清液。4℃的条件下用3倍体积95%无水乙醇醇沉24 h,收集沉淀,冻干[19]。Sevage 法脱蛋白,收集水样,再加入Sevage试剂(氯仿∶正丁醇=5∶1,体积比),重复3次。透析48 h,浓缩、冻干得AAP[20-21]。
1.3.2 AAP的磷酸化
参照郑常领等[5]的方法,略作改进,三聚磷酸钠与三偏磷酸钠质量比为4∶3,与水混匀配制一定浓度的磷酸化试剂。在磷酸化试剂中加入AAP 1 g,硫酸钠5 g,搅拌混匀,在pH值为8.8、温度为94℃的条件下反应5 h。醇沉24 h,冻干获得磷酸化黑木耳多糖(phosphorylated Auricularia auricula polysaccharide,P-AAP)。
1.3.3 磷酸化修饰前后AAP的结构分析
1.3.3.1 磷酸化修饰前后AAP扫描电镜观察
将AAP和P-AAP的粉末均匀涂在硅晶片上后喷金,使用电子显微镜进行扫描,并在2 000×、5 000×倍数拍照[22]。
1.3.3.2 磷酸化修饰前后AAP的傅里叶红外光谱分析
将多糖粉末和溴化钾按质量比1∶100碾碎、混匀,压片完成后放入傅里叶红外光谱仪在4 000 cm-1~400 cm-1处进行红外光谱扫描,扫描次数32次,分辨率4 cm-1[23]。
1.3.3.3 磷酸化修饰前后AAP的单糖组成分析
取AAP和P-AAP 10 mg分别与1 mL 4 mol/L三氟乙酸(trifluoroacetic acid,TFA)在 110℃水解 3 h,水解后于70℃真空干燥箱中干燥;将干燥后样本与1 mL吡啶混合,用1 mL硅烷化试剂混匀溶解。70℃真空干燥箱中干燥,降至25℃,开始检测。气相色谱检测程序:HP-5型石英毛细管柱(30 m×0.32 mm×0.25 μm);恒压模式,0.14 MPa;程序升温:50 ℃,保持 3 min;然后以10℃/min升至280℃,保持5 min;分流比10∶1,进样口温度280℃,氮气为载气;火焰离子化检测器(flame ionization detector,FID)的温度 300℃,氮气、氢气、空气流速分别为25、30 mL/min和400 mL/min;进样体积 1 μL[24-25]。
1.3.4 磷酸化黑木耳多糖脂质体的制备及结构表征
将大豆卵磷脂和胆固醇按质量比7∶1溶于16 mL乙醇中,形成有机相。将大豆卵磷脂与P-AAP按照质量比26∶1溶于磷酸盐缓冲液中,形成水相。利用超声波清洗器将有机相和水相在0℃冰水中完全混合30 min,形成稳定的油包水型乳状液。将乳状液置于圆底烧瓶中,在60℃条件下用旋转蒸发仪蒸发成凝胶。注射10 mL PBS水合30 min,用超声波清洗器均质20 min,得磷酸化黑木耳多糖脂质体(phosphorylated Auricularia auricula polysaccharide liposome,P-AAPL)。最后分别用0.45 μm和0.22 μm微孔滤膜对P-AAPL进行灭菌,4℃条件下保存,用于后续试验[26-27]。
1.3.4.1 P-AAPL的微观形态观察
取少量的P-AAPL水溶液稀释2倍,置于覆盖有碳膜的专用铜网上,再加上2%磷钨酸进行染色,待其干燥后利用透射电镜进行观察[28]。
1.3.4.2 P-AAPL包封率的测定
采用改进的微柱离心法测定P-AAPL包封率。用0.9%NaCl溶液将葡聚糖凝胶G-50溶胀5 h。将注射器芯杆去除,在活塞口处连接0.22 μm微孔滤膜。将溶胀后的葡聚糖凝胶G-50填充到2.5 mL注射器内,装入50 mL离心管中,1 500 r/min离心5 min用于除去多余盐溶液。将400 μL脂质体乳状液缓慢加入凝胶床顶部,以1 500 r/min离心5 min,游离P-AAP吸附于葡聚糖凝胶G-50凝胶柱上,P-AAPL流入离心管,收集离心液。加入400 μL 0.9%NaCl洗脱剩余游离多糖,收集离心液[29]。用20 μL体积分数为10%的曲拉通X-100溶解100 μL的脂质体溶液,蒸馏水补至0.2 mL。同时,建立空白对照组。参照食用菌中粗多糖含量的测定方法测定吸光度,包封率计算公式如下[30]。
包封率/%=(Ap/At)×100
式中:Ap为包封 P-AAP 浓度,mg/mL;At为包封和游离P-AAP总浓度,mg/mL。
1.3.4.3 P-AAPL粒径、Zeta电位、多分散指数测定
取0.2 mL P-AAPL溶液分散于超纯水中,至总体积约为2 mL。使用激光粒度分析仪测定粒径。采用Zeta电位仪测定Zeta电位、多分散指数[31]。
1.3.4.4 P-AAPL傅里叶红外光谱分析
将P-AAPL粉末和溴化钾按1∶100的质量比碾碎、混匀,压片完成后放入傅里叶红外光谱仪在4 000 cm-1~400 cm-1处进行红外光谱扫描,扫描次数32次,分辨率4 cm-1[24]。
1.3.5 脂质体包封前后多糖的静态流变学试验
流变仪的基板选用直径40 mm的平行板转子,进行流变试验。将制备的不同浓度P-AAP和P-AAPL样品水溶液静置5 min。在(25.0±0.1)℃、剪切速度为100.0 s-1~0.1 s-1的范围内,探究表观黏度随剪切速度的变化[32]。试验平行测定3次。
1.3.6 脂质体包封前后多糖的体外抗氧化能力测定
参照GB/T 39100—2020《多肽抗氧化性测定DPPH和ABTS法》中DPPH法进行测定[33]。配制50.0 μg/mL的DPPH-乙醇溶液备用。准备3组试管,分别编号为A组、B组、C组。将180 μL的DPPH-乙醇溶液和不同浓度的20 μL抗坏血酸溶液添加到A组试管中,作为试验组;分别吸取20 μL不同浓度抗坏血酸溶液和无水乙醇溶液180 μL添加到C组试管中,作为对照组;吸取180 μL的DPPH溶液和蒸馏水20 μL添加到B组试管中,作为空白组。避光30 min后,测定3组在517 nm 处的吸光度,记为 Aa、Ab、Ac[33]。
样品测定:用 AAP、P-AAP、AAPL 和 P-AAPL 样品溶液代替抗坏血酸溶液,其他操作同上。
DPPH 自由基清除率/%=[1-(Aa-Ac)/Ab]×100
1.4 数据处理
本试验所有数据平行测定3次。利用Origin软件分析处理数据。
2 结果与分析
2.1 AAP和P-AAP的结构分析
2.1.1 AAP和P-AAP的扫描电镜观察
利用扫描电子显微镜对磷酸化修饰前后AAP的形态结构进行观察,结果见图1。

图1 AAP和P-AAP的扫描电镜Fig.1 Scanning electron microscopy images of AAP and P-AAP
由图1A、图1B可看出,AAP表面较光滑、平整,碎片较少,质地较为紧密,结构清晰。如图1C、图1D所示,P-AAP结构呈碎片化,表面粗糙。可见AAP经过磷酸化修饰后结构发生改变。进一步验证了P-AAP制备成功。
2.1.2 AAP和P-AAP的傅里叶红外光谱分析
红外光谱法是研究糖类化合物结构的一种有效方法,不同的红外吸收频率反映了其特征的化学键和功能基团。通过对其红外光谱的分析,可以确定糖类中含有的官能团种类和部分结构[34]。AAP和P-AAP在4 000 cm-1~400 cm-1波数范围内的红外光谱见图2。

图2 AAP和P-AAP的红外光谱Fig.2 Infrared spectra of AAP and P-AAP
由图2可知,磷酸化前后多糖的峰型没有明显的变化,表明修饰后多糖的主要结构未改变。磷酸化前AAP在3 495 cm-1处出现分子间氢键O-H吸收峰,在3 056 cm-1和1 413 cm-1出现C-H吸收峰,这是多糖的典型吸收峰[35]。两个图谱的主要差别在1 300 cm-1~900 cm-1处。P-AAP在1 220、1 128 cm-1处出现典型的P=O键吸收峰,在901 cm-1处出现P-O-C键的吸收峰,表明有磷酸基团的接入[36]。
2.1.3 AAP和P-AAP的单糖组成分析
确定多糖的单糖组成是研究多糖结构的重要基础,多糖的生物活性与其单糖组成密不可分,因此采用气相色谱法对AAP和P-AAP的单糖组成及含量进行测定。磷酸化修饰前后AAP的单糖组成分析见图3。
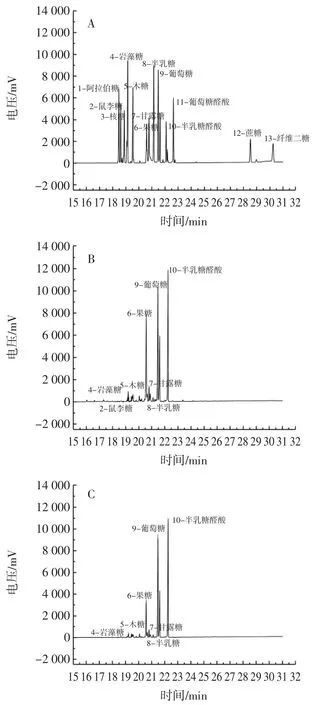
图3 气相色谱Fig.3 Gas chromatograms
以13种常见的单糖作为标准品(图3A),对比分析单糖混合标准品与样品的峰值保留时间,并用峰表面积比求出摩尔比(图3B和图3C)。如图3B、图3C所示,对比磷酸化修饰前后AAP的摩尔比发现AAP经过磷酸化修饰后,单糖组成种类并未发生明显变化,主要由半乳糖醛酸、葡萄糖、果糖、甘露糖和木糖组成,摩尔比由9.2∶8.3∶6.4∶1.6∶1.3变为8.5∶7.5∶2.6∶0.8∶0.8。AAP经过磷酸化修饰后,单糖的峰面积有所降低,可能是由于多糖分子与磷酸基团结合造成,并进一步验证了P-AAP制备成功。
2.2 P-AAPL的结构表征分析
2.2.1 P-AAPL的透射电镜观察
使用透射电子显微镜对脂质体的表观状态进行观察,用于评价脂质体的微观形态特性。P-AAPL的透射电镜图见图4。

图4 P-AAPL的透射电镜图Fig.4 Transmission electron micrograph of P-AAPL
如图4所示,P-AAPL微粒形态完整接近球形,分布均匀、形状大小均一。
2.2.2 P-AAPL的稳定性分析
脂质体的稳定性是评价脂质体质量的重要因素,脂质体的稳定性通常由包封率、粒径、Zeta电位和多分散指数决定。P-AAPL粒径和电位分布见图5。
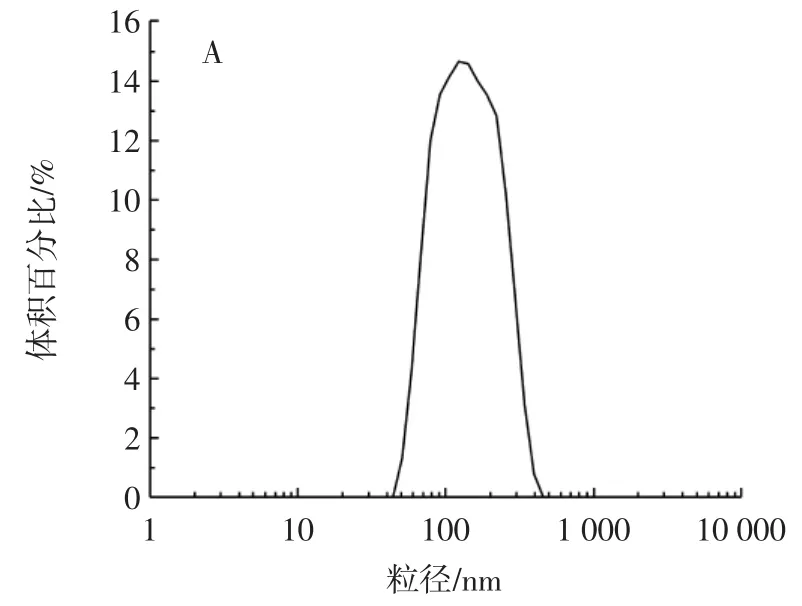
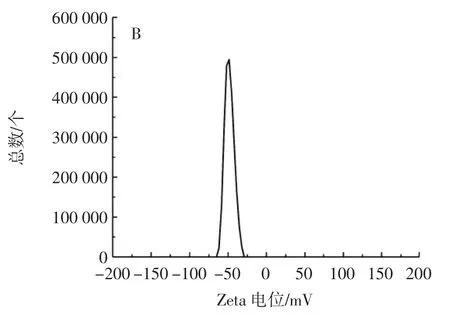
图5 P-AAPL粒径和电位分布Fig.5 Particle size and potential distribution of P-AAPL
如图5A所示,P-AAPL粒径主要集中在50.75 nm~396.06 nm范围内,平均粒径为(122.42±1.41)nm。研究表明,脂质体粒径越小,越容易穿过小肠上皮细胞,能更好地被吸收[22]。如图5B所示,P-AAPL电位主要分布在-61.74mV~-32.04mV范围内,其绝对值大于30mV,表明P-AAPL稳定性较好,能稳定地分散于水相中,脂质体的Zeta电位绝对值越大越能增加颗粒之间的排斥力,使脂质体的稳定性得到明显改善。另外脂质体的多分散指数也是评价脂质体是否稳定和分布均匀的一项重要指标,数值越小,其分布均匀性也越高,PAAPL的多分散指数为0.298±0.035。包封率反映了芯材被壁材包封的程度,包封率越高,脂质体对芯材的包封效果越好,磷酸化黑木耳多糖脂质体包封率为83.26%。
2.2.3 P-AAPL的傅里叶变换红外光谱分析
傅里叶变换红外光谱见图6。
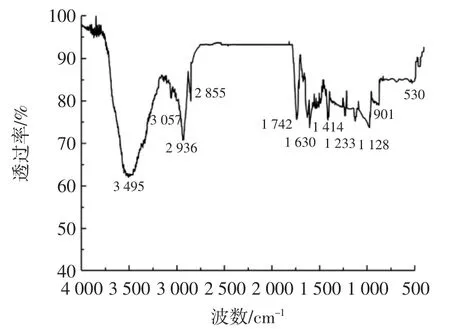
图6 傅里叶变换红外光谱Fig.6 Fourier transform infrared spectrum
由图 6 可知,P-AAPL 在波数为 3495、3056、1629、1 413、1 128、900 cm-1处与 P-AAP 的红外光谱上的峰值较为接近。其中3 495 cm-1由糖分子内或分子间氢键O-H伸缩振动引起,3 056 cm-1和1 413 cm-1则是由C-H伸缩振动引起的。1 629 cm-1为C=O伸缩振动引起的吸收峰。1 128 cm-1和901 cm-1分别是P=O键和P-O-C键引起的吸收峰[5]。因此,可初步判断该物质是糖类化合物。P-AAPL与磷酸化P-AAP相比,在波数2 854、1 741、1 232、530 cm-1处出现峰值,可判断该化合物由脂类化合物组成。2 854 cm-1是双分子层内部非极性CH2特征基团的吸收峰,1 741 cm-1和1 232 cm-1代表大豆卵磷脂双分子层的外部极性基团C=O和P=O的特征吸收峰。此外P-AAPL还在波数为530 cm-1处出现明显的胆固醇的特征吸收峰。脂类官能团的出现对于多糖被脂类壁材包封有着重要意义。
2.3 不同浓度P-AAP和P-AAPL溶液的静态流变学结果
流变特性能够评估流体的力学性能,黏度能够影响流体的感官品质,它是用来评估流体品质的一个重要因素,代表了流体内部结构被破坏的难易程度[22]。脂质体具有与细胞膜相类似的磷脂双分层结构,具有一定的流动性。本研究以表观黏度为因变量,以剪切速率为自变量,探究不同浓度P-AAP和P-AAPL溶液的静态流变学结果。不同浓度P-AAP和P-AAPL溶液的表观黏度与剪切速率的关系曲线见图7。

图7 不同浓度P-AAP和P-AAPL溶液的表观黏度与剪切速率的关系Fig.7 Relationship between apparent viscosity and shear rate of P-AAP and P-AAPL solutions at different concentrations
如图7A所示,不同浓度P-AAP表现出剪切稀释的假塑性流体现象。当P-AAP为2.5 mg/mL时,随着剪切速率的不断升高,P-AAP的表观黏度从467.21 mPa·s下降到 187.78 mPa·s。当P-AAP为 0.5 mg/mL时,随着剪切速率的不断升高,P-AAP的表观黏度从61.43 mPa·s下降到8.23 mPa·s。在一定的剪切速率下,随着P-AAP浓度的升高,多糖溶液的表观黏度增加,剪切稀化现象也愈来愈明显。剪切速率为10 s-1,当PAAP 浓度为 0.5、1.0、1.5、2.0、2.5 mg/mL 时,表观黏度分别为 53.90、122.35、214.85、285.23、410.32 mPa·s。
如图7B所示,不同浓度P-AAPL表现出剪切稀释的假塑性流体现象。当P-AAPL浓度为2.5 mg/mL时,随着剪切速率的不断升高,P-AAPL的表观黏度从561.23 mPa·s下降到 414.25 mPa·s。当 P-AAPL 为0.5 mg/mL时,随着剪切速率的不断升高,P-AAPL的表观黏度从224.58 mPa·s下降到157.12 mPa·s。在一定的剪切速率下,随着P-AAPL浓度的升高,多糖溶液的表观黏度增加,剪切稀化现象也愈来愈明显。剪切速率为 10 s-1,当 P-AAPL 浓度为 0.5、1.0、1.5、2.0、2.5mg/mL 时,黏度分别为213.11、280.25、401.55、465.84、538.96 mPa·s。在相同的剪切速率下,磷酸化黑木耳多糖脂质体表观黏度明显高于磷酸化黑木耳多糖,可能是由于脂质体和多糖间的氢键数量增加,脂质体和多糖的氢键较黑木耳多糖间的氢键难断裂[37]。
2.4 脂质体包封前后多糖的DPPH自由基的清除能力测定
DPPH自由基的清除能力是判断抗氧化能力的重要指标,主要是通过DPPH自由基的孤对电子与单电子配对,使自身的紫色变为黄色,且在517 nm的波长处显示出最大吸收峰,清除能力越强,吸光度越小[33]。本研究以DPPH自由基的清除能力为因变量,探究脂质体包封前后多糖的体外抗氧化能力。脂质体包封前后多糖的DPPH自由基清除能力的测定结果见图8。

图8 DPPH自由基清除能力的测定Fig.8 DPPH free radical scavenging ability
由图8可知,在多糖浓度为6 mg/mL~10 mg/mL时,P-AAP的DPPH自由基清除率明显高于AAP,且脂质体包封后的多糖始终低于包封前多糖的DPPH自由基清除率。当多糖浓度为8 mg/mL时,AAP、P-AAP、AAPL和P-AAPL的DPPH自由基清除率分别为34.94%、52.41%、28.78%和42.98%,此时AAP较AAPL的DPPH自由基清除率高6.16%,P-AAP较P-AAPL的DPPH自由基清除率高9.43%。分析可能是因为脂质体的磷脂双分子层包裹了多糖,为避免多糖被空气氧化,所以包封后多糖的DPPH自由基清除能力下降[22]。
3 结论
磷酸化修饰前后AAP单糖组成主要由半乳糖醛酸、葡萄糖、果糖、甘露糖和木糖组成,磷酸化修饰前后黑木耳多糖摩尔比由9.2∶8.3∶6.4∶1.6∶1.3变为8.5∶7.5∶2.6∶0.8∶0.8。傅里叶红外光谱结果表明有磷酸基团的接入。扫描电镜显示磷酸化修饰后AAP的结构遭到破坏。P-AAPL包封率为83.26%,平均粒径为(122.42±1.41)nm,电位主要分布在-61.74 mV~-32.04 mV范围内,多分散指数为0.298±0.035。傅里叶变换红外光谱结果表明,脂质体与P-AAP之间无新的化学键产生。P-AAP和P-AAPL都表现出典型的非牛顿行为和明显的剪切稀化现象,均为假塑性流体。在多糖浓度为6 mg/mL~10 mg/mL时,P-AAP的DPPH自由基清除率明显高于AAP,且脂质体包封后的多糖始终低于包封前多糖的DPPH自由基清除率。当多糖浓度为8 mg/mL时,AAP较AAPL的DPPH自由基清除率高6.16%,P-AAP较P-AAPL的DPPH自由基清除率高9.43%。以上结果表明,磷酸化修饰能够提高AAP的体外抗氧化能力且脂质体的包封可以有效防止P-AAP的氧化。

