细胞内源性分子辅助荧光信号放大策略及细胞成像
马小飞,胡 山,李俊彬,杨 盛,谌委菊,卿志和,周怡波,杨荣华
(1.长沙理工大学化学化工学院,细胞化学湖南省重点实验室,长沙 410114;2.湖南师范大学化学化工学院,化学生物学及中药分析教育部重点实验室,长沙 410081)
准确获取细胞内分子信息对于阐明生理和病理相关机制至关重要[1],荧光探针具有灵敏度高、实时监测和非侵入性等优点,被广泛应用于医学、生物学和分析化学等领域[2,3].但部分靶标的低丰度特性为传统荧光探针的检测应用带来巨大挑战.信号放大策略通过增加输出信号强度来提高荧光探针检测灵敏度,进而对恶性疾病相关的信号分子和生物标志物进行检测[4].常规细胞内信号放大方法包括杂交链式反应(Hybrid chain reaction,HCR)[5~7]、等温扩增-支点介导滚环放大(Rolling circle amplification,RCA)[8~10]及催化发夹自组装反应(Catalytic hairpin assembly,CHR)[11~13]等,通过在细胞内原位产生DNA构象变化对内源性核酸靶标物进行高灵敏成像.但这些核酸信号放大策略依赖外源性金属离子或核酸,而外部添加物将不可避免地对细胞内微环境造成干扰,进而影响机体的正常生理活动.因此,如何克服外源性添加物依赖性,发展适用于低丰度目标物检测的信号放大方法具有重要意义.
核酸、蛋白质、脂类等生物大分子,谷胱甘肽(Glutathione,GSH)和三磷酸腺苷(Adenosine triphosphate,ATP)等活性小分子以及金属离子(Na+,K+,Ca2+,Mg2+)是构成细胞的重要成分,且其在细胞内浓度较高.基于此,研究者们利用高丰度胞内分子作放大基质,构建了多种新型荧光信号放大策略用于细胞内重要靶标物的检测及荧光成像.本文对目前已报道的细胞内源性分子辅助信号放大方法进行了归纳整理,介绍其信号放大机制,并总结了该策略在生物传感领域取得的重要研究进展.
1 内源性核酸辅助信号放大
内源性核酸辅助信号放大策略利用高浓度内源性核酸分子作辅助链,参与核酸杂交反应,通过释放多个分子信标实现细胞内原位信号扩增,从而对低浓度核酸靶标物进行检测.此方法无需外源性辅助链,弥补了常规细胞内核酸信号放大方法的缺点.
Wang等[14]构建了一种用于miRNA(micro RNA)放大检测及荧光成像的纳米耀斑,首次将内源性mRNA(messenger RNA)用作信号放大基质.该纳米耀斑的检出限低至9.0 pmol/L,比常规纳米耀斑低约3个数量级.如图1(A)所示,金纳米颗粒负载2种类型的DNA双链体(R/S和F*/R*),分别可与靶标miRNA和内源性辅助链mRNA反应.miRNA与R/S反应后可释放单个分子信号产生荧光信号,同时,细胞内高浓度mRNA与F*/R*作用释放大量单链核酸(R*),其与R/S发生竞争反应后释放靶标miRNA,从而参与下一循环,以此产生大量分子信标实现荧光信号放大.细胞成像结果表明,与常规纳米耀斑相比,基于内源性mRNA辅助放大策略构筑的纳米耀斑展现出更高的荧光强度[图1(B)].
Huang等[15]构建了一种用于活细胞中miRNA成像的新型光笼放大纳米耀斑.将DNA双链体F*/R*和光响应的三重链R/P/S结合到金纳米颗粒上构建了纳米耀斑,其荧光信号强度与miRNA浓度对数值之间的线性关系良好,检出限为3.5 pmol/L,比传统纳米耀斑低约3个数量级.在光照条件下,三重链裂解产生游离的P链,R链裸露的部分与靶标物miRNA反应后可释放单个分子信标产生荧光信号.而细胞内高浓度的mRNA可继续参与链置换反应释放靶标miRNA,进而不断循环实现荧光信号放大.与Wang等[14]报道的纳米耀斑相比,该纳米耀斑引入了光控装置,可对纳米机器进行时空控制,避免产生非特异性信号,从而提高了检测的精准度和灵敏度.在紫外光照射下,与常规纳米耀斑相比,基于该策略设计的纳米耀斑表现出更强的荧光信号,表明该探针可通过光控对内源性miRNA进行精确荧光成像.
与传统的纳米耀斑相比,基于内源性核酸辅助信号放大策略所构建的放大型荧光能量共振转移(Fluorescence resonance energy transfer,FRET)纳米耀斑具有较强的抗干扰能力,可在一定程度上避免DNA水解酶和谷胱甘肽所引起的假阳性信号,从而提高其检测灵敏度和精确度.然而,该策略的检测对象局限于核酸分子,不适用于活性小分子物种及其它生物大分子,且核酸在细胞复杂环境中不稳定,DNA降解后将严重影响信号放大效率及检测准确性.

Fig.1 An endogenous mRNA-powered nanoflare image of intracellular microRNA in living cells[14]
2 内源性酶辅助信号放大
酶具有良好的催化活性,可催化相应底物产生指数倍信号输出,是提高检测灵敏度的有效方法[16].基于酶的信号放大方法,如环介导的等温放大(Loop-mediated isothermal amplification,LAMP)[17]、链置换放大(Strand displacement amplification,SDA)[18]和滚环放大(Rolling circle amplification,RCA)[19,20]等可对微量目标物进行体外检测,但其对酶的依赖性阻碍了其在活细胞内的进一步应用.
Su等[21]受碱基切除修复过程的启发,首次构建了由胞内核酸内切酶(Apurinic/Apyrimidinic Endonuclease I,APE1)驱动的“烧桥”DNA马达.如图2(A)所示,APE1是一种DNA损伤修复的核酸内切酶,对双链DNA中脱嘌呤嘧啶(Apurinopyrimidine,AP)位点具有高度特异性,可实现核酸定向自主运动.如图2(B)所示,通过单分子荧光技术监测DNA马达的移动性,证实该系统具有优异的可控性和连续性.该DNA马达的速度高度依赖于APE1浓度,通过不同浓度APE1产生不同荧光信号强度,从而对癌细胞[图2(C1)]和正常细胞[图2(C2)]进行有效区分.
Jiang等[22]构建了一种由核酸内切酶APE1驱动的DNA walker,可在细胞内原位成像尿嘧啶-DNA糖基化酶(Uracil-DNA Glycocasylase,UDG).如图3(A)所示,通过将所有组分整合到DNA-AuNP偶联物中,该DNA walker可有效避免功能核酸组分非特异性降解,从而降低背景荧光信号.进入细胞后,DNA walker与UDG相互作用,轨道链中的尿嘧啶碱基被切除,暴露出AP识别位点,继而与核酸内切酶APE1发生反应,导致荧光素释放,从而恢复荧光信号.如此往复,大量荧光团被释放产生荧光信号,从而实现对UDG的高灵敏检测.如图3(B)所示,与以胸腺嘧啶代替尿嘧啶的对照组相比,DNA walker在细胞内产生明显的绿色荧光信号,表明在细胞内源性UDG和APE1的作用下,DNA walker能够灵敏地检测活细胞中的UDG活性.
细胞内的大分子扩散决定了生物化学过程的动力学,同时也限制了仿生DNA纳米机器的应用[23~26].Zhao等[27]设计了一种可以在活细胞中原位快速“行走”的DNA分子马达,在扩散受限的微环境(如细胞质)中启动粒子“行走”.如图4(A)所示,单链DNA(DW)、含有识别位点(I,oG)的DNA(DTs)通过Au-S作用修饰在金纳米颗粒上形成DNA walker.DW与DT可形成双联,进而激活其特异性位点.进入细胞后,内源性糖苷酶与DT发生特异性反应,移除受损的8-氧鸟嘌呤(oG)或肌苷(I)碱基从而暴露AP位点.该位点可与APE1酶作用从而使DT链断裂,释放荧光团.锚定的DW可以与其它DT分子形成新的双联,以此循环释放更多的荧光团.如图4(B)所示,2种阴性对照系统(无DW和随机序列DW)处理的细胞荧光信号极弱,而孵育DNA walker的细胞有明显荧光信号.与常规组装系统相比,此方法可避免低效率的扩散组装并加速反应动力学,对不同细胞的异质环境做出可靠响应.

Fig.2 Intracellular endonuclease-driven DNA motors for discrimination of cancer cells and normal cells[21]
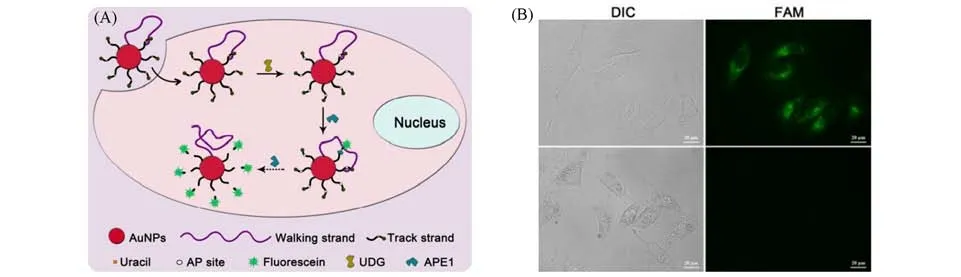
Fig.3 Endogenous enzyme-driven DNA walker image of uracil-DNA glycosylase in living cells[22]

Fig.4 DNA walkers image of diffusion-restricted microenvironments in cells[27]
酶是细胞内广泛存在的生物大分子,可作为刺激物用于分子检测和药物释放[28~30].利用内源性酶辅助信号放大可避免外源添加酶对宿主基因造成损害,但是该策略的信号放大效率依赖酶的活性,导致其检测精确度较低且局限于特定的检测对象,不适用于其它小分子(如活性氧)的检测.
3 胞浆蛋白辅助信号放大
蛋白质是细胞的重要组成部分,是生命活动的主要承担者,与细胞的生长[31,32]、新陈代谢[33,34]、应激反应[35,36]及免疫反应[37,38]关系密切.借助活细胞内高丰度胞浆蛋白辅助增强探针的荧光信号,可实现低丰度靶标物的原位检测[39,40].
本课题组[41]通过对大量染料与细胞裂解液作用后筛选出荧光增强型染料,并进一步证明该染料可与胞浆蛋白中的肌动蛋白发生特异性结合,使荧光信号大幅度增强.基于此,利用介孔二氧化硅作载体,构建了一种胞浆蛋白辅助信号放大纳米探针用于检测细胞内羟基自由基(·OH).如图5(A)所示,修饰单链DNA的功能化介孔硅负载大量荧光染料,表面吸附聚合物(PTAD)构成纳米探针.当探针进入细胞后,内源性·OH裂解单链DNA,使表面堵孔聚合物脱离,从而释放出大量染料,恢复其荧光信号,且释放出的染料可与胞浆蛋白结合进一步大幅度增强荧光信号,其放大效率高达近400倍.通过级联式信号放大,纳米探针对·OH展现出极高的检测灵敏度,检出限为6.4 pmol/L.如图5(B)所示,将探针与巨噬细胞一起孵育后,荧光信号随着孵育时间逐渐增强,表明该探针可有效进入细胞且对内源性·OH进行荧光成像.

Fig.5 Nanosensor based on cytoplasmic protein-assisted signal amplification for imaging of·OH[41]
基于蛋白结合荧光信号增强策略,本课题组[42]在介孔硅上修饰缺氧响应型偶氮苯甲酸,负载荧光染料及猝灭剂后,与环糊精聚合物发生主-客体作用构造新型纳米探针(HCFA).该探针的检测信噪比(S/B)可高达791.5倍,且信噪比与氧浓度在0~10%范围内具有良好的线性关系.如图6(A)所示,当HCFA因滞留效应被动靶向急性发炎的结肠组织时,偶氮键在缺氧条件下还原为氨基衍生物,其与环糊精聚合物之间的主-客相互作用被破坏,染料逸出恢复荧光.同时,游离态染料可与胞浆蛋白结合,进一步增强其荧光强度.图6(B)和(C)所示荧光成像结果表明,探针HCFA可区分细胞不同程度的缺氧情况,并在小鼠活体内成像不同程度的肠炎,从而揭示急性结肠炎与缺氧的潜在关系.
本课题组[43]还构建了H2Sn响应型聚合物胶束,在其内部负载蛋白增强型染料及猝灭剂构成新型荧光纳米信标.该纳米信标可以在体外灵敏地响应H2Sn,信噪比可达941.2倍,且信噪比与H2Sn浓度在0.02~30μmol/L范围内有较好的线性关系,检出限低至0.42 nmol/L.如图7(A)所示,纳米信标进入胚胎细胞后,被内源性H2Sn激活释放荧光染料,染料与猝灭剂脱离后荧光信号恢复,且染料可与胞浆蛋白结合,进一步实现荧光信号的大幅度增强,达到二次信号放大的目的.聚合物纳米信标通过两次信号放大模式展现出极高的灵敏度,从而实现对胚胎发育过程中的H2Sn进行荧光成像.由图7(B)所示斑马鱼成像结果可知,受精卵内H2Sn的浓度较低,随着胚胎发育荧光强度逐渐增强(2.5 hpf),表明H2Sn的浓度升高.但原肠胚期(6 hpf)后,荧光强度开始降低,其中体节期荧光强度降低至50%,并逐渐达到平稳,表明H2Sn在抗氧化、保护正常生理发育等过程中发挥重要作用.

Fig.6 Nanoprobe based on cytoplasmic protein-assisted signal amplification image of hypoxia associated with acute colitis[42]

Fig.7 Monitoring the fluctuation of hydrogen polysulfides during fertilization and embryonic development with polymeric nanobeacon[43]
利用纳米颗粒负载染料可实现荧光信号的有效放大,但染料非特异性泄露也极易诱发假阳性信号,导致信号获取不准确.基于此,本课题组[44]提出一种以染料为支架的新型信号放大策略,构建了自降解染料掺杂聚合物探针(SDPP)[图8(A)].与染料负载纳米探针相比,该探针稳定性好、抗干扰能力强,能精确检测·OH,其放大效率可达396.9倍.如图8(B)所示,SDPP进入细胞后可被·OH激活,通过自降解反应释放染料,进而与蛋白结合放大荧光信号.与染料负载型纳米探针相比,SDPP可有效避免假阳性信号,精确成像细胞内·OH.活体荧光成像结果表明,SDPP可对活体内心肌炎相关·OH进行准确成像.该工作不仅为活体中·OH的成像提供了一种有效的分子工具,而且为精确可靠地获取细胞内分子信息的信号放大策略提供了新的方向[图8(C)].
蛋白辅助放大策略以蛋白结合荧光增强型染料为基础,利用不同纳米颗粒作载体,修饰特异性响应开关后负载染料构建负载型荧光纳米探针.该类纳米探针选择性好、抗干扰能力强,且基于纳米颗粒的高负载性及蛋白增强荧光机制,纳米探针的响应灵敏度高,可用于检测各种低丰度靶标物(如细胞内核酸和小分子).但是,负载型纳米探针在活体应用中面临染料泄露产生假阳性信号的问题.自降解染料掺杂聚合物探针虽然可以避免上述问题,但基于靶标触发的自降解反应所需时间较长,在小鼠活体应用荧光成像中面临一定问题.

Fig.8 Self-immolative dye-doped polymeric probe image of·OH by avoiding leakage[44]

Fig.9 ATP-driven photosensitizers image of microRNA in cells[48]
4 内源性小分子辅助信号放大
ATP作为一种高能磷酸小分子化合物,是细胞生命活动的主要能量来源,且普遍存在于细胞质和细胞核中.同时,ATP可以作为信号分子用于调节细胞主动运输[45]、神经传递[46]和离子通道[47],在细胞内含量高且浓度稳定.因此,ATP是一种理想的细胞内源性信号放大分子.近年来,已开发了几种利用细胞内ATP作为燃料的DNA纳米机器,用于细胞内低丰度核酸靶标物的检测.
Xu等[48]基于ATP驱动的链置换级联扩增策略,设计了一种肿瘤靶向miRNA激活的纳米光敏剂Y-motif/FA@HyNP.该光敏剂在水溶液中稳定性好,可以特异性、高灵敏地检测miRNA,其检出限为0.4 pmol/L.如图9(A)所示,在半导体量子点表面修饰叶酸及功能DNA(Y-motif)构成纳米光敏剂.当利用叶酸靶向肿瘤细胞后,细胞内miRNA与Y-motif特异性结合,释放出其中的ATP适配体.适配体与胞内高丰度ATP结合后,可进一步释放出miRNA特异性结合序列参与循环反应.同时,Y-motif构象变化导致猝灭剂脱离,恢复量子点荧光及光动力学治疗功能.如图9(B)所示,与正常细胞相比,Y-motif/FA@HyNP在癌细胞中有明显的荧光信号,表明纳米光敏剂可通过叶酸受体介导的内吞作用靶向肿瘤细胞.荧光成像结果表明,Y-motif/FA@HyNPs以细胞内ATP为燃料,可对MCF-7细胞中低水平内源核酸Let-7a进行灵敏荧光成像.
Ye等[49]报道了一种简单、高度集成的DNA纳米机器,通过ATP与适配体的特异性结合驱动纳米机器产生荧光信号,对细胞内miRNA进行成像.该纳米机器可高灵敏、特异性地响应miRNA,荧光强度与T碱基浓度在100 pmol/L~2 nmol/L范围内具有良好的线性关系.如图10(A)所示,单链发夹摇臂及功能双链结合于金纳米颗粒上构成纳米机器.当细胞内靶标核酸与发夹摇臂结合后,发夹DNA打开,其端部序列自由摆动,与金颗粒表面功能双链杂交,竞争下修饰荧光基团的ATP适配体.同时,细胞内ATP可进一步与适配体作用,使其远离金纳米颗粒,恢复荧光信号.基于细胞内ATP的高丰度性,可使大量适配体脱离纳米颗粒进而产生高强度荧光信号.如图10(B)和(C)所示,该纳米机器可以区分人胚胎肾细胞(HEK-293T)和人胚肺成纤维细胞(MRC-5)中不同浓度的miRNA-21,并灵敏地检测到HEK-293T中低表达的miRNA-21,表明该纳米机器对细胞内miRNA成像的良好适用性和准确性,且成像时间可持续2 h.
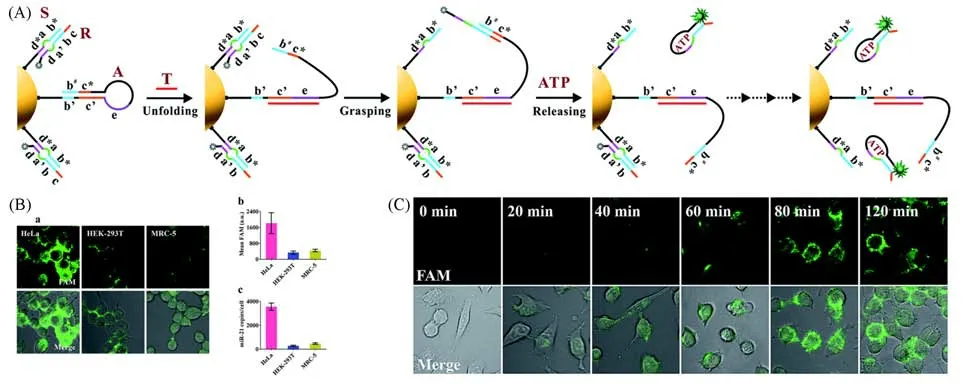
Fig.10 DNA nanomachine powered by endogenous ATP sense target in living cells[49]
Xian等[50]开发了一种ATP驱动光激活DNA walker,用于活细胞中miRNA的时空可控荧光成像.该DNA walker可以高灵敏响应miRNA,且荧光强度与miR-21的浓度对数在100 pmol/L~5 nmol/L范围内呈良好的线性关系.如图11(A)所示,上转换纳米颗粒作为载体负载DNA发夹(HP)探针构成纳米机器.待其进入细胞后,在近红外光激发下上转换纳米颗粒发出紫外光,激活DNA发夹位点使其断裂,暴露靶标结合序列.靶标物miR-21与其结合释放激活单链,参与DNA walker激活循环中.与Ye等[49]报道的DNA纳米机器原理类似,此DNA walker利用上转换纳米颗粒产生的紫外光激活传感器,并利用ATP与适配体作用释放荧光信号报告单元,具备时空可控性.如图11(B)所示,该DNA Walker可对细胞内miR-21进行检测和荧光成像.
半导体或金纳米颗粒对于组装在其表面的DNA组分具有很强的保护性,可在一定程度上抵抗酶的降解,从而使纳米机器具有较好的稳定性.实验结果也表明,上述报道探针的稳定性好,具有一定的抗干扰能力.但是ATP辅助信号放大方法以DNA适配体与分子相互作用为基础,而ATP与适体之间的相互作用不稳定,其复合物在复杂的细胞内微环境中容易被生物分子(如酶和蛋白质)降解,将严重影响信号放大效率.

Fig.11 Imaging of intracellular microRNA with near-infrared light controllable DNA walker driven by ATP[50]

Fig.12 Nanoprobe based on metal ion-assisted signal amplification for miRNA imaging[53]
5 内源性离子辅助信号放大
细胞内金属离子(K+,Mg2+,Ca2+等)参与细胞分裂、神经信号传递等生理过程,对维持细胞结构及蛋白酶活性具有重要作用,且其在细胞内浓度较高.如细胞内Mg2+通常由各种转运蛋白和离子通道控制,其浓度保持在0.5~1.2 mmol/L范围内[51,52].利用金属离子作为信号放大基质或参与信号放大反应过程,可有效提高检测灵敏度.
Wang等[53]开发了一种负载DNAzyme的金纳米颗粒荧光探针,用于放大检测细胞内miRNA.该纳米探针在Mg2+存在时可高灵敏地检测靶标miR-21,检出限为10 pmol/L,且其生物相容性好,具有一定的抗干扰能力,适用于细胞中miRNA成像.如图12(A)所示,该探针由金纳米颗粒和分裂DNAzyme杂交的底物序列组成.荧光基团靠近猝灭剂,其荧光信号被猝灭.当探针进入细胞后,靶标物miRNA与分裂的DNAzyme结合形成活性二级结构,在细胞内Mg2+催化作用下发生断裂,释放修饰有荧光基团的核酸序列及靶标物,产生荧光信号.同时,释放的靶标物可参与下一循环,大量荧光基团被释放产生高强度荧光信号,从而对细胞内miRNA进行检测.如图12(B)所示,在细胞生理浓度Mg2+条件下,细胞荧光强度随着探针孵育时间逐渐增强,与之对比,正常细胞(L02)始终未观察到明显的荧光,说明该探针利用细胞固有Mg2+催化作用,可对肿瘤细胞及正常细胞中miRNA进行成像,并依此区分细胞.
6 总结与展望
本文介绍了内源性核酸、酶、蛋白质、ATP和金属离子辅助信号放大探针的构建和响应机理,总结了其在细胞内低丰度靶标物检测及相关病理研究中的应用.该类探针基于纳米颗粒(如金纳米颗粒、介孔二氧化硅及聚合物胶束等)的高负载性,利用细胞内固有的分子为放大基质,实现原位信号放大.与常规细胞内信号放大策略相比,该信号放大策略不依赖外源性辅助物,所用纳米颗粒均具有良好的生物相容性,且其降解物易被机体排出体外,因此不会对机体造成影响.在探针设计中充分利用了生物体系的多样性,在靶标相关生化信息的超灵敏获取中展现其独特优势.
当然,该策略面临众多困难与挑战,如核酸辅助信号放大策略的检测对象局限于核酸,且核酸探针在细胞复杂环境中不稳定,降解后将影响信号放大效率及检测准确性;而ATP辅助信号放大方法由于ATP与适配体作用力弱,在细胞内复杂微环境中进一步被削弱,进而影响其信号放大效率;基于蛋白辅助信号放大策略构建的负载型荧光纳米探针在活体应用中存在染料泄露产生假阳性信号的问题.因此,如何克服内源性分子辅助信号放大策略的缺点,发展更为完善的信号放大方法用于低丰度重要疾病标志物的检测,在荧光成像应用方面做出新的突破,是研究者努力的方向.如利用细胞内ATP高丰度特性,设计高亲和力的信号报告单元,可避免ATP-信号体复合物在复杂环境中信号强度受限的问题.总之,基于内源性分子辅助信号放大方法的提出为荧光探针在生化传感领域的应用开辟了新的方向,也为揭示重要疾病标志物与疾病潜在关系提供了有力的工具.

