果树火疫病研究进展
方茜,徐幼平,蔡新忠*
(1.浙江大学海南研究院,海南 三亚 572025;2.浙江大学农业与生物技术学院生物技术研究所,浙江省作物病虫生物学重点实验室,杭州 310058;3.浙江大学分析测试中心,杭州 310058)
由解淀粉欧文菌(Erwinia amylovora)引起的火疫病是梨园、苹果园中最具毁灭性的细菌性病害之一。该菌寄主范围广泛,包括蔷薇科的37 属129种[1],例如常见的苹果属、梨属、山楂属以及列入瑞士濒危物种名单的栒子属[2]。火疫病于1780年在美国纽约州和哈德逊高地首次被发现。目前,该病已经蔓延至全球60 多个国家和地区(https://gd.eppo.int/taxon/ERWIAM/distribution)。
火疫病可引起树体大批死亡,造成巨大的经济损失。1930年,美国加州33个县的梨种植面积比上一年减少了35%,用于防治火疫病的总支出为82.5万美元;1966—1967 年,荷兰约有8 hm2果园被毁;1971 年,该病在联邦德国北部西海岸流行,毁掉了1.8万株梨树;1999年在黎巴嫩和意大利严重暴发,单个生长季毁掉了50万棵果树[3]。
我国于20世纪30年代在广东曾有报道火疫病,但没有得到证实。地理信息系统和MARYBLYT模型分析预测结果表明,我国大部分梨和苹果种植区均为该病的适生区。病害发生的严重性随品种、年份和栽培区而异。我国苹果和梨主栽品种大多为高度感病品种,如‘红富士’‘库尔勒香梨’‘杜梨’‘鸭梨’等[4]。随着在邻国吉尔吉斯斯坦、哈萨克斯坦和韩国等地相继发生,火疫病最终传入我国。早在2005 年,与梨火疫病(病原菌为E.amylovora)相似的亚洲梨火疫病(病原菌为E.pyrifolia)就在浙江零星发生,目前该病已扩展至3 省(市)19 县(市、区)[5]。2016 年5 月,火疫病在新疆伊犁州被首次报道,现已传至甘肃省的张掖和武威地区,共计2个省(自治区)70个县(市、区)[5],对新疆乃至全国的苹果和梨产业的健康发展造成了巨大威胁。当前,国内外关于火疫病的研究和防治取得了相当的进展。但由于其病菌寄主范围较广,缺乏特效药剂和高抗优质品种,该病仍然是苹果和梨产区主要关注的问题。
本文综述了火疫病的病害特性和发生规律、火疫病菌致病机制及其寄主植物抗性机制,重点介绍了火疫病的防治方法,旨在为火疫病发生规律的深入研究和防治新技术的研发提供参考。
1 火疫病病害特性
1.1 病原菌Erwinia amylovora 的生物学特性
E.amylovora属肠杆菌科(Enterobacteriaceae)欧文菌属(Erwinia),是一种革兰氏阴性杆状细菌,有荚膜,周生鞭毛,大小为(0.9~1.8)μm×(0.6~1.5)μm,单生或呈双链状;菌落白色,黏性,有绒毛状中心环,表面光滑,边缘整齐。E.amylovora生长的适宜温度为23~30 ℃,最适温度为28 ℃,最适pH 为6.0,pH 5.0 以下其生长被抑制。在25 ℃、pH 6.0条件下,该病原菌繁殖世代时间为75 min[6]。
1.2 病害症状特点
1817 年,威廉·考克斯(William COXE)首次创造的“火疫病”这个词描述了该病害最典型的特征——在几小时内,树枝、花朵和树叶像被火烧过一样全部变黑,病枝上叶片凋萎,幼果僵化而不脱落,整棵树呈现枯萎、烧焦的外观,故得此名。根据E.amylovora侵染的部位,又分为花枯病、枝枯病、果枯病、根枯病。
花枯病是火疫病最早显现的症状,通常出现在早春季节。当受病原菌E.amylovora侵染后,花朵从最初的水渍状变成褐色至黑色,若遇高温高湿天气,花序梗中会渗出类似琥珀色的黏稠液滴,受感染的花朵通常会掉落或附着在树上。E.amylovora侵染幼嫩的枝芽引起枝枯病,5~10 d 内病害迅速蔓延,病枝上的叶片沿中脉和次脉变黑,受感染的枝条变为深棕色或黑色,枯萎的树枝在尖端形成一个“手杖”状弯曲,在潮湿环境下病部还会形成“菌脓”(图1)。在有些感病寄主中,病害继续向下蔓延,E.amylovora侵染较大的枝条,形成局部的溃疡病,树皮变黑,后期表面轻微凹陷,边缘明显,剥去表皮可见红褐色的树皮组织,这也是区别梨火疫病与亚洲梨火疫病的重要特征[7]。果枯病通常发生于未成熟的果实上,初生水浸状斑(图1),后变暗褐色凹陷,并渗出黄色黏液,致病果变黑而干枯,在潮湿环境下病部产生黏稠的细菌溢泌物,初呈白色,后呈红褐色。此外,侵染树冠和根部的梨火疫病菌最具有破坏性,直接导致树木立即死亡,多发于很多高密度种植矮化果树的标准果园中。

图1 梨火疫病症状Fig.1 Symptoms of pear fire blight
1.3 病害发生规律
1.3.1 侵染循环
E.amylovora侵染循环涉及病原菌的越冬越夏、春季初侵染、病原菌传播扩散、生长季节再侵染等过程。在溃疡病疤组织、病果及某些昆虫消化道内,越冬的E.amylovora是主要初侵染源;除此之外,内寄生于健康梨树组织中的E.amylovora可能也是初侵染源。当早春气温回升时,E.amylovora开始繁殖,由风、雨、鸟类、蜜蜂授粉、农事活动等传播至花,在蜜腺中快速生长繁殖。E.amylovora的Ⅲ型分泌系统(type Ⅲsecretion system,T3SS)对其在花柱上的生长起主要调控作用。在高相对湿度下,E.amylovora利用鞭毛从柱头移动到蜜腺中[8]。E.amylovora一旦定殖并在组织中传播,其再侵染可能会在整个生长季节持续存在。此时,再侵染的来源可能是幼嫩的芽、叶或更大枝条上产生的细菌溢泌物,直接通过自然孔口或伤口进入寄主组织,在木质部和韧皮部薄壁组织中快速迁移,最后造成严重的溃疡病斑。在生长季节结束后,大部分病原菌随树皮组织死亡而死亡,小部分残留在病花、病叶组织中越冬,继续完成下一个侵染循环[8]。
1.3.2 发病条件
火疫病的发生与内部条件和外部环境密切相关。温湿度是最主要的环境因素。当气温为18~24 ℃、相对湿度达70%以上时,E.amylovora活性较强,能以3~30 cm/d的速度向健康组织扩展,造成全株性死亡。调查发现:地势低洼易积水、土壤黏重易板结的果园中梨火疫病发生较重;雨水多时会加快病害的传播。
2 Erwinia amylovora 致病机制
E.amylovora成功侵染植物需要2 个关键的毒力因子:T3SS及胞外多糖[9]。T3SS是一种由20多个蛋白组装而成的管状效应蛋白分泌通道,可将效应蛋白从病原菌体内转移到植物体中。E.amylovora依赖T3SS 抑制植物的免疫防御反应,如抑制活性氧的产生以及病原体相关分子模式触发免疫[pathogen-associated molecular pattern (PAMP)-triggered immunity,PTI]、效应子触发免疫(effectortriggered immunity,ETI)的激活。E.amylovora中与T3SS 相关的大多数结构及效应蛋白的分泌受到复杂的网络调控,其中HrpL是识别并结合其靶基因启动子上特定序列(hrp-box)的主要调节子。HrpL又受多个调节蛋白的调节,如HrpS 蛋白激活HrpL转录,HrpX/HrpY蛋白正调控HrpL表达,GrrS/GrrA及EnvZ/OmpR负调控HrpL表达[8]。
火疫病菌E.amylovora通过T3SS 分泌的蛋白质包括多种效应蛋白[DspA/E、Eop1、Eop2、Eop3和Eop4(AvrRpt2EA)]以及Hrp 蛋白(HrpN、HrpW、HrpJ和HrpK)[10]。其中,DspA/E 与HrpN 是E.amylovora的重要毒力蛋白(图2)。DspA/E 与丁香假单胞菌(Pseudomonas syringaepv.tomato)中的AvrE 同源,通过HrpL途径释放到植物细胞中,诱导细胞死亡[11],并通过富含亮氨酸重复序列(leucine-rich repeat,LRR)受体激酶DIPM1~4促进病害发生(图2)。DspA/E可抑制茉莉酸和水杨酸途径中相关基因的表达,从而干扰宿主的免疫反应[12]。HrpN蛋白将DspA/E及其他效应蛋白从E.amylovora转移到植物细胞内,诱导植物产生过敏性反应(hypersensitive response,HR)[13],并与跨膜蛋白HIPM 互作,促进病害发生(图2)。Eop1、Eop3、Eop4作为无毒因子,在调节寄主-病原物互作中起作用。Eop1 是YopJ 家族成员之一,具有寄主特异性,是抗火疫病苹果品种‘Everust’和野生物种Malus floribunda821 识别的无毒因子[14]。Eop3可能是火疫病菌株Ea273中的无毒因子,被苹果品种‘Red Delicious’所识别[15]。Eop4 可 激 活 基 于Malus×robusta5FB_MR5的 抗性[16]。Eop2 蛋白末端保守的果胶裂解酶结构域可与植物细胞壁相互作用,促进效应蛋白的易位。HrpW 蛋白的N-端结构域可引发过敏反应。HrpJ可作为细胞外的分子伴侣防止HrpN在质外体中的聚集,从而促进HrpN 进入寄主细胞。HrpK 蛋白可能参与T3SS底物的转运[10]。
E.amylovora可产生荚膜状的胞外多糖,从而帮助其绕过植物的防御系统,并能在干燥条件下保持菌体湿润,避免水分和养分流失[8]。E.amylovora中与毒力相关的2 类胞外多糖主要是火疫菌素(amylovoran)和果聚糖(levan),两者对该病原菌生物膜的形成起关键作用[17]。火疫菌素可作为保护E.amylovora免受植物抗菌反应的屏障[18]。果聚糖由lsc基因编码的左旋蔗糖酶合成,缺乏果聚糖合成能力的E.amylovora的致病力明显下降。E.amylovora胞外多糖的合成与寄主体内山梨醇含量有关。山梨醇是绝大多数蔷薇科植物的储糖物质。E.amylovora的Srl基因编码的蛋白质使山梨醇磷酸化,促进胞外多糖合成。该病原菌形成的Srl操纵子由6 个基因组成。其中,SrlA、SrlB和SrlE编码吸收山梨醇的蛋白质,SrlD编码将山梨醇转化为果糖的蛋白质,SrlM和SrlR则为调节基因[13]。
E.amylovora的致病性还与Ⅵ型分泌系统(T6SS)及生物膜的形成有关。T6SS 是变形菌门(Proteobacteria)特有的分泌系统,通常由15~25 个基因组成,在细菌表面形成一个类似倒置噬菌体尾巴的结构[19]。T6SS通过促进火疫菌素与果聚糖的生物合成来参与E.amylovora致病,其可能的机制是保护该病原菌免受其他微生物的攻击或者提高该病原菌对其他微生物的竞争力[20]。此外,E.amylovora可在植物体外及体内形成生物膜,在入侵寄主植物过程中起关键作用。当生物膜形成后,E.amylovora需要附着在木质部表面,其细胞表面的结构鞭毛(flagella)、菌毛(curli)、黏附素(adhesins)、紧密黏附素(intimins)、侵袭素(invasins)等在附着中起重要作用[21]。E.amylovora利用鞭毛由柱头移动到蜜腺的整个过程受鞭毛主调控基因flhDC与T3SS 的精密调节,使得flg22表位的产生最小化,避免激活寄主植物PTI免疫反应[22]。生物膜形成能力弱的E.amylovora无法在植物木质部中建立大规模的种群,不利于其侵染[9]。
3 寄主植物对火疫病的抗性机制
植物对火疫病的抗性是一种数量性状遗传。目前,已经在苹果中定位到多个抗性数量性状位点(quantitative trait locus,QTL),包括:苹果栽培品种‘Fiesta’的第7 连锁群中一个主要抗性QTLFBF7[23];苹果品种‘Florina’连锁群5 和10 上的FB_FLO5及FB_FLO10[24];野生苹果Malus×robusta5(Mr5)LG3 近 端 位 置 的FB_MR5[25]和Malus×arnoldianaMAL0004 中 的FB_Mar12;野 生 苹 果M.floribunda821及观赏品种‘Everust’基因组LG12远端区域的FB_E12和FB_Mf12[26],以及野生苹果M.fusca的FB_Mfu10[27]。
一些QTL的抗火疫病功能已得到验证,研究最深入的是FB_MR5。该基因编码卷曲螺旋(coiledcoil, CC)结构域-核苷酸结合位点(nucleotidebinding site, NBS)-LRR 结 构 域 型R 蛋 白,在MdRIN4 的参与下识别E.amylovora效应子AvrRpt2EA。MdRIN4 是拟南芥RIN4 的同源蛋白,AvrRpt2EA切割MdRIN4 后释放AvrRpt2 裂解产物3(AvrRpt2-cleavage product 3, ACP3),从 而 激 活FB_MR5 诱发防御反应[28](图2)。AvrRpt2EA是火疫病菌与苹果协同进化的分子靶标,其效应子第156位半胱氨酸(C-等位基因)替换为丝氨酸(S-等位基因),导致FB_MR5的抗性消失[29]。
FB_Mar12编码具有丝氨酸/苏氨酸激酶和LRR结构域的蛋白[30],其抗性不会被带有S-等位基因的火疫病菌所克服,是较为稳定且持久的QTL,该位点靠近LG12。缺失Eop1效应子的E.amylovora能侵染M.floribunda821 及‘Everust’,但并不会引起Malus×arnoldianaMAL0004 中的抗性消失,表明Eop1 可能是FB_E12和FB_Mf12而不是FB_Mar12识别的无毒蛋白(avirulence protein,AVR)[14](图2)。FB_Mfu10对极具侵袭性的S型菌株具有高度抗性,但迄今尚未见报道能克服FB_Mfu10抗性的E.amylovora菌株,该QTL 中存在编码凝集素和丝氨酸/苏氨酸激酶结构域的潜在R基因,具体功能有待进一步验证[31]。
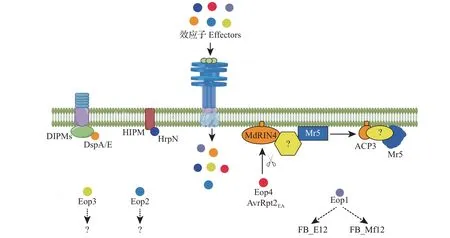
图2 植物与E.amylovora互作分子机制Fig.2 Molecular mechanisms underlying plant-E.amylovora interactions
最近的研究结果显示,苹果凝集素家族MdAGGs在苹果抗火疫病菌中起作用[32]。诱抗剂苯并噻二唑(BTH)诱导MdAGGs 大量积累,MdAGGs在低pH情况下与火疫病菌细胞表面脂多糖和结合态胞外多糖结合,从而凝集火疫病菌细胞。作为逆防卫反应,在感病寄主中,火疫病菌通过分泌DspA/E和胞外多糖抑制MdAGGs基因的表达,并分泌带负电荷的火疫菌素等胞外多糖作为诱饵,结合并消耗表面带正电荷的MdAGGs,从而保护该病原菌免受其凝集抑制。
除蛋白质之外,植物感知到E.amylovora入侵时,还会分泌大量次生代谢物质,可直接隔绝该病原菌或通过影响其重要的生理过程来限制其传播。二氢查耳酮(dihydrochalcone, DHC)是苹果叶中含量最丰富的黄酮类化合物,主要成分是根皮苷(phloretin 20-O-glucoside)及根皮素(phloretin),正常情况下根皮苷与根皮素的质量比约为10∶1,当受到E.amylovora侵染时,苹果中DHC 会通过2 种途径进行转化,即去葡萄糖基化途径及氧化途径。在抗病品种中,氧化反应更占优势,根皮素浓度更高,从而具有更高的杀菌活性,在感病品种中则相反[33]。
植物激素也在抗火疫病反应中发挥着重要作用。水杨酸(salicylic acid,SA)是一种与E.amylovora抗性相关的防御激素,用SA 类似物处理梨和苹果可保护它们免受该病原菌的侵染[34]。在苹果体内过表达关键的SA 信号基因MpNPR1可赋予其抗病性。在非寄主植物拟南芥中,沉默水杨酸调节基因EDS1降低了拟南芥对E.amylovora的抗性[35]。在低氮含量环境下,拟南芥对火疫病菌的敏感性增强,这与植物体内较低的活性氧积累量和较低的茉莉酸(jasmonic acid,JA)信号通路表达量有关,而外源施用茉莉酸甲酯(methyl jasmonate, MeJA)可提高低氮条件下植物的抗性[36]。下调茉莉酸信号通路表达量同样会降低寄主植物对E.amylovora的抗性。但目前尚不清楚JA 信号通路对E.amylovora的具体作用机制。
本实验室通过对梨抗病品种‘玉露香’与感病品种‘库尔勒香梨’的组成性差异蛋白组进行分析,鉴定出29个潜在的抗火疫病菌相关蛋白,包括3个免疫受体FERONIA、LYK4 和LecRK8.2,一组防卫相关蛋白如碳酸酐酶、prosaposin 和类SRG1,一组酚类合成调控酶以及一个铜转运腺苷三磷酸酶(ATPase)蛋白HMA5。此外,差异表达蛋白还包括13 个氧化还原相关蛋白。这表明基于FERONIA、LYK4 和LecRK8.2 等的免疫,碳酸酐酶、prosaposin和类SRG1介导的防卫反应,酚类合成,HMA5介导的铜转运以及氧化还原调控可能参与‘玉露香’梨对火疫病抗性的调控[37]。
总体而言,植物对火疫病的抗性机制研究还远不够深入,已有的结果主要来自苹果,而梨等抗火疫病分子机制的研究亟待加强。
4 防治方法
E.amylovora寄主范围十分广泛,毒力强,迁移速度快,难以找到统一的根治靶标。因此,对梨火疫病的防治需要综合多种方法,目的是:1)防止病害的传入;2)提高寄主植物的抗病性;3)减少初侵染源;4)阻止E.amylovora在植物体内的定殖。常用的方法有:植物检疫,防范病情传入及扩散;培育抗病品种;协调运用农业防治、化学防治、生物防治等手段,避免病害的发生或进一步加重。
4.1 植物检疫
我国农业农村部新修订的《全国农业植物检疫性有害生物名单》和《应施检疫的植物及植物产品名单》中,火疫病菌E.amylovora被列为全国农业植物检疫性有害生物[5]。因此,从苗圃或发生火疫病的国家进口梨、苹果、山楂等蔷薇科寄主植物苗木、接穗时应采取严格措施。
第一,严格禁止进口带病的苗木、果实、接穗等繁殖材料,严格实行产地检疫并严格限制引进苗木的数量。第二,对已经进口的苗木、接穗等繁殖材料加强隔离试种检疫,隔离试种期应在5年以上,只有经隔离试种无病的苗木才允许扩大繁殖,防止火疫病菌的传入及定殖。第三,对于种苗繁殖材料及水果带菌体的检疫,使用柠檬酸缓冲液、次氯酸钠溶液浸泡或进行湿热处理。
4.2 培育抗病品种
防治火疫病最根本和最为经济有效的方法是培育抗病品种。中国作为世界梨属植物的发源地,种质资源十分丰富。通过幼果人工接种技术发现,中国梨种质中存在较丰富的抗火疫病资源,相较于西方梨,东方梨对火疫病的抗性更强,特别是很多地方品种,如‘新疆黄梨’‘青海冰糖’‘山西油梨’‘木瓜梨’等。对20 个国内外梨品种抗病水平的室内接种分析表明:地方品种晋酥‘绿梨’表现出抗病性,霍城冬黄梨‘八月酥’及库车阿木特‘棉梨’表现出耐病性;但国内主栽品种‘库尔勒香梨’‘杜梨’等为高度感病[4]。此外,我国的‘花盖梨’及‘豆梨’对火疫病近乎免疫,其根部和茎部能较好抵抗火疫病菌的侵染;新疆野苹果‘GD-9’为高抗火疫病品种,且具有耐病、耐寒、耐旱等优良性状,可作为抗火疫病的苹果砧木来源[38]。
国外已经有几个与抗性相关的QTL 在苹果属物种中被确定。其中,野生物种中具有最高抗性的QTL,但这些野生品种的品质不佳,或个头小或味道苦涩,可作为砧木用于抗火疫病育种[27]。HARSHMAN 等[39]从200多份苹果材料中确定了数个优良抗火疫病种质资源,将这些抗性资源导入已具有一定程度抗病性的种质如‘Fiesta’‘Splendour’及‘GoldRush’中,通过聚合多个抗性基因,可望育成广谱持久抗火疫病的高品质苹果品种。
通过传统的抗病育种方法也获得了一些抗病品种,如德国梨树品种‘Alexandre Lucas’和‘BeurréHardy’、瑞士苹果品种‘Ladina’[29]。但传统方法存在培育年限长等问题。近年来,随着分子生物学、基因组学与生物信息学的快速发展,新的育种技术如基因组编辑等不断用于抗病种质的培育。MALNOY 等[40]成功将纯化的CRISPR/Cas9 核糖核蛋白(ribonucleoproteins, RNPs)直接递送到苹果的原生质体中,有效突变了目标候选基因DIPM-1、DIPM-2和DIPM-4,提高了苹果品种‘金冠’对火疫病的抗性。密歇根州立大学何胜洋团队克隆了植物抗病关键调控因子NPR1 的苹果同源基因MpNPR1,并将其导入‘M.26’和‘Galaxy’,转基因品系对火疫病表现出更高的抗性[41]。来自惜古比天蚕(Hyalophora cecropia)的抗菌肽attacin E 可以裂解许多重要的植物病原菌,转化该基因的苹果树表现出对火疫病的抗性[15]。将抗性基因FB_MR5转入易感栽培种‘Gala’,可赋予其抗病性[29]。热不稳定延伸因子(elongation factor thermal unstable, EF-Tu)作为一种PAMP,被EFR受体识别,从而激活植物的免疫反应。在易感苹果砧木‘M.26’中表达EFR基因可赋予苹果对火疫病菌的抗性。转基因砧木‘M.26’可识别E.amylovora中EF-Tu 衍生的PAMP肽elf18,激活PTI 免疫反应[42]。除了增强抗病性之外,基因组编辑技术还能大大缩短育种年限,通过转早花基因的方法可在7年内培育出携带抗火疫病基因Fb-E的第5 代优良品系(BC′4),且对火疫病具有较高的抗性[43]。因此,利用基因组编辑等新技术培育广谱持久抗火疫病品种将是防控火疫病的重要途径。
4.3 农业防治
梨园和苹果园中栽培树种结构不合理、果园管理不到位、种植品种单一是火疫病频发的主要原因。为预防火疫病的发生,选择合适的果园地点尤为重要,如在海拔700 m 以上地区种植的梨树感染火疫病的概率远远低于海拔400 m 以下的地区,这是因为海拔高,开花时间较晚,可避开病原菌的侵染盛期。不同土壤条件也会影响火疫病的发生,生长在排水良好、pH为5.5~6.5和钾含量较高的土壤中的梨树更不容易发生病害[1]。因此,应适时施肥,及时排水,通过调整和改善梨树的生长环境来增强梨树的抗病性。若火疫病已经发生,减少果园的初侵染源则是关键措施之一。通常,在秋末冬初时及时修剪受感染的枝条,为彻底去除病害,还应修剪距病部30~50 cm处的健壮枝条,同时,剪除病花和病叶并集中烧毁。在每次修剪时,都应使用乙醇或0.5%次氯酸钠溶液进行表面消毒,务必做到“一剪一消毒,一锯一消毒”,严防修枝剪上携带的火疫病菌传播而加重病害。为提高消毒的效率,王俊等[44]研发了电加热自动消毒剪,该设备在工作时刀片始终保持120~150 ℃的高温,可有效杀死沾染在刀片上的病原菌。此外,火疫病还可以通过蜜蜂的授粉传播而加重危害,所以在发病果园内原则上禁止放蜂。为保证香梨等安全授粉,可推广使用无人机授粉、人工点粉、液体授粉、“蜜蜂+生防菌”等授粉技术。
4.4 化学防治
化学防治是火疫病应急控制的关键措施,常用的化学药剂如表1所示。

表1 火疫病防控药剂Table 1 Chemicals for fire blight management
花枯病阶段是防治火疫病的关键时期。对花枯病的控制在很大程度上依赖于化学药剂,可在开花期适当施用硫酸铝钾和72%农用链霉素可溶性粉剂3 000~4 000 倍液。但硫酸铝钾易被雨水冲走,导致施用后药效下降迅速。链霉素作为杀菌效率最高的化学药剂之一,可以与病原菌核糖体结合并阻断蛋白质的合成[45],但已在火疫病菌中观察到对链霉素的抗性,最常见的抗性机制是编码核糖体蛋白的染色体基因rpsL自发突变,导致病原菌对链霉素免疫。这种突变在美国、埃及、新西兰、以色列的耐药菌株中普遍存在[46]。此外,残留的链霉素进入环境会对土壤、水等造成污染,并影响生物多样性,许多国家已经严格限制链霉素的使用。自2014 年以来,瑞士一年只允许施用一次链霉素[2]。近年来,研究人员也开发了不少新的化学药剂来代替链霉素。如在梨树发芽前全树均匀喷布1∶2∶200倍量式波尔多液、47%春雷·王铜可湿性粉剂700倍液或53.8%氢氧化铜干悬浮剂1 000 倍液等可有效防止火疫病的发生。以色列在梨树开花期喷施0.15%~2%恶喹酸(oxolinic acid)用于防治火疫病,但也已经发现耐药菌株[47]。
为了解决耐药性的产生及抗生素污染环境等问题,可采用树干注射杀菌剂的方法来控制火疫病的发生。树干注射是一种目标精确的农药输送方法,直接将抗生素靶向植物木质部,可减少抗生素在环境中的污染量。树干注射调环酸(prohexadione carboxylic acid, PCA)能显著控制花中火疫病菌的侵染[48]。AĆIMOVIĆ 等[49]通过树干注射技术,将土霉素精准输送到植物体内,能有效控制火疫病菌在木质部与韧皮部薄壁组织之间传播,使苹果树发病率降低60%。
4.5 生物防治
为了减少耐药性的产生,近年来,研究人员不断寻找环境友好型、对人畜无害的代替控制策略。随着对火疫病微生物学及侵染生物学的深入研究,利用有益微生物对火疫病菌进行生物防治得到关注。目前,已有很多生防制剂在全球范围内被开发和销售,包括商品菌剂荧光假单胞菌(Pseudomonas fluorescens)A506、成团泛菌(Pantoea agglomerans)D325 和P10c、枯 草 芽 孢 杆 菌(Bacillus subtilis)QST713 及BD170。P.fluorescensA506 可使火疫病的花器发病率下降40%~60%,与农用链霉素的防治效果相当[53]。生防菌株禾谷假单胞菌(Pseudomonas graminis)49M在温室条件下的防治效果优于商业菌剂P.fluorescensA506 及草生欧文菌(E.herbicola)C9-1,且对植物组织无致病性,可开发为新的抗火疫病生物农药[54]。从花、叶中分离获得的内生菌E.herbicola89对花腐病的控制率高达70%,优于链霉素[55]。BAHADOU等[56]从摩洛哥发生过火疫病的寄主植物中分离出61 株内生菌,经田间试验证明,其中最有效果的是P.agglomeransACBP2、解淀粉芽孢杆菌(B.amyloliquefaciens)LMR2、耐盐芽孢杆菌(B.halotolerans)SF3 和SF4 及莫海威芽孢杆菌(B.mojavensis)SF16,可作为潜在的生防制剂来源。
拮抗是生防菌最重要的作用机制,内生菌P.agglomerans产生达苯二胺类抗生素——草欧菌素Ⅰ(herbicolinⅠ)和多肽抗生素——小菌素(microcin),均对火疫病菌有抑制作用[57]。生防杆菌FZB42 通过产生大环内酯类抗生素——聚酮达菲菌素(polyketide difficidin)与双肽杆菌溶素(dipeptide bacilysin)抑制火疫病菌的生长[58]。内生菌株HN89对火疫病菌、梨梢枯病菌(Pseudomonas syringaepv.syringae)和腐烂病菌(Valsa malivar.pyri)均有较强的抑制作用,抑菌谱广泛,具有一定的生物防治潜力[53]。火疫病菌可通过蜜蜂授粉传播而加重危害,利用“蜜蜂导向盒+生防菌”技术,让蜜蜂从出箱时就携带生防菌,使生防菌更好地在梨花上定殖和扩繁,以预防火疫病的发生[59]。
噬菌体是生物圈中最常见的病毒,可以特异性识别细菌宿主,在其体内繁殖并破坏细菌宿主。由此,噬菌体可以选择性杀死病原菌,且几乎不影响周围的微生物群落。SCHNABEL 等[60]从发生过火疫病的果园土壤中分离到50个噬菌体,并从中筛选得到一个能显著裂解火疫病菌的噬菌体FEa116C。在寻找新的噬菌体用于生物防治的过程中,一些“巨噬菌体”被鉴定出,这些噬菌体的基因组通常大于200 kb。巨噬菌体VB_EAMM_Y3含有一种信号捕获释放的内溶素(Y3_301),可诱导火疫病菌的裂解[61]。为了最大限度发挥噬菌体的生物防治潜力,GAYDER等[62]利用噬菌体之间的协同作用,将多个噬菌体组合来控制病原菌的生长,并创新性地将细菌拮抗剂P.agglomerans用作噬菌体载体,提前在花器的柱头、花梗表面传递和繁殖噬菌体,占领病原菌的侵染位点,抑制病原菌的生长繁殖,这对预防病原菌对噬菌体产生耐受性具有重要作用。
植物抗性诱导剂在广义上也是一类生防制剂,包括一系列化学物质及生物物质,可以诱导植物产生抗性,而本身不具有杀菌活性。调环酸钙(prohexadione-calcium,PhCa)是一种植物生长调节剂,可以抑制赤霉素生物合成的后期步骤,减缓枝条的生长速率[63]。研究发现,在苹果中使用PhCa来调控植物的营养生长可以降低火疫病的发病率及严重程度[64],主要的机制可能是PhCa 处理使细胞壁组织增厚,从而抑制病原菌在宿主细胞木质部和薄壁组织中迁移[65]。喷施PhCa 的浓度应根据树木的生育期而异,对于成熟的树木,在开花前可喷施125~250 mg/L PhCa,对于五年生以下的树木,可喷施62~125 mg/L PhCa,并在树木新梢期再喷施1次[63]。已知的另一种抑制赤霉素生物合成的化合物三乙酸三乙酯,可以延缓苹果的新梢生长,抑制火疫病的再侵染[66]。苯丙噻重氮(acibenzolar-Smethyl,ASM)是一种功能性水杨酸类似物,可以激活植物系统获得抗性,诱导防御反应的产生,包括病程相关蛋白的释放、活性氧的迸发[67],从而保护植物免受病原菌的侵害。已注册的商品制剂名为Bion和Actigard。研究表明:在苹果开花前1周喷施75 mg/L ASM,以后每周喷施1 次,可增强对火疫病的抵抗力[68];将ASM局部涂抹在紧邻主要修剪伤口下方30~45 cm 长的梨或苹果枝条组织上,可以减少火疫病的发生[69]。此外,研究者还将几种植物生长诱抗剂联合施用,以期达到最大的防治效果。AĆIMOVIĆ 等[70]评估了2 年内单独施用PhCa 或与ASM一起施用对火疫病的防治效果,结果表明,在多年生苹果树上接种火疫病菌后,每隔12 d 喷施125 mg/L PhCa和25 mg/LASM能使发病率降低69%。
反义抗菌剂是人工合成的RNA 同源物,具有与细菌必需基因翻译起始位点的反义序列,可以沉默病原菌中基因的表达,抑制病原菌的生长。由于可以精准靶向病原菌特定的DNA 序列,不容易产生耐药性等,反义抗菌剂现被广泛用于病害防治。PATEL 等[71]设计了一条针对必需基因acpP起始密码子区域的10 个核苷酸的肽核酸(peptide nucleic acid, PNA)寡聚体链,并借助细胞穿透肽(cell penetrating peptide,CPP)将PNA寡聚体输送到病原菌细胞中,可有效杀死病原菌,与链霉素的作用效果相当。
此外,抗菌肽也可用于火疫病的防治。抗菌肽可破坏病原菌的生物膜,由于其不像其他抗生素一样有特定的酶靶标,因此很难产生抗药性。BP100(KKLFKILKYL-NH2)是抗菌肽的一种,能够杀死E.amylovora且具有较低的植物毒性[72]。对火疫病菌有较高抑制和杀菌能力的抗菌肽还包括杀菌肽A-蜂毒素(cecropin A-melittin, CAM)杂合物(KWKLFKKIGAVLKVL-NH2)[73]。抗 菌 肽BP100与CAM 协同使用可以增加抗菌效力[74]。将抗菌肽与其他抗微生物活性的序列进行偶联也被广泛报道。如:抗菌肽BP100 与天然抗菌肽片段偶联,可获得比单个化合物抗火疫病菌活性更高的多肽化合物[75];抗菌肽BP16 对火疫病有中等的抗菌活性,在植物防御激发子多肽flg15 的C-端或N-端引入BP16可合成新的抗菌肽合成物BP358,能有效抑制病原菌的生长,表现出高于BP16 与多肽flg15 混合物的杀菌效率,与抗生素春雷霉素的防治效果相当[76]。
火疫病生防制剂及其防治效果的汇总见表2。

表2 火疫病生防制剂Table 2 Biological control agents for fire blight
5 展望
我国苹果和梨的栽培面积和总产量均居世界首位。近年来,火疫病的发生严重制约了梨和苹果产业的发展,对该病害的防控一直是业内关注的焦点。目前仍以化学防治为主,由于农用链霉素的使用一直有争议,仍需不断开发新的化学药剂以应对耐药性的产生,世界各国也正在积极寻找可代替链霉素来防治火疫病的措施。在这种情况下,了解病原菌的致病机制及寄主植物的抗性机制至关重要。现如今对E.amylovora的致病机制(如T3SS 及火疫菌素等)已取得了相当大的研究进展,但仍需进一步明确它们在复杂致病调控网络中的作用,尤其是火疫病菌效应子的植物靶标鉴定及其功能解析。对E.amylovora致病机制的进一步明析有助于设计更加精准的防控策略。培育和利用抗病品种是防控火疫病的最根本途径。目前对植物抗火疫病机制的了解尚不够深入,尽管一些抗性QTL 已被鉴定出来,但多限于苹果品种,且作用机制没有得到系统解析。另外需要注意的是,植物对火疫病的抗性属于多基因控制的微效基因抗性。因此,很多抗火疫病的单个QTL 作用非常有限。比如在‘Fiesta’和‘Florina’等苹果品种中发现的抗火疫病QTL 只针对毒性较弱的E.amylovora菌株。尽管如此,这些QTL 的聚合利用可以减缓E.amylovora对植物抗病性的克服作用,有助于实现持久广谱抗性育种的总体目标。在今后的工作中,需要拓宽寄主研究范围,挖掘更多抗性更强的主效QTL,并对这些抗性候选基因进行功能和机制分析,以培育出抗性强且稳定的抗性品种。
生物防治是绿色防控火疫病的重要途径,但目前市面上大多数生防拮抗菌的保护作用优于治疗作用,即主要用于预防病害的发生。在实际生产中,可将有机肥作为载体,配合施用生防制剂,以降低梨等蔷薇科植物暴发火疫病的风险。此外,噬菌体毒素对E.amylovora有强烈抑制作用,噬菌体疗法有望成为防治火疫病的方法之一。此外,一些新型抑菌技术也在研发中,如反义RNA 抗菌技术,以病原菌生长发育和侵染关键基因为靶序列合成反义RNA,施用后可通过抑制关键基因转录本积累或之后的翻译起到抑菌作用,但昂贵的合成成本以及易降解等特性限制了其在农业生产中的应用。
总之,对火疫病的防控,应实行“分类指导、分区治理、综合防控”的策略,加强全国范围内的病害调查和监测,特别是种植梨、苹果的优势产区。一旦发现火疫病,应采取严格的根除措施,因地制宜进行综合防控,阻止和延缓火疫病在全国的扩展,力争将火疫病的危害损失降到最低。

