RNA干扰技术在害虫防治中的应用及其安全性
汪芳,党聪,金虹霞,2,肖山,钟馥骏,方琦,姚洪渭,叶恭银*
(1.浙江大学农业与生物技术学院昆虫科学研究所,水稻生物学国家重点实验室/农业农村部作物病虫分子生物学重点实验室/浙江省作物病虫生物学重点实验室,杭州 310058;2.浙江大学图书馆,杭州 310058)
RNA 干扰(RNA interference, RNAi)最初在秀丽小杆线虫(Caenorhabditis elegans)中发现,之后被证实普遍存在于真菌、植物、昆虫等多种真核生物中。2007 年,科研人员将害虫双链RNA(doublestranded RNA,dsRNA)转入农作物,首次获得了基于RNA 干扰的转基因抗虫玉米和棉花,展示了RNA 干扰在害虫防治领域的巨大潜力[1-2]。本文对RNA 干扰技术的基本作用机制、RNA 干扰在农林害虫防治中的应用及安全性等进行了综述,为RNA干扰技术在害虫防治中获得更广泛的应用提供了一定的理论支撑。
1 RNA 干扰的原理
RNA 干扰是一种在生物体内高度保守的、由20~30个核苷酸(nucleotide,nt)组成的小分子非编码RNA 引发的基因沉默现象[3]。在昆虫等真核生物中,RNA 干扰是为了抵御外源核酸入侵或调节内源基因的一种自我保护机制,在这个过程中,有3类小分子非编码RNA发挥着重要作用,分别是干扰小RNA(small interfering RNA, siRNA)、微RNA(microRNA,miRNA)和PIWI 蛋白互作RNA(PIWIinteracting RNA,piRNA)[4]。
1.1 siRNA
siRNA 由体外导入或体内表达的dsRNA 切割而成。生物体内外源或内源的dsRNA 主要来自RNA 病毒侵染、转座子转录、基因组中反向重复序列转录等[5]。dsRNA 被核酸酶Dicer-2(ribonucleaseⅢ,RNaseⅢ)识别,并切割形成21~25 bp大小的小片段siRNA。Dicer-2中的PAZ结构域和RNaseⅢ结构域对siRNA的形成起到关键作用。PAZ结构域识别dsRNA 的末端,在核酸酶Dicer-2 的中心区域形成一个RNaseⅢ分子二聚体,对dsRNA进行切割,产生的siRNA 的3′末端悬挂2 个未配对碱基,5′末端具有磷酸腺苷。切割形成的siRNA与连接特异性核酸酶的Argonaute-2(Ago-2)蛋白结合形成RNA 诱导的沉默复合体(RNA-induced silencing complex,RISC),随后在RNA 解旋酶的作用下解链成2 条单链,其中一条链(引导链)的3′末端携带2 个未配对的碱基,可以引导其特异性切割靶标mRNA,进而影响靶标基因的翻译[6],另外一条链(过客链)则逐渐被降解。
在植物、线虫、真菌等真核生物中,一部分解旋的单链siRNA(包括引导链和过客链)在依赖于RNA的RNA 聚 合 酶(RNA-dependent RNA polymerase,RdRp)的作用下,以靶标mRNA 为模板,扩增形成新的dsRNA,进而将RNA 干扰的效应传递下去。但是在昆虫、软体动物和脊椎动物中不存在RdRp,因此,siRNA引起的沉默效应不能继续扩大[7]。
1.2 miRNA
与siRNA 不同,miRNA 主要来源于内源性基因,主要作用是调节内源基因的表达[8]。在细胞核内,一个或几个转录单元在RNA 聚合酶Ⅱ的催化下,形成了初级miRNA(primary miRNA, primiRNA)[9]。pri-miRNA是一类较大分子RNA,其中包含部分互补序列,可以形成茎环结构。
pri-miRNA在细胞核中被核酸酶RNaseⅢ家族(植物中叫作Dcl1,动物中叫作Drosha)所识别并切割,形成60~70 nt 的小分子前体miRNA(precursor miRNA,pre-miRNA),pre-miRNA再经过加工形成较为成熟的双链miRNA/miRNA*分子。成熟的双链miRNA/miRNA*分子3′末端悬挂有未配对碱基,5′末端也具有磷酸腺苷,进入到细胞质解旋后,miRNA与Ago-1蛋白结合形成RISC以抑制靶标基因,从而实现基因沉默,该过程在植物和动物中有所差异[8]。在植物中,Dcl1在细胞核中对pre-miRNA进行切割和加工,成熟双链miRNA/miRNA*分子经HASTY蛋白运输至细胞质中形成RISC,与靶标基因mRNA互补配对后实现对靶标基因的调控[10]。而在动物中,pre-miRNA先被核转运蛋白Exportin 5运送至细胞质中,然后经核酸酶Dicer-1 切割加工形成双链miRNA/miRNA*分子,RISC与靶标基因mRNA的3′端非翻译区(untranslated region,UTR)结合,降解靶标基因mRNA或抑制其翻译成蛋白质。但是这样的结合并不是完全互补配对的,只有miRNA的5′末端的第2—8个碱基与mRNA形成完全互补配对,该区域也被称为种子区域(seed region)[7-8]。
1.3 piRNA
piRNA 最初在动物中被发现,主要在生殖细胞中发挥功能[8]。目前对piRNA 的研究相对较少,与siRNA及miRNA有较大的不同,piRNA是起源于长单链RNA 前体的、长度为24~31 nt 的小分子非编码RNA,该RNA 的生成不需要Dicer 酶的参与,且不与Ago-1或Ago-2蛋白结合,而是与Argo蛋白家族中的PIWI 蛋白结合[4]。一个有效的piRNA 沉默复合体的形成需要几个PIWI 家族蛋白(如Aub、Ago-3蛋白等)共同参与,piRNA沉默复合体也可以通过DNA甲基化等方式调控基因的表达[11]。
piRNA 的产生主要通过初级加工途径和“乒乓循环”途径。在初级加工途径中,piRNA 从piRNA簇的基因组区域转录而来,经加工后与PIWI蛋白或Aub蛋白结合,以PIWI/piRNA沉默复合体的形式在细胞核中进行基因沉默[12]。初级piRNA与Aub蛋白结合后,以“乒乓循环”的方式进行扩增。在果蝇中,首先由初级途径产生的成熟piRNA与Aub蛋白在核周凝聚体结构区形成复合物,与靶向互补mRNA 相结合并进行剪切,形成新的piRNA 5′端。然后,Ago-3蛋白与沉默复合体剪切后的mRNA结合,剪切形成新的piRNA 3′端,在HEN1 甲基化酶的修饰作用下形成成熟的piRNA。接着,Ago-3 携带的piRNA 通过碱基互补配对识别互补的mRNA序列并剪切形成piRNA 5′端,不断往复循环,最后完成整个“乒乓循环”过程[13]。
2 RNA 干扰在害虫防治中的应用
2.1 RNA 干扰在昆虫基因功能研究中的应用
在昆虫中,RNA干扰技术最早被应用于黑腹果蝇(Drosophila melanogaster)的基因功能研究,KENNERDELL 等[14]将dsRNA 注入果蝇胚胎,发现相关基因的表达量受到显著抑制,表明可以通过dsRNA 注射开展昆虫基因功能的研究。RNA 干扰技术具有快速、高效等优势,已经成为昆虫学中研究基因功能的重要工具。截至2021年12月8日,在Web of Science(WOS)(https://www.webofscience.com/wos/woscc/basic-search)核心合集中检索关键词“insect”和“RNAi”,共获取2 747篇文献,对所有文献的关键词进行分析(图1)发现,昆虫RNAi的热点研究物种为果蝇(Drosophilaspp.)、赤拟谷盗(Tribolium castaneum)、褐飞虱(Nilaparvata lugens)、家蚕(Bombyx mori)及蚊等,研究的功能基因多集中于免疫(immunity)、保幼激素(juvenile hormone)、蜕皮激素(ecdysone)、生殖(reproduction)、几丁质(chitin)、卵黄原蛋白(vitellogenin)、细胞色素P450(cytochrome P450)等在昆虫生长发育中有重要作用的相关通路上。此外,昆虫的关键酶基因如几丁质酶基因(chitinase)、几丁质合成酶基因(chitin synthase)、海藻糖酶基因(trehalase)、谷胱甘肽硫转移酶基因(glutathione S-transferase)、囊泡ATP酶基因(V-ATPase)等也是昆虫RNAi的研究热点。

图1 Web of Science检索论文中昆虫RNAi的高频关键词Fig.1 High-frequency key words of insect RNAi from papers searched in Web of Science
通过注射和饲喂dsRNA 可以在许多昆虫中实现相关基因的沉默,这也是研究基因功能最常用的方法。为提高dsRNA 的合成效率、降低成本,以便获得大量dsRNA来满足饲喂需求,基于大肠埃希菌(Escherchia coli)的dsRNA 高效表达系统已被开发应用[15]。注射或饲喂miRNA 也可以实现对昆虫基因的沉默,如将miR-9b 类似物饲喂褐色橘蚜(Aphis citricidus)可显著降低其有翅后代的比例,而饲喂miR-9b抑制剂则可显著增加后代的有翅率[16]。
2.2 RNA 干扰在转基因抗虫作物研发中的应用
通过转基因的方法,在植物中导入表达昆虫干扰RNA的载体,表达的干扰RNA可以通过食物链进入昆虫体,从而实现相关基因的沉默,达到抗虫的效果[17]。2007年,研究人员将玉米根萤叶甲(Diabroticavirgifera virgifera)V-ATPase A基因的dsRNA转入玉米植株,该转基因玉米对玉米根萤叶甲产生了显著的抗性[2]。基于RNA干扰技术的转基因抗虫植物在模式生物烟草和拟南芥中的研究相对较多,同时,在水稻、玉米、小麦等重要农作物中也有转昆虫dsRNA的抗虫材料相继问世(表1)。在靶标基因选择方面,V-ATPase、chitinase、蜕皮激素受体基因(ecdysone receptor)等编码重要功能蛋白的基因是热门候选靶标。需特别指出的是,多个基于RNA干扰的转基因抗虫作物对刺吸式害虫(如桃蚜、麦长管蚜、烟粉虱等)表现出较好的抗性,而目前转苏云金芽孢杆菌(Bacillus thuringiensis,Bt)基因作物中对刺吸式害虫具有抗性的品系还相对较少,这也体现了基于RNA干扰的转基因抗虫作物的优势。为提高dsRNA在植物韧皮部汁液中的表达量,以增强其对刺吸式害虫的抗性,也有研究者使用韧皮部特异性启动子来构建转基因抗烟粉虱拟南芥[18]。此外,植物质体基因工程可以实现dsRNA在质体中的特异性高表达,进而在防治靶标害虫的同时尽可能地降低转基因作物的安全风险[19]。
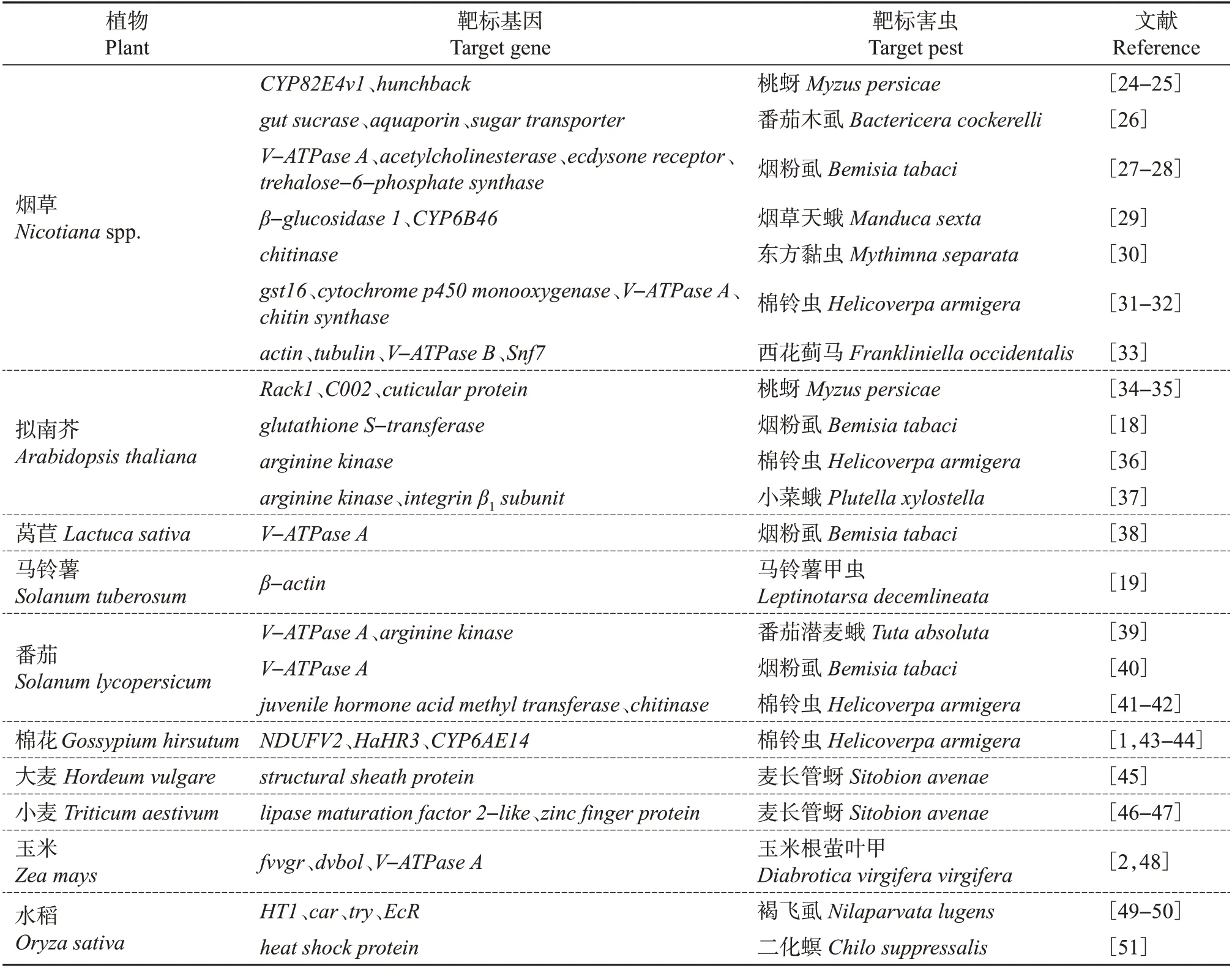
表1 基于RNA干扰技术的转基因抗虫植物汇总Table 1 Summary of transgenic insect-resistant plants based on RNAi technology
miRNA 也被用于转基因抗虫植物的培育。将棉铃虫miR-24 转入烟草,棉铃虫取食之后出现蜕皮失败,进而产生了较高的死亡率[20]。在水稻中表达二化螟miR-15显著延缓了二化螟的发育历期[21],转二化螟miR-14 或miR-260 的水稻同样表现出对二化螟较好的抗性[22-23]。
2.3 RNA 干扰在新型核酸杀虫剂研发中的应用
随着RNA干扰技术的逐渐成熟,新型核酸农药应运而生。新型核酸农药是外源干扰RNA制剂,其本质是一段单链或双链的RNA 分子通过一定的途径进入害虫体,使害虫相关基因发生沉默,最终达到控制害虫的目的。核酸农药因特异性强、高效、环境污染小等优势正逐渐成为新型农药研发的热点[52]。
在已报道的多个研究中,已经证实了dsRNA应用于杀虫剂的潜力。将小菜蛾(Plutella xylostella)乙酰胆碱酯酶基因AChE1和AChE2的6 段不同siRNA 喷施于甘蓝和芥蓝上,小菜蛾的死亡率显著升高[53]。将亚洲玉米螟(Ostrinia furnacalis)的一个富含甲硫氨酸的储藏蛋白基因SP的C端dsRNA喷洒至亚洲玉米螟和棉铃虫体表,2 种鳞翅目害虫的死亡率均显著升高[54]。马铃薯叶片可以吸收喷洒在其表面的马铃薯甲虫(Leptinotarsa decemlineata)Actin基因dsRNA 的水溶液,从而抑制了取食该叶片的马铃薯甲虫个体质量的增加[55]。拟南芥和水稻的根系浸泡在dsRNA 溶液中,可以将dsRNA 吸收进植株体内,并且经过害虫取食传递至害虫体内[56]。大肠埃希菌表达的dsRNA 与纳米载体星形阳离子聚合物(star polycation,SPc)制成的RNA喷雾剂,对桃蚜表现出较好的防治效果[57]。
目前,新型核酸杀虫剂的应用还遇到一些需要解决的实际问题,如寻找有效的dsRNA进入害虫体并发挥作用的传递方式,建立低成本、高效率的dsRNA合成方法,明确dsRNA的环境安全性等。随着这些问题的逐步解决,未来核酸农药将在害虫综合治理中发挥重要作用[58]。
3 RNA 干扰技术的安全性
尽管基于RNA 干扰的转基因作物具有巨大的应用前景,但是其可能产生的环境风险也需要进行严格评价。RNA 干扰的安全性问题主要集中在以下3方面:非靶标效应、靶标害虫的抗性、干扰RNA的环境持久性。
3.1 非靶标效应
RNA干扰的非靶标效应包括脱靶效应和非期望的基因沉默。RNA 干扰的沉默效果主要依赖于siRNA 与靶标基因mRNA 的特异性结合。然而,siRNA也可能与除靶标基因外的基因进行完全或部分互补配对,对这些非靶标基因产生影响,被称为脱靶效应。研究发现,将亲环素B基因(cyclophilin B)和地西泮结合抑制剂基因(diazepam-binding inhibitor)的siRNA 导入线虫细胞后产生了与靶标基因无关的细胞发育形态表型,这是由与siRNA序列互补度高的非靶标基因的沉默引起的[59]。TSCHUCH 等[60]报道发现siRNA存在8个碱基的互补配对就可能产生脱靶效应,也发现一些脱靶效应的出现源于siRNA 与该基因3′ UTR 区域的不完全互补配对。此外,外源干扰RNA进入昆虫体也可能使昆虫发生免疫应答反应,进而引起非序列特异性的脱靶效应。如对意大利蜜蜂饲喂绿色荧光蛋白基因(green fluorescent protein,GFP)的dsRNA 后,通过转录组测序发现意大利蜜蜂有多个基因表达发生变化,包括与来自GFP基因的siRNA 序列相似的基因和免疫相关基因[61]。王锦达[62]也发现了外源无关dsRNA的导入引起了赤拟谷盗免疫相关基因的脱靶效应。
同时,干扰RNA也可能会对靶标生物以外的其他生物造成影响,被称为非期望的基因沉默。BAUM 等[2]发现,对马铃薯甲虫饲喂玉米根萤叶甲V-ATPase A的dsRNA,前者也产生了显著的死亡率。有研究将玉米根萤叶甲Snf7基因的dsRNA饲喂13种非靶标昆虫,发现只有当非靶标昆虫的Snf7基因有连续21 nt与玉米根萤叶甲相同时才会对其产生影响[63]。与此类似,当玉米根萤叶甲dsRNA序列与一些瓢虫[如长足瓢虫(Hippodamia convergens)、异色瓢虫(Harmonia axyridis)、二星瓢虫(Adalia bipunctata)、七星瓢虫(Coccinella septempunctata)等]同源基因之间存在连续21 nt相同时,可以对这几种瓢虫产生不同程度的影响[64]。这些非靶标效应主要源于dsRNA切割形成的siRNA与非靶标昆虫之间的互补配对。随着dsRNA靶序列保守性的降低,可能产生的非靶标效应也会减少[58]。因此,降低RNA干扰中非靶标效应最直接的方法是通过生物信息学的序列比对和预测,设计较为安全的靶标来干扰RNA片段[65-66]。然而,也有一些研究报道表明,尽管靶标dsRNA 与非靶标生物同源基因存在多个连续21 nt匹配的情况,但是并没有对这些非靶标生物产生相关影响[67-69]。这也表明dsRNA的非靶标效应可能与靶标基因的种类、非靶标生物对RNAi的敏感性以及dsRNA 的暴露浓度有关系[69-70]。总之,dsRNA的非靶标效应需结合具体的dsRNA片段及具体非靶标生物进行个案评价。
3.2 靶标害虫的抗性
靶标生物对dsRNA 的抗性最早在线虫中被发现。研究者在实验室内观察到化学诱导的线虫突变体对几种生殖特异性基因的dsRNA产生了一定的抗性[71]。在害虫RNA干扰中,也有可能由于害虫种群内某些个体发生基因突变或者是靶标mRNA 的多态性等,该害虫对某一dsRNA 序列产生了抗性,从而导致RNA干扰技术用于害虫防治的效果下降[72]。玉米根萤叶甲连续取食表达其Snf7基因dsRNA 的转基因玉米后,对该转基因玉米产生了抗性,主要原因是玉米根萤叶甲中位于常染色体上连锁群4的点突变造成中肠对dsRNA 吸收能力发生变化,对Snf7基因dsRNA 产生抗性的玉米根萤叶甲种群对其他基因的dsRNA 也有一定抗性[73]。将马铃薯甲虫的V-ATPase A基因的dsRNA 涂于马铃薯叶片表面,连续饲喂9代后,马铃薯甲虫对该dsRNA产生抗性,同时该抗性种群也对COPI β基因的dsRNA 产生了一定抗性[74]。然而以V-ATPase A基因dsRNA的亚致死浓度(lethal concentration, LC)LC40和LC75连续饲喂黄瓜十一星叶甲食根亚种(Diabrotica undecimpunctata howardi),培养7代后这种叶甲对该dsRNA依然没有产生抗性[75]。这些研究说明靶标害虫对dsRNA 抗性的产生因害虫种类和dsRNA 片段不同而异。目前关于RNA 干扰的抗性研究较为有限,为了更好地将RNA 干扰技术应用于害虫防治中,需要加强此类研究。
3.3 干扰RNA 的环境持久性
当RNA干扰技术应用于田间害虫防治时,需要考虑外源干扰RNA在环境中保持活性的时间,以判断外源干扰RNA 的环境安全性。通过核酸定量检测和昆虫生物学测定,有研究证明玉米根萤叶甲Snf7基因dsRNA 在不同的土壤或水生环境中可以快速降解,在2 d以后不再具有生物活性[76-77]。在实验室条件下,喷施至植物叶片上的dsRNA溶液具有5~7 d 的抗病毒活性;在模拟雨天环境下,dsRNA在24 h 左右就无法被检测出[78]。也有研究报道dsRNA 在紫外线照射1~2 h 后就不再具有活性[55]。因此,暴露在田间环境条件下dsRNA的持久性不会太长。但是,干扰RNA 在应用时进行的改造(如转基因植物、纳米材料包裹等)可能会影响其降解动力学[77],因此,对每一个应用的干扰RNA 片段进行严格的环境持久性评价是必不可少的。
4 小结与展望
农作物的绿色、高产、稳产对于我国粮食安全至关重要,RNA干扰技术由于其高特异性和低环境污染性可以为农作物害虫防治提供新的思路和途径。运用RNA干扰技术研究昆虫基因功能,可以作为筛选害虫防治作用靶标基因的重要手段,筛选获得的候选基因可为培育基于RNA 干扰技术的转基因抗虫作物及开发新型核酸农药奠定重要基础。随着越来越多的功能基因被解析,未来RNA干扰技术将会在害虫防治中发挥更大作用。但是,其应用前的安全性风险不容忽视。目前围绕新型RNA 转基因作物及核酸农药的安全性评价体系尚不完善,建议在研发新型害虫防治手段的同时,加强其相关安全性研究,并建立相关安全性评价的标准和指南。

