基于miRNA-mRNA调控网络筛选与验证参与Graves病B细胞增殖的关键基因①
王 玮 杨 倩 王 凯 钟惠敏 潘凡凡 查兵兵
(复旦大学附属上海市第五人民医院内分泌科,上海200240)
Graves病(Graves'disease,GD)是甲状腺功能亢进症的最常见类型,发病率为1.0%~1.5%,且逐年上升[1]。体液免疫与GD发病紧密相关,促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAb)与甲状腺上皮细胞表面的促甲状腺激素受体(thyrotropin receptor,TSHR)结合,刺激甲状腺上皮细胞过度增生,使甲状腺激素分泌失控,导致疾病发生[2]。
B细胞是体液免疫重要的执行者,与GD的发生、发展息息相关。B细胞不仅可以分化为浆细胞分泌致病性抗体TRAb,还能作为抗原提呈细胞将TSHR的抗原表位呈递给T细胞。尽管B细胞在GD的发病机制中起着至关重要的作用,但GD中B细胞的基因表达谱尚不清楚,对其表达谱的研究有望为治疗GD病提供新靶点。
miRNA是一种长度为18~25个核苷酸的小分子非编码RNA,能够靶向识别mRNA的3'端非编码区的特异性结合位点,直接降解mRNA或抑制其翻译,从而调节基因的表达[3]。miRNA在自身免疫性疾病中发挥重要作用,如自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)、类风湿关节炎、系统性红斑狼疮等[4-6]。多项数据表明GD中miRNA的表达异常可能参与疾病的发生发展[7-9]。LIU等[7]发现初发GD患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中miR-154、miR-376b和miR-431表达下调。YAMADA等[8]发现GD患者血清中miR-16、miR-22、miR-375和miR-451表达上调。QIN等[9]通过对GD患者和健康对照组的甲状腺组织进行微阵列分析,发现GD患者的甲状腺组织中共有23种miRNA异常表达,导致超过2 000种mRNAs表达失调。miRNA与GD的研究是目前的研究热点,但对miRNA与GD患者外周血B细胞的研究比较少见。
因此,本项研究采用微阵列技术比较初发GD患者和健康受试者外周血B细胞中miRNA和mRNA表达谱的差异,揭示其异常表达与GD之间的关系,并通过qRT-PCR和流式细胞术对mRNA和蛋白水平进行验证。研究发现GD患者外周血B细胞中hsa-miR-146b-5p的下调可能是其发病的潜在机制,下调的hsa-miR-146b-5p可能通过上调CD79B促进B细胞活化与增殖从而促进GD的发生发展。
1 资料与方法
1.1 资料
1.1.1 一般资料41例初次发病且未经治疗的GD患者外周血取自2016年至2022年上海市第五人民医院内分泌科。GD患者入组标准:①高代谢症候群;②促甲状腺激素(thyroid stimulating hor‐mone,TSH)水平降低,游离三碘甲状腺原氨酸(free triiodothyronine,FT3)和游离甲状腺素(free thyrox‐ine,FT4)水平正常/升高;③甲状腺弥漫性肿大;④甲状腺吸碘率升高。排除标准:①近期接受免疫抑制剂或糖皮质激素者;②应激状态;③妊娠期或哺乳期妇女;④合并心脑血管疾病、肝肾功能衰竭者;⑤合并严重感染及其他自身免疫性疾病者。41例健康受试者外周血取自上海市第五人民医院体检中心2016年至2022年既往无甲状腺疾病、年龄和性别相匹配的健康受试者。所有试验对象均自愿参加本研究并签署知情同意书。本研究经上海市第五人民医院伦理委员会批准,伦审批件号:2017-
029。
1.1.2 试剂 甲状腺功能和甲状腺抗体试剂购自Roche Diagnostics公司;人淋巴细胞分离液Lympho‐prepTM购自Axis-Shield公司;Human BD Fc BlockTM购自BD Biosciences公司;流式抗体购自Biolegend公司;人B细胞分选试剂盒购自Miltenyi Biotec公司;RNAsimple总RNA提取 试剂盒、miRNA提取 试 剂盒、miRcute增强型miRNA cDNA试剂盒购自TIAN‐GEN公司;PrimeScriptTMRT reagent试剂盒、PCR试剂盒购自TaKaRa公司。
1.2 方法
1.2.1 甲状腺功能和甲状腺抗体检测 所有试验对象检测前禁食12 h,于第2天清晨6:00抽血送检,无抗凝剂样本采集后,静置1 h离心、分离血清,检测指标包括FT3(参考范围:3.10~6.80 pmol/L)、FT4(参考范围:12.0~22.0 pmol/L)、TSH(参考范围:0.27~4.20 mU/L)、抗甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)(参考范围:0~34.0 U/ml)、抗甲状腺球蛋白抗体(thyroglobulin antibody,TGAb,参考范围:0~115.0 U/ml)和TRAb(参考范围:<1.75 U/L)。甲状腺功能和甲状腺抗体经电化学发光免疫法测定。
1.2.2 PBMC分离 生理盐水等体积稀释人外周血,将稀释后血缓慢滴入人淋巴细胞分离液Lym‐phoprepTM上层,根据密度梯度离心法提取PBMC。
1.2.3 流式细胞术法 向PBMC中加入Human BD Fc BlockTM,室温孵育10 min,使其与细胞表面Fc受体结合,以阻断流式抗体Fc段与细胞表面Fc受体的非特异性结合;加入anti-human CD19抗体或anti-human CD19抗 体 和anti-human CD79B抗体进行表面染色,4℃避光孵育30 min,随后加入适量PBS离心洗去除未与细胞结合的流式抗体,加入500 µl PBS重悬细胞。使用Beckman counter CyAn流式细胞仪分别检测CD19+B细胞比例和CD19+B细胞表面CD79B细胞荧光强度。使用FlowJo V10软件分析数据。
1.2.4 B细胞纯化和RNA提取 向健康受试者和GD患者外周血的PBMC中加入PE-conjugated anti-CD19抗体和anti-PE微珠阳性分选得到CD19+B细胞,流式细胞术验证其纯化效率>90%。使用RNA‐simple总RNA提取试剂盒提取获得CD19+B细胞总RNA;使用miRNA提取试剂盒提取获得CD19+B细胞miRNA。
1.2.5 差异表达miRNA与mRNA筛选 取健康受试者和GD患者外周血各3份,根据密度梯度离心法提取PBMC,随后进行B细胞纯化和RNA提取。使用Affymetrix WT PLUS Reagent Kit对总RNA进行扩增、标记和纯化以获得cRNA,GeneChip Kit对生物素标记的cRNA进行杂交和洗涤。使用Affymetrix GeneChip Scanner 3000对芯片结果进行扫描,Com‐mand Console Software 3.1软件读取原始数据以及归一化处理,所用算法为Gene level_SST_RMA,Transcriptome Analysis Console软件对差异表达基因进行分析。以|log2(fold change)|≥2.0且P<0.05为条件筛选差异表达的miRNA和mRNA。
1.2.6 差异miRNA靶基因预测 利用TargetScan(http://www.targetscan.org/)、miRBase(http://www.mirbase.org/)等数据库对差异miRNA的靶基因进行预测。
1.2.7 靶基因的选取、miRNA-mRNA网络构建以及靶基因蛋白互作分析 将1.2.6得到的差异miRNA靶基因与1.2.5得到的差异mRNA取交集,筛选出miRNA的靶基因。将靶基因与对应的差异miRNA以及差异表达倍数等导入Cytoscape软件中构建miRNA-mRNA差异表达网络。通过geneMA‐NIA数据库对靶基因进行蛋白互作分析。
1.2.8 GO富集分析 采用R包cluster profiler对miRNA的靶基因交集进行GO富集分析。
1.2.9 qRT-PCR使用PrimeScriptTMRT reagent试剂盒将总RNA逆转录为cDNA;使用miRcute增强型miRNA cDNA试剂盒将miRNA逆转录为cDNA。使用qRT-PCR试剂盒验证GD病患者外周血B细胞中差异表达的miRNA和mRNA。应用ΔΔCt法处理数据。所有引物由上海生工生物有限公司合成和纯化,引物序列见表1。
1.3 统计学处理 所有数据采用SPSS22.0软件和GraphPad Prism 8.0软件分析,正态分布数据用±s表示,组间比较采用t检验,非正态分布数据用M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。P<0.05时认为差异有统计学意义。
2 结果
2.1 GD患者和健康受试者临床资料 本研究共纳入GD患者和健康受试者各41例。GD患者中女性28例,男性13例,中位年龄36岁,临床指标检测结果见表2。
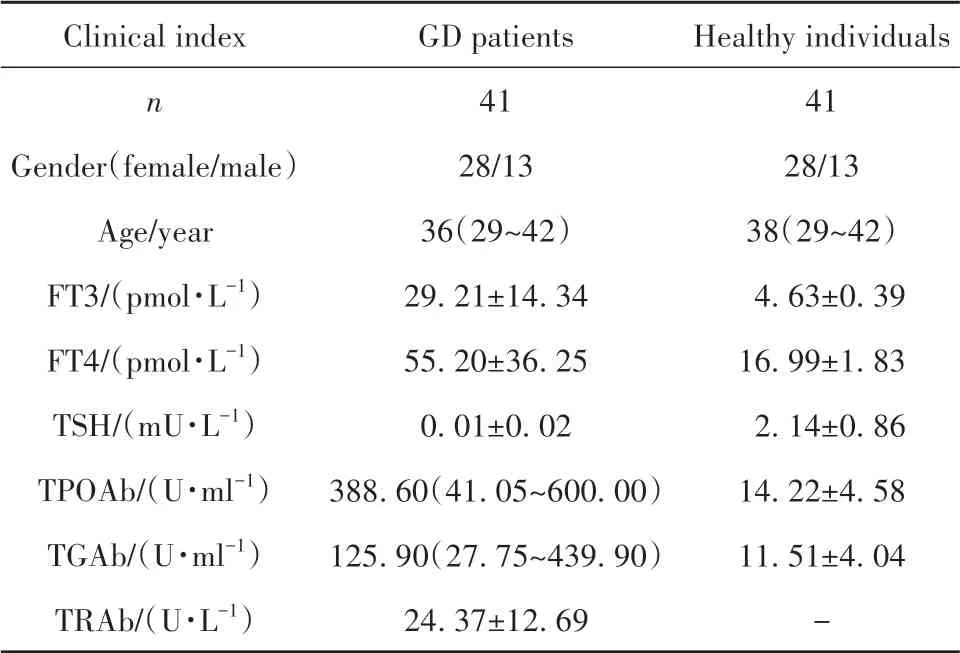
表2 临床资料Tab.2 Clinical features
2.2 GD患者外周血CD19+B细胞比例升高 与健康受试者相比,GD患者外周血中CD19+B细胞比例显著升高(3.46%vs7.77%,P<0.000 1,图1)。

图1 GD患者PBMCs CD19+B细胞比例升高Fig.1 Percentages of CD19+B in PBMCs was increased in GD patients
2.3 GD患者外周血B细胞中miRNA和mRNA差异表达谱 为揭示GD中B细胞异常增加的机制,对3例GD患者和3例健康受试者外周血CD19+B细胞中差异表达的miRNA和mRNA进行分析。以|log2(fold change)|≥2.0且P<0.05作为差异miRNA和mRNA的筛选标准,共筛选出119个差异miRNA,其中73个在GD组上调,46个在GD组下调(图2A);共筛选出572个差异mRNAs,其中399个在GD组上调,包括CD3D、CD5、CD2、CD79B、IL2RA等,173个在GD组下调(图2B)。
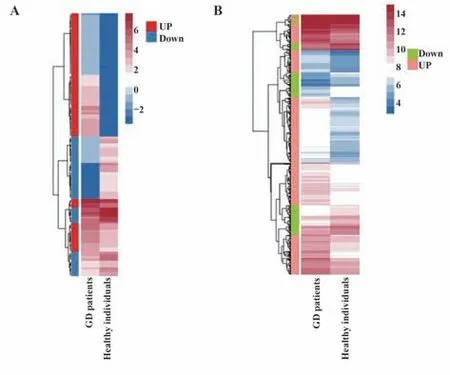
图2 GD患者和健康受试者外周血B细胞miRNA和mRNA差异表达谱Fig.2 Differential miRNA and mRNA expression profiles in B cells between healthy individuals and GD pa⁃tients
2.4 差异miRNA潜在靶基因预测及其功能富集分析 利用TargetScan等多个数据库对119个差异miRNA进行潜在靶基因预测,并与2.3所述的差异mRNAs取交集,获得152个靶基因。筛选获得的靶基因包括CD79B、CD3D、CDR2以及IL2RA等。对靶基因进行GO富集分析,结果显示靶基因的生物学过程主要富集于免疫反应及其调控中(图3A),包括免疫应答、细胞因子分泌以及粒细胞迁移等。进一步对上调靶基因进行GO富集分析,结果显示上调靶基因的生物学过程主要富集于免疫系统的调控(图3B),主要包括免疫系统调控、胞内信号转导以及免疫系统正向调控等。对富集最为集中的几个生物学过程进行回溯分析,发现这些生物学过程均与CD79B、IL2RA以及FOSB等基因紧密相关。
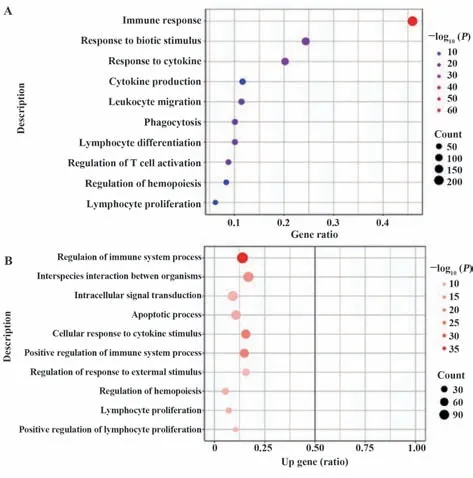
图3 差异表达基因GO富集分析Fig.3 GO enrichment analysis of differentially expressed genes
2.5 GD患者外周血B细胞中差异表达mRNA验证及蛋白互作分析 对筛选得到的152个靶基因进行B细胞增殖相关基因的筛选,结果显示mRNA表达谱中CD79B水平显著上调。同时,将152个靶基因进行蛋白互作分析,发现包括CD4、CD79B以及CD44等29个上调的靶基因出现于网络核心位置中(图4A)。因此推测CD79B可能是B细胞发挥功能的关键分子。通过qRT-PCR对7例GD患者和7例健康受试者外周血B细胞中CD79B mRNA进行验证;通过流式细胞术对13例GD患者和13例健康受试者外周血CD19+B细胞中CD79B进行验证。结果显示与健康受试者相比,GD患者外周血CD19+B细胞中CD79B mRNA表达显著上调(P<0.01,图4B),且CD79B荧光强度显著上调(P<0.01,图4C)。对GD患者外周血CD19+B细胞中CD79B蛋白水平与其甲状腺功能(FT3、FT4)和自身抗体(TPOAb、TGAb、TRAb)进行相关性分析,结果显示CD79B与FT3(r=0.51,P>0.05)、FT4(r=0.58,P>0.05)、TPOAb(r=0.38,P>0.05)、TGAb(r=0.11,P>0.05)和TRAb(r=−0.13,P>0.05)均无相关性。
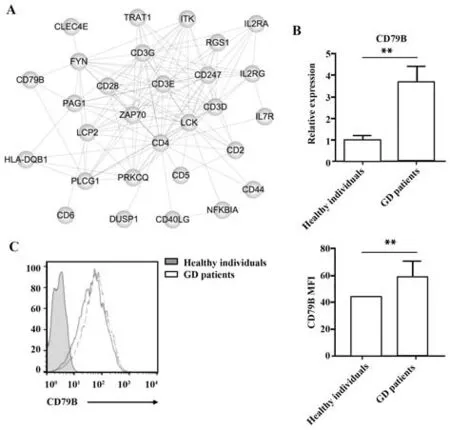
图4 qRT-PCR和FACS验证mRNAFig.4 mRNA was verified by qRT-PCR and FACS
2.6 GD患者外周血B细胞中差异表达miRNA验证 探究靶向CD79B的关键miRNA,对CD79B靶miRNA进行预测,结 果 显 示:9个miRNAs可调控CD79B,分别为hsa-miR-4726-5p、hsa-miR-650、hsamiR-6085、hsa-miR-4430、hsa-miR-146a-5p、hsa-miR-378i、hsa-miR-146b-5p、hsa-miR-378a-3p和hsa-miR-31-5p(图5A)。根据表达量高低对这9个miRNAs进行排序,并选取表达量最高的4个miRNAs进行验证,即hsa-miR-6085、hsa-miR-146a-5p、hsa-miR-146b-5p和hsa-miR-378a-3p(图5B)。通过qRT-PCR对7例GD患者和7例健康受试者外周血B细胞中miRNAs进行验证,结果显示,与健康受试者相比,GD患者外周血CD19+B细胞中hsa-miR-146b-5p表达显著下调(P<0.001,图5C),而hsa-miR-6085、hsamiR-146a-5p和hsa-miR-378a-3p表达无明显差异(P>0.05,图5C)。对GD患者外周血CD19+B细胞中hsa-miR-146b-5p与其甲状腺功能和自身抗体进行相关性分析,结果显示:hsa-miR-146b-5p与FT3(r=0.11,P>0.05)、FT4(r=0.25,P>0.05)、TPOAb(r=−0.39,P>0.05)、TGAb(r=−0.11,P>0.05)和TRAb(r=−0.14,P>0.05)均无相关性。利用Tar‐getScan数据库对miRNA调控CD79B的靶点进行预测,发现hsa-miR-146b-5p可靶向CD79B mRNA的3'端非编码区211~217号位点,即UCAAGAG与AGUUCUC互补,提示CD79B是hsa-miR-146b-5p的潜在靶点(图5D)。因此推测hsa-miR-146b-5p可能通过靶向CD79B调控B细胞的功能。
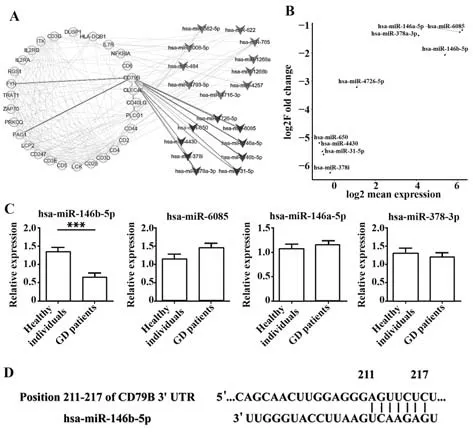
图5 qRT-PCR验证miRNAFig.5 miRNA was verified by qRT-PCR
3 讨论
GD是体液免疫介导的AITD,伴随B细胞的数量和功能异常[10]。本课题组既往研究发现,与健康受试者相比,GD患者甲状腺组织中CD20+B细胞浸润显著升高[11]。本研究与健康受试者相比,初发GD患者外周血CD19+B细胞的比例显著升高。早在20世纪80年代,MORI等[12]研究发现与健康受试者相比,GD患者外周血B细胞比例和计数均明显提高;而经药物治疗后甲状腺功能正常的GD患者外周血B细胞的比例和计数无显著差异。以上数据证实了GD中B细胞异常活跃。虽然GD的研究越来越多,但导致B细胞异常的分子机制并未明确。
近年关于miRNA和GD的生物信息学研究越来越多,多数是对PBMC、T细胞、血清、血浆和甲状腺组织的研究,很少对外周血纯化的B细胞进行研究[7-8,13-15]。本研究通过微阵列分析初发GD患者和健康受试者外周血B细胞中miRNA和mRNA的差异表达谱,鉴定出GD患者外周血B细胞中有119个差异表达的miRNAs和572个差异表达的mRNAs,发现hsa-miR-146b-5p可能通过靶向CD79B调控B细胞的功能进而影响疾病进展,hsa-miR-146b-5p和CD79B与初发GD的疾病状态无相关性。
过去几十年里,常规GD方案一直未变,且不能满足临床需求。近些年来,随着科研工作者对GD的深入研究,使用针对B细胞的单克隆抗体治疗GD已经进入临床试验并取得了一定成果,如抗CD20单抗和抗CD40单抗[16-17]。这些临床试验的开展表明针对B细胞的免疫疗法是目前治疗GD的热点。CD79B(Igβ)是 一 种35~40 kD的 跨 膜 蛋 白,与CD79A(Igα)形成异二聚体,CD79A/CD79B(Igα/Igβ)异二聚体与膜表面免疫球蛋白相联,形成B细胞受体(B cell receptor,BCR)复合物[18]。BCR复合物识别特定抗原并传递第一信号,参与B细胞活化,活化的B细胞在抗原的刺激下增殖,进一步分化为浆细胞和记忆B细胞发挥体液免疫效应[18-19]。因此推测CD79B的表达上调促进B活化,最终促进GD患者外周血B细胞异常增殖。利用CD79B靶向药物治疗弥漫性大B细胞淋巴瘤已进入临床试验,2019年首款CD79B靶向抗体偶联物Polatuzumab Vedotin治疗弥漫性大B细胞淋巴瘤已在美国上市[20-21]。以上临床进展表明通过阻断CD79B抑制B细胞功能从而治疗疾病的前景光明。不久的将来,CD79B也可能成为治疗GD的新靶点。
miR-146家族包括miR-146a和miR-146b,参与免疫系统调节和与自身免疫性疾病的发生[22]。有研究报道,miR-146在自身免疫性甲状腺炎小鼠的甲状腺和脾脏CD4+T细胞中上调表达;miR-146a在GD眼病的血清中表达下调;而在桥本甲状腺炎的甲状腺组织中表达上调[23-25]。通过对CD79B对应miRNA的预测和验证,发现GD患者外周血B细胞中hsa-miR-146b-5p表 达 下 调,CD79B是hsa-miR-146b-5p的潜在靶点,两者的靶向关系需要Lucifer‐ase进一步验证。因此,本课题组推测hsa-miR-146b-5p的下调可能促进CD79B水平上调,引起B细胞活化,最终使GD外周血B细胞异常增殖。
综上所述,本研究通过微阵列对GD患者外周血miRNA和mRNA异常表达谱分析和验证得出,hsa-miR-146b-5p和CD79B在GD患者外周血中异常表达。hsa-miR-146b-5p可能通过上调CD79B促进GD外周血B细胞的活化,CD79B可能成为GD新的生物标志物和治疗的潜在靶点。但本研究也存在不足之处,后续需要通过luciferase确定hsa-miR-146b-5p是否直接调控CD79B。

