基于临床和放射特征的列线图:非侵入性预测低级别胶质瘤患者的1p/19q染色体共缺失突变*
康兆庭 杨 田 柴 军,* 张晓琴 李俊林
1.内蒙古自治区人民医院医学影像科 (内蒙古 呼和浩特 010000)
2.内蒙古自治区综合疾病预防控制中心 (内蒙古 呼和浩特 010000)
在全球数百万中枢神经系统 (CNS) 的肿瘤中,胶质瘤是脑部最常见的原发性肿瘤,占比超过 90%[1]。2016年世界卫生组织 (WHO) 根据其侵袭性将WHO II级(低级)和III级(间变性)弥漫性胶质瘤统称为低级胶质瘤(LGGs),其特点是具有广泛的恶性潜能,主要好发于年轻人,约占胶质瘤的 30%[2];LGG 是一种潜在的致命疾病,中位总生存期约为 7 年[3]。
在诊断为 LGG 的患者中早期检测1p/19q 共缺失突变具有重要意义,1p/19q 共缺失突变LGG 的患者在化疗和放疗方面更敏感,并且生存时间显着提高[4-6],这可以促进患者的短期和长期管理。
临床通过检测脑组织活检或肿瘤手术切除收集病理样本,来识别 1p/19q 共缺失突变。然而,其中包含许多潜在风险[3,7-8],而且活检样本不能代表整个肿瘤[4,8]。
放射基因组学(Radiomics)是近年来发展起来的一种非侵入性定量提取成像特征并与具有临床意义的表型、基因组、蛋白质组数据和预后价值关联的高通量分析方法。这些量化的成像特征可用于疾病诊断、治疗决策和进一步临床疗效评估[4,9-10]。自精准医疗和个性化医疗问世以来,放射基因组学应用机器学习 (ML) 方法作为有前途的工具受到了极大的关注[3,11]。然而,大多数模型的性能在外部测试集上仍然不稳定,准确度得分在 0.68 到 0.93 之间,并且多数模型存在各种条件下的可重复性欠佳的局限性[4,12-16]。
本研究的主要目的是开发和验证一种非侵入性方法,使用利用最小绝对收缩和选择算子(LASSO)方法构建和验证基于T2加权和T1加权对比增强后MRI放射特征和临床特征的列线图,来术前区分1p/19q 缺失突变状况。
1 资料与方法
1.1 数据数据选取癌症影像档案 (TCIA) 中关于LGG-1p19q 缺失数据[4,17-18],其为公共数据无需知情同意。训练数据集由 159 名具有术前 MRI 图像和经活检证实的 1p/19q 状态的 LGG 患者组成。验证数据集由 50 名随机选择相似患者数据组成,这些患者也来自 TCIA,但在 TCGA-LGG 数据集中[18-19]。对于 TCGA,验证数据集的 1p/19q 状态源自先前基于此数据集的研究[20]。根据以下纳入标准选择患者:切片厚度≤7.5mm的检查,具有3年经验的放射科医生目测评估的包含总肿瘤体积(GTV)的切片中的伪影少于 50%,以及 T2加权和T1加权增强图像和 1p/19q 状态的存在。GTV 由一位放射科医师(RC)使用 3D Slicer 软件描绘。
1.2 图像预处理和放射组学特征提取为了在一定程度上考虑机器间的变异性,Z 分数归一化应用于每个图像系列(每位患者)中的 GTV。使用三次插值进行特征提取之前执行体素大小重采样。图像被重新采样为 3 × 3 × 3 mm3的体素大小;三次样条和卷积插值是三阶方法,它们通常比线性方法插值更平滑的表面,但众所周知它们的实现速度较慢[21]。为了减少噪声和计算负担,所有 MRI 检查的灰度值被聚合到相同数量的 bin(50 个 bin)中。由于强度单位在 MRI 中不是绝对的,因此使用固定 bin 数方法来实现更好的归一化效果[22]。使用 3Dslicer提取符合国际生物标志物标准化倡议 (IBSI) 的 Radiomics 特征以及非 IBSI 特征。
提取的放射组学特征包括五个主要组:(1)分形特征,(2) 一阶统计,(3) 形状和大小,(4) 纹理描述符,包括灰度共生 (GLCM)、灰度行程矩阵 (GLRLM) 和灰度区域大小矩阵(GLSZM),(5)小波分解后来自第 1、3 和 4 组的特征。GLCM 距离为 1。
1.3 特征选择基于放射特征的预测模型构建与统计分析本研究基于从训练队列中选择的特征构建了放射特征模型。Z-score 在特征选择之前应用于特征归一化。用关联特征选择(correlation-based feature subset,CFS)、最大相关最小冗余(mRMR)进行特征筛选,最小绝对收缩和选择算子(LASSO)用于选择特征。首先第一步,先后执行CFS和mRMR以消除冗余和不相关的特征。其次,LASSO用于通过惩罚参数调整和基于最小标准的 10 倍交叉验证来选择最有用的特征。LASSO包括选择常规参数 λ 来确定特征的数量。在确定特征数量后,选择最具预测性的特征子集,并评估相应的系数。大多数放射学特征的系数降低到零,并且选择了具有非零系数的剩余放射组学特征。接下来,本研究建立了一个具有选定放射组学特征的模型。通过由其各自系数加权的所选特征的线性组合为每个患者计算放射组学评分(Radscore)。Radscore 的最终公式如下:

此外,使用 L1 正则化的逻辑回归来选择训练队列中的独立临床预测因子。建立了结合放射组学特征和临床变量的列线图预测模型。我们在训练队列中基于多变量逻辑回归模型构建了列线图,并开发了接收者操作特征(ROC)曲线来评估列线图的辨别能力。此外,决策曲线分析 (DCA) 用于通过量化不同阈值概率下的净收益来确定预测模型的临床实用性。DCA 通过真阳性率和假阳性率之间的差异来估计模型的净收益,该差异由所选阈值风险概率的几率加权[23-26]。
1.4 统计分析使用 SPSS(版本 25.0,IBM)和 R 统计软件(版本 3.3.3,https://www.r-project.org)进行统计分析。采用单变量分析比较两组临床因素的差异,分类变量采用卡方检验或Fisher精确检验,连续变量采用Mann-Whitney U检验。“glmnet”包用于执行 LASSO 回归模型分析。使用“pROC”包绘制 ROC 曲线以评估模型的诊断效率。然后计算 ROC 曲线下面积 (AUC)。使用“rms”包执行多元二元逻辑回归。通过结合显着的特征特征和放射学特征来建立列线图。P<0.05 被认为是显着的。
1.5 TRIPOD 和 Radiomics 质量评分本研究遵循个体预后或诊断多变量预测模型透明报告 (TRIPOD) 的指导,并使用放射组学质量评分 (RQS) 来评估放射组学工作流程[21,27-28]。该特定研究的 RQS 得分为44%。RQS 最高分数为100%,基于36分制;高值表明研究和报告的方法质量更高[27]。
1.6 临床效用指数(CUI)CUI 于 2007 年开发,是诊断测试在临床实践中的有用程度,为从传统的敏感性、特异性、ROC 评价中无法明确信息。CUI取决于三个主要因素:辨别力、发生率和可接受性[29-30]。为在外部验证数据集上测试列线图模型计算临床效用指数。CUI 的取值范围为 0 到 1:效用优秀(CUI ≥ 0.81)、效用良好(CUI ≥ 0.64)、效用满意/一般(CUI ≥ 0.49)、效用差(CUI ≤ 0.49)和效用非常差(CUI ≤ 0.36)[30]。阳性 CUI 公式是灵敏度 x 阳性预测值,它衡量测试的病例发现(确认)能力;阴性CUI 公式是特异性 x 阴预测值,它衡量测试的筛选(排除)能力[30]。
2 结果
2.1 数据
2.1.1 训练数据集 在 LGG-1p19q数据中确定了 159 名连续的 LGG 患者,这些患者在 2002 年 1 月 10 日至 2011 年 1 月 9 日之间收集了术前 MRI 图像,活检证实为 1p/19q 状态数据包括 102 名共缺失 1p/19q 组的患者和 57 名非共缺失组的患者。LGG 病变的等级为Ⅱ(n=104) 和Ⅲ(n=55)。LGG 的类型为少突星形细胞瘤(n=97)、少突胶质细胞瘤 (n=45) 和星形细胞瘤 (n=17)。中位年龄为 42 岁(范围13~84岁),该数据集包括76名女性和 83 名男性。所有选定的患者都可以获得T1对比增强和T2加权图像。所有图像均使用1.5或3T扫描仪采集,切片厚度范围为1至7.5mm,轴向平面中的各向同性像素大小范围为 0.43 至 1.09 mm。
2.1.2 外部验证数据集 从 TCGA-LGG 数据集中随机选择 50 名(n=50)名患者,同时保持结果平衡。1p/19q 状态是由 Chia Feng Lu al.研究确定的[4],使用相同的数据集。该验证数据集包括 25 个未缺失和 25 个共同缺失的 LGG。LGG的等级为Ⅱ(n=29)和Ⅲ(n=21)。LGG 的类型是少突星形细胞瘤(n=14)、少突胶质细胞瘤(n=28)和星形细胞瘤(n=8)。中位年龄为46岁(范围20~74 岁),其中包括22名女性和28名男性。所有选定的患者都可以获得T1对之前 和T2加权图像。所有图像均采用1.5T或3T扫描仪(未报告 5 名患者的磁场),切片厚度范围为0.9mm 至7.5mm,轴向平面各向同性像素大小范围为0.39至1.02mm。
在训练和训练集之间没有观察到性别(训练集 M/F=1.1 与验证集 M/F=1.3)和 WHO 等级(训练集 Ⅱ/Ⅲ=1.9 对比 Ⅱ/Ⅲ=1.4)的显着差异。验证集组织学和年龄存在显着差异(训练组平均年龄46.5岁,验证组平均年龄41.6岁)。卡方检验和 Mann-Whitney 检验(年龄比较)的显着性水平为 α=0.05。人口统计和临床数据描述(见表1) 。
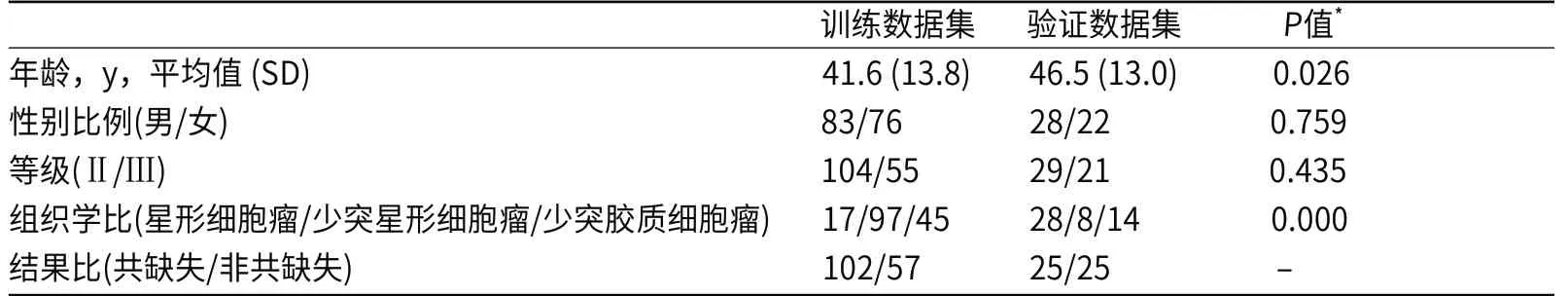
表1 数据说明
2.2 放射学特征构建、验证和评估总共从T1和T2加权图像中提取了每位患者的5352个放射组学特征;使用三次插值体素重采样方法提取的2676个放射组学特征。在选择特征之前,有必要解决数据不平衡问题。本文使用了合成少数过采样技术(SMOTE)[31]。SMOTE 帮助从数据集中的每个类中选择少数实例,并在实例之间生成一个合成点,以使类更加平衡。在这项研究中,SMOTE 可以解决训练集上的低特异性。在应用CFS算法后,然后使用mRMR来选择与1p/19q 共缺失突变高度相关且没有冗余的特征,总共保留了 20个特征。然后,进行LASSO,包括选择正则参数λ(log λ=0.0108),以确定特征数量(见图1A~图1B)。在确定特征数量后,选择 14 个特征中最具预测性的子集,并评估相应的系数(见图1C) 并用于构建预测模型。Radscore 显示在训练组(P<0.0001) 和验证组(P<0.0001) 中具有1p/19q 非共缺失 和 1p/19q 共缺失突变的 LGG 患者之间存在显着差异。具有 1p/19q 共缺失突变的患者通常表现出更高的 Radscore (见图2)。
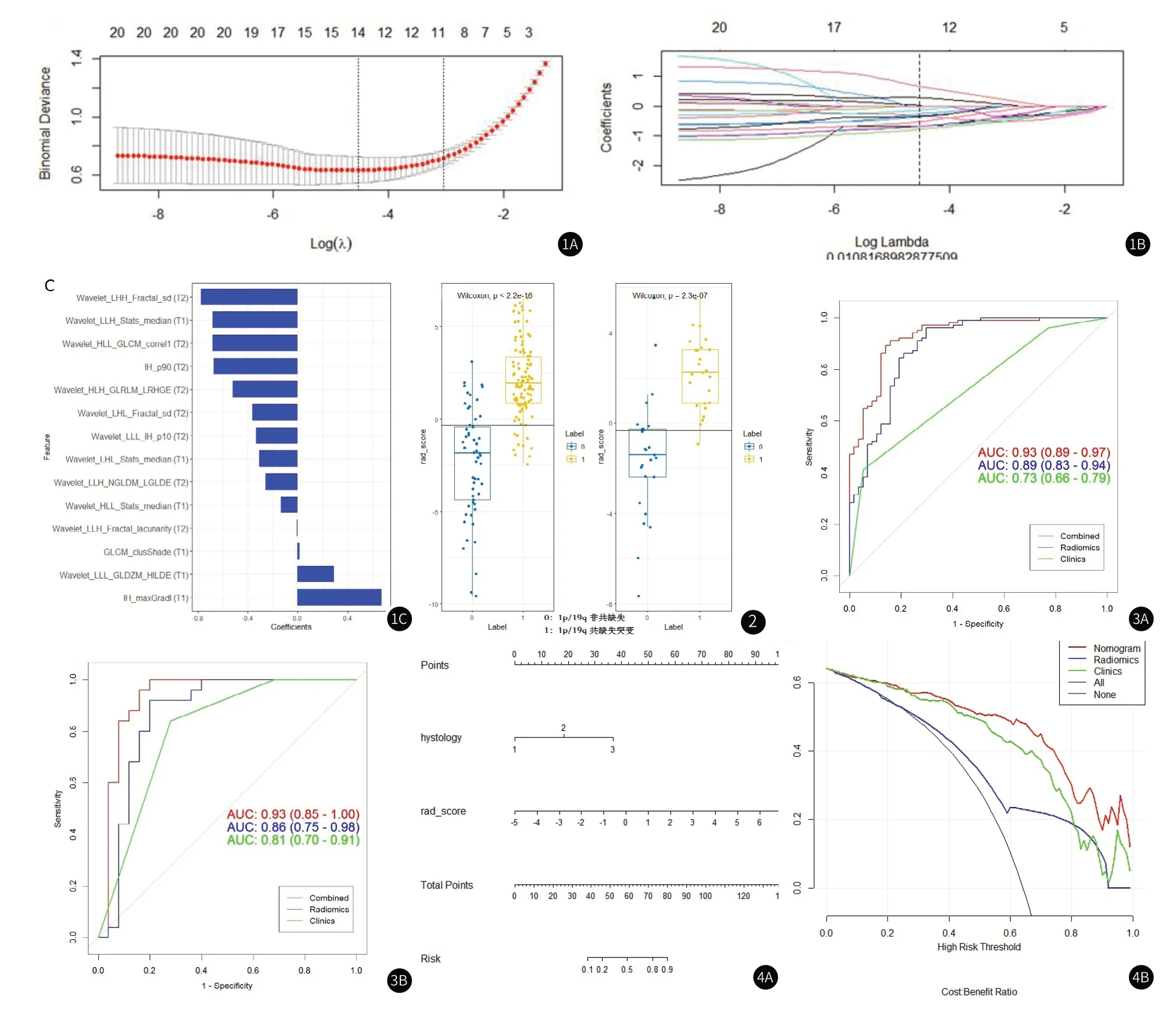
图1 使用LASSO回归模型选择与1p/19q共缺失突变相关的放射组学特征。图1A:交叉验证曲线。选择了最佳对数lambda(0.0108),并选择了14个非零系数。图1B:399个放射组学特征的LASSO系数分布图对解释的偏差进行了解释。图1C:直方图显示所选参数及其回归系数在放射组学模型中的贡献。图2 训练队列图2A和验证队列图2B中具有1p/19q非共缺失和1p/19q共缺失突变的LGG患者之间的 Radscore 差异。图3 用于预测LGG患者中1p/19q共缺失突变的三种已开发模型的性能比较。单独的临床特征、单独的放射学特征和训练图3A和验证图3B队列中的组合特征的 ROC 曲线。如图3所示,仅放射组学特征模型在训练队列中的AUC为0.89,在验证队列中为0.86。我们将P值小于0.01的临床指标-病理分型和放射学特征纳入逻辑回归分析。联合模型列线图在训练队列中的 AUC为0.93(95%CI,0.85-1),敏感性为91%(图3A),验证队列中的敏感性为83%(图3B),这在训练和验证队列中都显示出比放射组学特征更好的性能。图4 基于训练队列和模型评估校准曲线预测1p/19q共缺失突变的列线图。图4A:使用临床特征和Radscore构建的放射组线图。图4B:列线图的决策曲线DCA分析。y轴衡量标准化的净收益。净收益是通过将真阳性结果相加并减去假阳性结果来计算的,通过与未检测到的突变的相对危害与不必要治疗的危害相比较的相关因素对后者进行加权。红色曲线表示列线图,表示由放射组学特征和临床指标组成的联合预测模型。绿色曲线代表临床特征模型,而蓝色曲线代表放射特征模型。我们的联合预测模型优于其他模型和简单策略。
随后,构建了一个整合病理类型 和 Radscore 的列线图,见图4A。DCA通过真阳性率和假阳性率之间的差异来估计模型的净收益图,见图4B。
预测模型的 DCA 表明,在合理阈值概率的大部分范围内,与临床和放射学特征模型相比,联合列线图具有最高的净收益(见图4D)。决策曲线显示,如果患者的阈值概率在30%至100%的范围内,则使用我们研究中开发的联合列线图预测1p/19q共缺失突变收益相对高于仅基于临床或放射特征的模型。
2.3 临床效用指数(CUI)针对预测 LGG 患者染色体 1p/19q 共缺失的分子状态的列线图联合模型计算并在验证数据集上测试的阳性 CUI 为 0.83;阴性CUI 为 0.80 。获得的正负 CUI 值具有优秀的效用值。
这些结果表明,使用列线图联合模型,这意味着该算法可以良好地用于筛查和确认具有 1p-19q 共缺失状态的LGG患者。
表2列出了联合模型的预测性能,使用 AUC、准确性、敏感性、特异性和阴性、阳性预测值作为主要测量指标。在训练和验证队列的敏感性方面,联合模型优于放射组学特征模型和基于临床特征的模型。
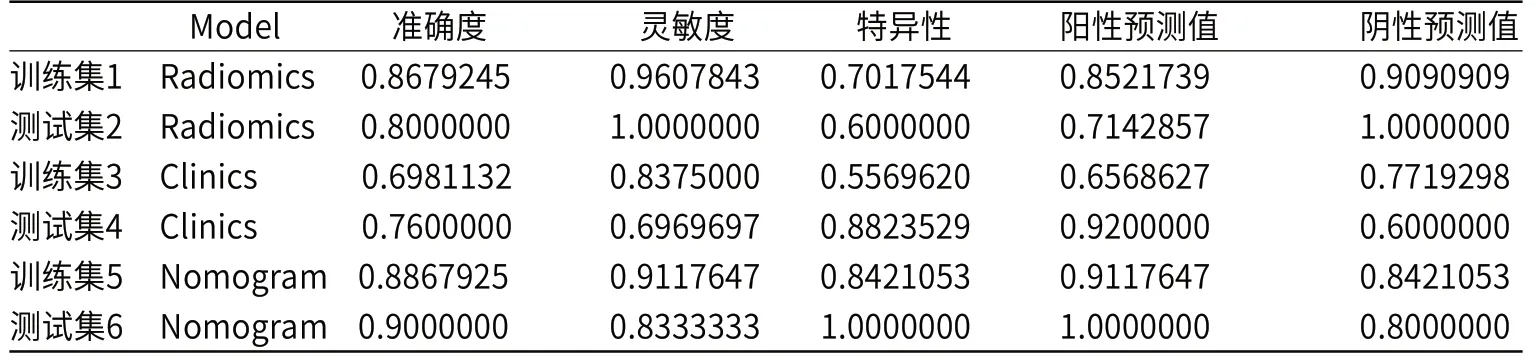
表2 三个模型在训练和验证队列中的预测性能
3 讨论
为了开发和验证基于联合模型的列线图,用于术前个体化预测 LGG 患者的1p/19q共缺失突变,本文进行了这项非侵入性、对整个病灶的MRI图像序列进行机器学习定量特征研究中。列线图综合了1个临床特征,即病理分型以及14个放射学特征。本研究结果表明,根据本研究的列线图,可以将 LGG患者分类为具有 1p/19q共缺失突变或非突变,这表明列线图可以用作一种新颖且用户友好的工具,以更好地管理LGG患者。此外,本研究提供了可视化的解释,以帮助临床医生了解MRI数据方面的预测结果。
在LGG个体基础上判断1p/19q共缺失突变状态对于确定个性化治疗策略至关重要。最近,研究人员一直在寻找新的影像组学分析方法来替代或补充常规检测1p/19q状态分子分析。周等人从癌症影像档案(TCIA) 数据集的165名患者的术前MRI中提取纹理特征,以开发逻辑回归模型,该模型在预测低级别胶质瘤的 1p/19q状态时 AUC 为0.78[32]。另两项使用CGGA或TCIA数据库的基于相似的嵌套交叉验证XGBoost模型的研究中,在低级别胶质瘤1p/19q 状态预测中表现出良好的 AUC 得分(0.8、0.85)、敏感性(0.75、0.88),和特异性(0.85、0.77),这可能归功于嵌套交叉验证在应对测试组信息泄漏和小样本量的优势[33-35]。本文使用TCIA数据库的研究具有更高的AUC和敏感性(0.89、94%),但较低的特异性0.64 。此外,本文的模型优于 van der Voort 等人提出的基于 SVM 的模型[36]和2022年一项应用最佳放射组学流程进行胶质瘤分类的模型[37]。邵华和张格等研究结果显示[38-39],FLAIR、弥散张量成像等多模态成像模式在评估预后较差的胶质瘤上具有较高的灵敏度、特异度、准确 度和诊断效能,具有较好的应用价值。
为了构建放射组学特征模型,通过使用 LASSO 方法缩小回归系数来预测因子-结果间的相关性,将2676个候选放射组学特征减少到 14 个潜在预测因子。这种方法不仅可以基于预测变量与结果的单变量关联强度来选择预测变量,而且还能够将所选特征组合成放射组学特征[40],进一步联合临床特征组合成列线图模型。
本文从测试集中提取了14个有价值的放射学特征,用于本文的预测模型。小波特征构成了本研究中大部分最重要的特征,代表相关性的测量。与非共缺失组相比,1p/19q共缺失肿瘤患者的T2FLAIR 信号更具异质性,边界更模糊。之前的研究也表明,1p/19q 共缺失的肿瘤患者瘤内信号存在更多异质性[41]。
本研究存在一些局限性。主要是样本量相对较小,这降低了分类结果的统计能力。出于这个原因,为了测试模型,我们对训练数据集进行了交叉验证,然后我们在整个训练数据集上对其进行了训练,以对外部数据集进行验证。其次,与训练和验证数据集内部和之间的数据平衡有关。训练数据集中的结果显着不平衡(102例缺失对57例非缺失);为了部分克服这一限制,使用了ADASYN 方法,这并非没有不平衡性。第三个限制与不同的MRI场强、切片厚度值(0.9~7.5mm)和各向同性像素间距(0.39~1.09mm)有关;这些差异可以是影响放射组学特征稳定性,但也可能是测试不同图像采集参数的方法稳定性的机会。
4 结论
基于非侵入性结合临床特征和 Radscore 的列线图模型在预测 1p/19q 编码共缺失突变方面表现出较好的灵敏度和辨别力,可以提供可靠的无创模型来预测 LGG 中的 1p/19q 共缺失的分子状态,为个性化治疗评估和治疗前预测提供有用信息,确定个性化治疗策略,以更好地管理 LGG 患者。

