臭氧关节腔注射对胶原诱导性关节炎大鼠趋化因子水平的影响
柏林昆,刘宁宁,王海瑶,苏雅珍,郭瑞团,和 平,任利民,高文琴,张丽中,张改连
(1山西医科大学第三医院,山西白求恩医院,山西医学科学院,同济山西医院风湿免疫科,太原 030032;2山西医科大学第五医院,山西省人民医院风湿免疫科;*通讯作者,E-mail:Zgl1118@163.com)
类风湿关节炎(rheumatoid arthritis,RA)是一种以炎症性关节炎和关节外受累为特征的全身慢性自身免疫性疾病,可因免疫紊乱引起炎性细胞浸润及异常分泌细胞因子,最终导致滑膜增生、血管翳形成和骨破坏[1,2]。研究表明RA患者血清中趋化因子异常表达[3]。而在RA患者滑膜炎症组织中,趋化因子和趋化因子受体结合既可通过促进白细胞募集、刺激血管生成[4,5];又能调节骨形成和骨吸收之间的动态平衡来影响骨代谢[6,7]。研究发现RA患者的血浆、滑液和滑膜组织中人巨噬细胞趋化蛋白-1(human macrophage chemoattractant protein-1, MCP-1)和调节激活正常T细胞表达和分泌因子(reduced upon activation, normal T cell expressed and secreted, RANTES)水平升高[8]。MCP-1和RANTES通过募集RA相关炎性细胞,促进炎症的发生[9-11]。C-X-C配体10(C-X-C ligand10,CXCL10)又称为干扰素γ诱导蛋白10,与其受体C-X-C趋化因子受体3(C-X-C chemokine receptor-3,CXCR3)结合后可趋化单核细胞和巨噬细胞,促进Th1炎症反应[12]。在RA动物模型中,CXCL10/CXCR3轴的激活可以促进CIA小鼠滑膜成纤维细胞的侵袭[13];而抑制CXCL10/CXCR3轴水平已被证明可以减少受损关节部位炎症细胞的浸润,从而减轻关节炎症和骨侵蚀[4,14]。在分子水平上,趋化因子能够激活核因子κB受体活化因子(receptor activator of nuclear factor-κB, RANK)-RANK配体(RANK ligand, RANKL)信号通路,促进破骨细胞成熟和分化[15]。
臭氧(ozone,O3),又称三原子氧,是一种不稳定且具有强氧化性的分子。一个多世纪以来,O3疗法已被广泛使用并进行了大量研究。目前已证实O3治疗具有抑制病原微生物、激活氧代谢、调节免疫系统、副作用小且可预防的特点[16]。有关RA动物模型的研究表明,O3处理可抑制促炎细胞因子(IL-1β、TNF-α、IL-12、IL-6)和血管内皮生长因子(VEGF)的产生,增加抗炎细胞因子IL-10的表达,减轻关节炎症,重建细胞氧化还原平衡[17,18]。同时,O3还可能对RA发生发展过程中异常表达的RANKL/RANK/骨保护素信号通路进行调控[19]。在临床研究中发现,与甲氨蝶呤(MTX)单药治疗相比,MTX联合O3更能降低RA患者的疾病活动度[20]。然而,目前还没有研究证实O3关节腔注射对RA发生发展过程中趋化因子表达水平的影响。本研究旨在采用O3关节腔注射对胶原诱导性关节炎(collagen-induced arthritis, CIA)大鼠进行干预,评估其对关节滑膜组织的影响,检测血清中MCP-1、RANTES、CXCL10的水平,滑膜组织CXCR3蛋白的表达,以及滑膜组织、淋巴结和脾脏中CXCL10和CXCR3的mRNA表达水平,同时将MTX和O3单药治疗效果进行对比,从相关趋化因子角度探讨O3治疗RA炎症反应的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 健康雌性Wistar大鼠40只,年龄(49±5)d,160~180 g,由中国北京军事医学科学院实验动物中心提供,证书号:SCXK【军队】,2012-0004,饲养于山西医科大学动物房。实验动物适应性饲养1周后,称重标记,采用乱数表法将大鼠随机分为正常对照组(n=8)和实验模型组(n=32)。实验过程中,各组实验动物均分笼饲养,饲养条件:20 ℃室温,50%相对湿度,定时喂食,自由摄水,光照周期(8 h光线和16 h黑暗)。
1.1.2 主要试剂与仪器 天然牛Ⅱ型胶原、完全弗氏佐剂(CFA)购于美国Sigma公司。Rotor-Gene Q实时荧光定量PCR仪及SYBR Green PCR试剂盒购于德国QIAGEN公司。流式细胞仪(型号:NovoCyte D1040)购于艾森生物(杭州)有限公司。臭氧发生器购于德国赫尔曼公司。X射线摄影设备购于美国飞利浦公司。LEICA RM-223 5型切片机购于德国LEICA公司。Olympus BX41照相显微镜购于美国Media Cybernetics公司。Image-ProPlus 5.1图形软件分析系统为美国Media Cybernetics公司产品。
1.2 方法
1.2.1 CIA大鼠模型的制备 本研究采用注射用完全弗氏佐剂乳化的牛Ⅱ型胶原,于适应性饲养1周后诱导大鼠CIA模型,具体方法如下:牛Ⅱ型胶原蛋白在0.1 mol/L的冰乙酸中溶解,浓度为2 mg/ml,4 ℃过夜,次日在无菌冰浴条件下用等量完全弗氏佐剂(CFA)充分混匀乳化。配制成质量浓度为1 g/L即每1 ml溶剂含1 mg牛Ⅱ型胶原的乳化液。实验模型组大鼠腹腔注射5%水合氯醛5 ml/kg用以麻醉,注射部位使用75%酒精消毒后,分别在大鼠背部3点、尾根部和任一后足掌皮内注射乳化液共0.5 ml(含牛Ⅱ型胶原0.5 mg)。加强免疫于初次免疫1周后在大鼠腹腔注射0.2 ml乳化液(含牛Ⅱ型胶原蛋白0.2 mg),诱导CIA模型。正常对照组不予以任何特殊处理。
1.2.2 实验动物干预方案 上述32只雌性大鼠中24只成功建立CIA模型。将造模成功的24只大鼠按乱数表法随机分为3组:CIA组、臭氧干预组(O3组)及甲氨蝶呤干预组(MTX组),每组8只,分笼饲养。O3组,在双踝关节局部注射臭氧(40 μg/ml)1 ml,每周1次,连续3周[18];MTX组,腹腔注射MTX 0.9 mg/kg,每周1次,连续3周[21];CIA组(阳性对照组)和正常对照组腹腔注射等量0.9%氯化钠溶液,用法同上。
1.2.3 标本制备 在实验结束时(5周)向各组Wistar大鼠腹腔注射5%的水合氯醛(5 ml/kg)麻醉,采用颈椎脱位法处死。内眦静脉收集外周血并离心,取上清液-80 ℃储存备用。然后立即解剖获取新鲜脾脏、淋巴结和滑膜组织以备下一步研究。新鲜组织分别标记:一部分浸泡于4%多聚甲醛中固定过夜,石蜡包埋进行免疫组化研究,另一部分储存于液氮容器(-190 ℃)以便进行RT-PCR分析。
1.2.4 流式细胞术检测血清中MCP-1、RANTES、CXCL10的表达水平 解冻上清液,采用梯度稀释法制备标准品。应用流式细胞仪和多项趋化因子检测试剂盒(北京旷博生物技术有限公司)测定血清趋化因子浓度,采用Cell-Quest软件(Becton Dickinson)和Windows多文档接口流式细胞术应用程序对数据进行分析。
1.2.5 免疫组化检测滑液组织中CXCR3蛋白的表达 滑膜组织经石蜡包埋后进行冷冻,使石蜡变成固态,将其切为厚度为5 μm的切片,贴附在清洁载玻片上,置于烤箱37 ℃恒温干燥4 h以上;分梯度脱蜡;3% H2O2室温下孵育10 min以消除内源性过氧化酶活性;PBS洗涤;抗原修复;血清封闭;CXCR3单克隆抗体孵育,4 ℃冰箱过夜;常温下40 min后PBS缓冲液冲洗;切片上覆盖聚合物辅助剂20 min,PBS洗涤;滴加山羊抗兔IgG多聚体抗体,37 ℃恒温箱中孵育30 min后PBS洗涤;DAB显色,光学显微镜下观察蒸馏水冲洗终止显色;苏木素再次染色,脱水封片。通过光学显微镜摄取组化图像,输入Image-Proplus 5.1图形分析系统,按照标准分辨率截取200倍图像。
1.2.6 RT-PCR检测CXCL10、CXCR3在滑膜组织、淋巴结和脾脏中的mRNA表达水平 通过逆转录聚合酶链反应(RT-PCR)技术检测滑膜组织、淋巴结和脾脏中CXCL10、CXCR3的mRNA表达水平。总RNA提取方法如下:用Trizol试剂对组织样品裂解,裂解液离心(12 000 r/min,4 ℃,15 min);用苯酚-氯仿混合物提取上清液中RNA,冰异丙醇沉淀,离心(7 500 r/min,4 ℃,5 min),弃上清;将沉淀物(RNA)重新溶解于经焦炭酸二乙酯(DEPC)处理过的H2O中,琼脂糖凝胶电泳显示RNA条带。利用Primer 3.0软件设计PCR引物,序列见表1。采用Rotor-Gene SYBR Green PCR试剂盒进行RNA逆转录和cDNA扩增。PCR扩增混合液配置:20 μl×4管,反应体系:5×TSRT Buffer 8 μl,2.5 mmol/L dNTP 6 μl,10 μmol/L引物各2 μl,Taq酶0.4 μl,cDNA 4 μl,ddH2O 53.6 μl。PCR程序设置为:94 ℃预变性5 min;94 ℃变性30 s;Tm退火30 s;72 ℃延伸30 s,35个循环;72 ℃延长7 min。利用Rotor-Gene Q实时荧光定量PCR仪进行分析,每个样品进行3次重复分析。
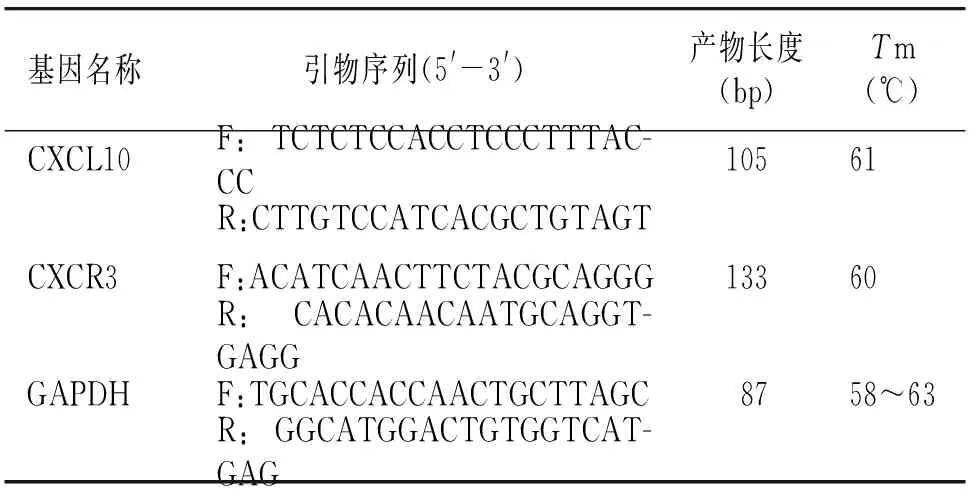
表1 引物名称及序列Table 1 Name and sequence of primers
2 结果
2.1 O3治疗可以降低CIA大鼠血清CXCL10水平
CIA组大鼠血清MCP-1、RANTES、CXCL10浓度明显高于正常对照组(P<0.05)。与CIA组相比,O3组大鼠血清CXCL10浓度明显降低(P<0.05);而O3组与CIA组大鼠血清MCP-1、RANTES浓度的差异无统计学意义(P>0.05)。O3组与MTX组大鼠血清CXCL10浓度的差异无统计学意义(P>0.05,见图1)。
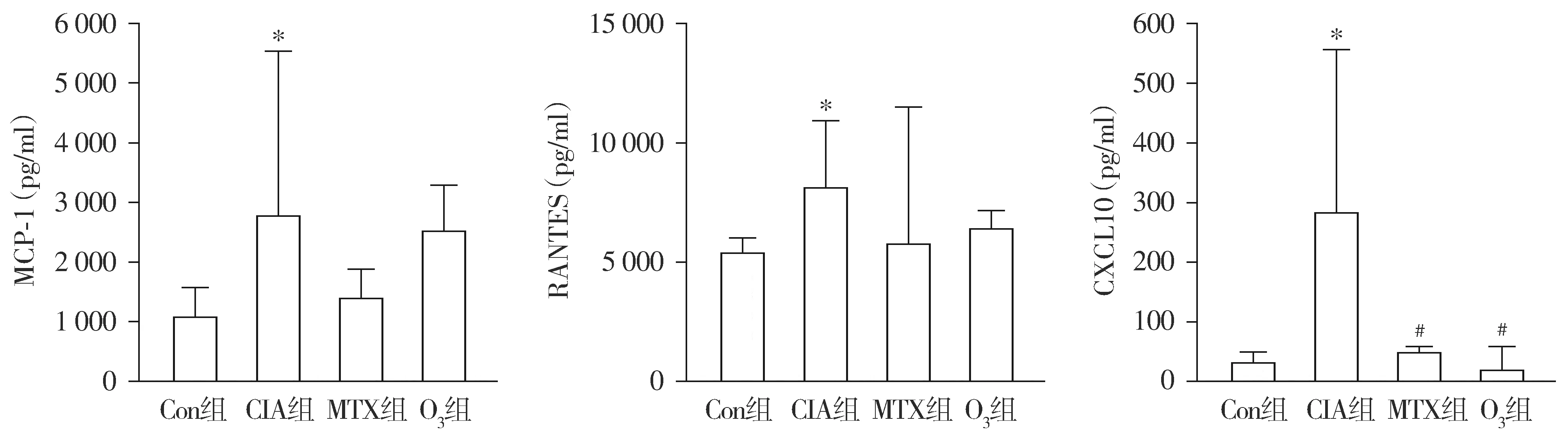
与Con组比较,*P<0.05;与CIA组比较,#P<0.05图1 大鼠血清趋化因子MCP-1、RANTES和CXCL10表达水平比较Figure 1 Comparison of serum chemokines MCP-1, RANTES and CXCL10 levels in rats between groups
2.2 O3治疗可抑制CIA大鼠滑膜组织中CXCR3的蛋白表达
CXCR3作为CXCL10的受体,在CIA大鼠滑膜组织中异常表达。免疫组化分析显示,各组大鼠滑膜组织中CXCR3为胞浆型表达。正常对照组大鼠滑膜组织中隐约可见核周淡黄色着色,滑膜组织为2~3层滑膜细胞,CXCR3呈弱阳性或阴性表达(见图2A);CIA组大鼠可见滑膜组织增生,其内分布有10~20层滑膜细胞,核周胞浆弥漫分布黄褐色着色,CXCR3表达呈强阳性(见图2B);O3组和MTX组大鼠滑膜组织中可见散在褐色或淡黄色胞浆染色,滑膜细胞约4~6层,与正常滑膜组织相近,CXCR3呈弱阳性或阴性表达(见图2C,D)。经O3和MTX治疗后,CXCR3表达水平明显下降,主要表现为阳性免疫染色区域面积减少且染色变浅(见图2C,D)。以上结果表明,O3与MTX作用相似,可抑制CIA大鼠滑膜组织中CXCR3的蛋白表达。
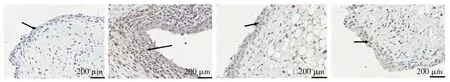
A.正常对照组B.CIA组C.O3治疗组D.MTX治疗组图中箭头所指为滑膜细胞图2 免疫组化检测大鼠滑膜组织CXCR3的表达 (苏木精染色,×200)Figure 2 Expression of CXCR3 in synovial tissue of rats by immunohistochemical staining (hematoxylin staining,×200)
2.3 各组大鼠不同组织中CXCL10、CXCR3的mRNA表达水平比较
RT-PCR结果显示,在滑膜组织和淋巴结中CIA组大鼠CXCL10、CXCR3的mRNA表达水平显著高于正常对照组(P<0.05)。与CIA组比较,O3组滑膜组织中CXCL10和CXCR3的mRNA表达水平明显降低(P<0.05);而淋巴结中CXCL10和CXCR3的表达差异无统计学意义(P>0.05)。MTX组滑膜组织中CXCR3的mRNA表达水平与O3组相比,差异无统计学意义(P>0.05)。在脾脏组织中,CIA组CXCL10的mRNA表达水平与正常对照组比较显著增加(P<0.05)。O3组与CIA组相比,脾脏中CXCL10和CXCR3的mRNA表达水平差异均无统计学意义(P>0.05,见图3)。
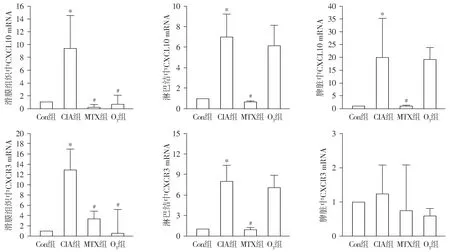
与正常对照组比较,*P<0.05;与CIA组比较,#P<0.05图3 RT-PCR检测大鼠滑膜、淋巴结、脾脏组织中CXCL10和CXCR3的mRNA表达水平Figure 3 The mRNA levels of CXCL10 and CXCR3 in synovial membranes, lymph nodes, and spleen tissues of rats by RT-PCR
3 讨论
RA是目前最常见的慢性病之一,治疗不及时极易出现关节畸形和多种并发症,严重影响患者生活质量。MTX作为治疗RA的一线用药,作用机制多样,包括阻断炎症细胞DNA的合成、降低RANKL/OPG比率等[22]。研究发现MTX治疗并不能完全阻止RA患者的影像学进展,且长期使用部分患者可能会出现病理性多器官毒性,从而限制了其治疗潜力[22,23]。因此,临床上常常将MTX与其他药物联合使用。O3是一种极易溶于血液和组织液的蓝色气体,早期被用于治疗战伤,发挥抗炎杀菌的作用[24]。近年来,关节腔内注射O3已经成为治疗骨关节炎的一种新方法,其不仅能够通过控制氧化应激反应来激活机体的抗氧化系统和免疫系统,保护软骨细胞,发挥抗炎作用[25];还能通过抑制致痛物质(如前列腺素和缓激肽)的合成和释放,减轻疼痛,增加患者依从性[26]。本课题组前期研究表明40 μg/ml的O3关节腔注射可以减轻CIA大鼠的关节肿胀度,降低血清促炎细胞因子TNF-α、IL-6、VEGF的水平以及骨破坏相关分子RANKL、RANKL/OPG比值,与MTX疗效相当[18,19]。
趋化因子可分为CXC、CC、C、CX3C四大亚族,不仅能在疾病初期调控稳态免疫细胞的迁移,加重疾病的病理状态;还能由炎症状态下特定的细胞诱导和表达,在免疫系统的发育和稳态中发挥重要作用[27]。研究发现RA患者的血浆、滑液和滑膜组织中MCP-1和RANTES水平升高[8]。趋化因子在RA患者血清和滑液中的高表达能够驱使炎症细胞浸润,特别是CC类趋化因子RANTES和MCP-1[28,29]。RANTES主要引起T淋巴细胞的浸润,而MCP-1则可以驱使滑膜巨噬细胞的聚集。我们的研究结果表明O3治疗可降低CIA模型大鼠血清中MCP-1、RANTES和CXCL10的异常表达。因此,O3治疗抑制趋化因子的表达可能直接或间接抑制RA炎症反应。
CXCL10属于CXC类趋化因子,其受体CXCR3主要(但不完全)由Th1细胞表达[30]。与受体结合后,CXCL10/CXCR3轴可促进RA滑膜CD4+T细胞中RANKL的表达,在破骨细胞的分化、成熟及归巢过程中也发挥重要作用[31]。目前,以CXCL10/CXCR3为靶标调节免疫细胞的活化和定位用于RA治疗的研究也取得一定进展[32]。本研究证实O3关节腔注射可以减轻CIA大鼠的滑膜增生,抑制滑膜中CXCL10和CXCR3的mRNA表达水平。且与MTX治疗组相比,O3治疗组滑膜组织中CXCR3的mRNA表达水平无统计学差异。因此,我们推测O3治疗可重建CIA模型大鼠滑膜微环境CXCL10/CXCR3介导的免疫平衡,这可能成为O3缓解RA滑膜炎症和骨破坏的一个潜在靶点。除此之外,本研究还使用RT-PCR检测CXCL10和CXCR3在淋巴结和脾脏中的表达情况。我们发现与正常对照组相比,CIA组淋巴结和脾脏中CXCL10和CXCR3 mRNA表达水平也异常升高,表明RA外周淋巴器官中同样存在CXCL10/CXCR3轴介导的免疫紊乱。本研究中O3治疗未纠正外周淋巴器官趋化因子异常表达,我们猜测O3疗效可能受给药水平和方式的影响。
总的来说,以上一系列证据为O3治疗RA相关炎症反应的作用机制提供了依据,使其有望成为RA的一种可选择的补充治疗方法。目前,关于O3关节腔注射治疗RA的最佳浓度、给药方式等尚不统一,且国内外对其长期治疗效果的相关报道较少。因此,为进一步推进这种治疗方法在RA中的应用,有必要对O3治疗RA进行更全面、更详细的临床前研究,以便达到规范、安全、有效的治疗效果。

