16S rDNA测序检测海南地区腹泻型肠易激综合征患者肠道菌群的变化
王 嫣, 汤 净, 陈卜钰, 曹艳慧
海南医学院第一附属医院消化内科,海南 海口 570000
肠易激综合征(irritable bowel syndrome,IBS)是一种最常见的功能性肠道疾病,其特征是腹痛或腹部不适,腹泻、便秘或排便不规律等。IBS患病率为9.2%,女性患病率高于男性(12.0%vs8.6%),发病机制复杂多样,它不仅降低了患者的生活质量,还增加全球医疗负担。罗马Ⅳ分型标准共分为便秘型IBS(IBS-constipation, IBS-C)、腹泻型IBS(IBS-diarrhea, IBS-D)、混合型IBS(IBS-mixed type, IBS-M)、不定型IBS(IBS-unclassified, IBS-U),其中IBS-D最为常见[1-2]。IBS患者中同时出现焦虑、抑郁等精神心理状态发生率较高(诊断率达50%)[3-4]。目前IBS病因复杂多样,近年研究热点表明肠道菌群失调可导致内分泌代谢系统疾病、神经系统疾病、胃肠道疾病等的发生。胃肠道菌群是一个多样且数量众多的生态系统,栖息于整个胃肠道,对我们的健康具有系统性影响,其存在巨大的复杂性和个体间高度的变异性。随着研究的不断深入,逐渐认识到肠道菌群在IBS中发挥重要作用,肠道菌群失调影响肠道黏膜完整性及通透性、体液免疫、脑-肠轴、精神障碍等多方面[5-6]。相关文献报道,IBS患者增加的肠道菌群有:普雷沃属(Prevotella)、肠杆菌(Enterobacteriaceae)、韦氏荣球菌(Veillonella)、链球菌(Streptococcus)等,同时相应减少的肠道菌群有:瘤胃球菌属(Ruminococcus)、双歧杆菌属(Bifidobacterium)、柯林斯菌(Collinsella)、粪杆菌属(Faecalibacterium)等[6]。本文应用16S rDNA技术检测肠道菌群变化。
1 资料与方法
1.1 一般资料收集2020年10月至2021年10月在海南医学院第一附属医院消化内科就诊的IBS-D患者30例,男12例,女18例,年龄(40.94±9.81)岁(21~59岁)。健康对照组30名,男13名,女17名,年龄(42.06±11.65)岁(26~55岁),所有入组IBS-D患者组和健康对照组受试者均在本地生活超过10年或在本地生活的海南籍人员。性别及年龄对比,差异无统计学意义(P>0.05),具有可比性。本课题研究已获得海南医学院第一附属医院医学伦理委员会批准[批号:2021(科研)第(81)号]。
1.2 纳入及排除标准IBS-D组纳入标准:符合罗马Ⅳ诊断标准[4];临床资料完整;签署研究知情同意书,配合各项检查;排除标准:高血压、糖尿病、慢性支气管炎等慢性疾病;孕期、哺乳期、合并系统严重疾病、合并精神疾病等情况;近期使用各种抗生素、质子泵抑制剂及益生菌等药物;曾有重大手术史、复杂腹部手术史者。健康对照组纳入及排除标准:纳入前6个月内未出现明显的腹痛、腹泻、腹胀等胃肠道症状,并且排除上述IBS-D组任何标准。
1.3 方法
1.3.1 样本采集:分别收集IBS-D患者治疗前后新鲜粪便、健康对照组新鲜粪便约5.0 g于无菌冷冻试管中,封口后于1 h内运送至海南医学院第一附属医院院实验室冻存于-80 ℃超低温冰箱内保存,后续进行16S rDNA测序。所有IBS-D患者完善常规检查,与患者本人沟通签署知情同意书。记录患者基本信息、IBS症状严重程度量表(IBS-Symptom Severity Scale, IBS-SSS)评分、宗氏焦虑自评量表(Zong′s Self-rating Anxiety Scale, Z-SAS)评分及宗氏抑郁自评量表(Zong′s Self-rating Depression Scale, Z-SDS)评分。
1.3.2 样本粪便:DNA 提取按相关试剂盒提取步骤进行。
1.3.3 样本DNA的PCR扩增、纯化:(1)将粪便样本提取的DNA进行16S rDNA V3~V4区测序(引物设计:5′-GACTACHVGGGTATCTAATCC-3′和5′-CCTACGGG-NGGCWGCAG-3′)。(2)样本DNA扩增、纯化:使用上述引物对序列进行扩增,PCR产物经2%琼脂糖凝胶电泳确证。PCR产物由AMPure XT beads (Beckman Coulter Genomics,Danvers,MA,USA)纯化,Qubit(Invitrogen,USA)定量。扩增子池用于测序,扩增子文库的大小和数量分别在Agilent 2100生物分析仪(Agilent,美国)和Illumina(Kappa Biosciences,Woburn,MA,美国)的文库定量试剂盒上进行评估。在NovaSeq PE250平台上对库进行排序。
1.3.4 生物分析流程:样品在Illumina NovaSeq平台上按照制造商的建议进行测序。得出原始数据、过滤后的高质量数据等测序序列,最后高质量序列形成聚类分析,100%相似序列形成可操作单元ASV。
1.4 评估标准依据:(1)采用IBS-SSS量表评估患者症状严重程度,该评分量表分别从腹部不适、腹痛天数、腹胀程度、大便满意度、肠道对生活困扰5个方面评估IBS症状严重程度。每项满分100分,每个选项设置5个级别,得分依次增加20分,满分共计500分。症状严重程度分级:总分>76分且<175分为轻度,总分>175分且≤300分为中度,总分>300分为重度。(2)采用Z-SAS、Z-SDS自评量表评估焦虑/抑郁状况,评分≥50分存在焦虑/抑郁心理状态。(3)正常粪便涂片中革兰阳性杆菌占比50.2%~74%,革兰阴性杆菌占比23.5%~44%,革兰阳性球菌占比2%~13%,革兰阴性球菌占比0.5%~9%。年龄、饮食情况、肠道刺激、病情等因素的影响可能导致肠道菌群失调,按照菌群失调数量的改变分为Ⅰ、Ⅱ度菌群失调,出现菌群质量的改变导致Ⅲ度菌群失调[7]。
1.5 观察指标观察两组IBS-SSS评分、Z-SAS评分、Z-SDS评分和粪便涂片结果。16S rDNA测序技术观察肠道菌群变化。
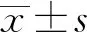
2 结果
2.1 症状评分、焦虑/抑郁评分IBS-D组症状评分(IBS-SSS)及焦虑/抑郁评分(Z-SAS和Z-SDS)明显高于健康对照组(见表1)。
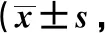
表1 IBS-D组与健康对照组症状及心理状态评分分)Tab 1 Symptom and mental status scores of IBS-D group and healthy control group scores)
2.2 粪便涂片分析经统计分析显示,IBS-D患者粪便涂片检查存在菌群失调,显示肠道Ⅱ、Ⅲ度菌群失调人数明显增加、无菌群失调人数减少(χ2=52.32,P=0.001),差异有统计学意义(P<0.05)(见表2)。

表2 IBS-D组与健康对照组粪便涂片菌群比较
2.3 16S rDNA测序分析
2.3.1 对测序质量分析:IBS-D组和健康对照组的有效序列分别为(80 629±31 920)条和(83 807±2 424)条序列,高质量测序序列平均值为70366,所有有效测序序列长度位于400~500 bp,样品测序深度为99%~100%,IBS-D组和健康对照组ASV数量分别为686、411。
2.3.2 多样性分析:Alpha多样性主要用来反映单样本物种丰富度、均匀度以及测序深度,包括Chao1、Observed species、Goods_coverage、Shannon、Simpson和Pielou-e等指数,其中Chao1指数是反映样本中群落的丰富度较为常用指标,数值越高,丰富度越高。Shannon指数是反映样本中群落多样性常用指标,Pielou-e反映均匀度指标。当曲线随测序序列数的增加稀释曲线趋向平坦,可直接说明本实验测序数量合理(见图1)。与健康对照组相比较,结果显示IBS-D组物种丰富度及多样性降低,差异有统计学意义(P<0.05)(见表3)。进一步行Beta多样性分析,其指不同样本群落之间的物种差异性。常用主坐标分析PCoA用于描述样本的距离,样本距离越近,物种组成成分越接近。为了避免线性模型的缺点(指主坐标分析PCoA),更好地反映组间差异,应用非线性模型NMDS分析,其结果的优劣用胁强系数(Stress)来衡量,通常认为当Stress<0.1时,可以认为是一个好的排序,与健康对照组相比,结果显示IBS-D组粪便菌群整体上与健康对照组存在相似性,但菌群波动度明显(见图2)。此外,采用 Adonis 法将两组进行组间差异检验,计算R=0.071,P=0.024,表明IBS-D组与健康对照组组间样品差异越大,组内样品差异越小,分组效果越好,分组合理(见图3)。
2.3.3 粪便菌群分析:IBS-D与健康对照群菌群存在差异,分别从菌“门”、菌“属”进行比较,在“门”水平,IBS-D患者与健康对照组两组中97%的肠道菌“门”归属:厚壁菌门、拟杆菌门、变形菌门和放线菌门,但含量比例不同,厚壁菌门减少,拟杆菌门增加,其比值(F/B)为4.24,差异无统计学意义(P>0.05)(见图4~5)。在“属”水平,与健康对照组相比,从热图可以看出,IBS-D组瘤胃球菌(Ruminococcus_gnavus)丰度增加,普氏栖粪杆菌属(Faecalibacterium)、罕见小球菌属(Subdoligranulum)、直肠无杆菌属(Agathobacter)、毛螺杆菌科(Lachnospiraceae)、丹毒丝菌属(Erysipelotrichaceae)、罗斯氏菌属(Roseburia)、粪球菌属(Coprococcus)丰度减少(P<0.05)(见图6)。再次分别对每组样本所测物种进行差异性分析,筛选P<0.05的前100物种绘制柱状图,结果同前(见图7)。应用LEfSe(LDA Effect Size)分析两组菌群,将LDA绝对值>4为判定标准,表示两组差异性物种,在“属”水平IBS-D组中的Faecalibacterium差异显著,健康对照组中Ruminococcus_gnavus差异显著(见图8~9)。
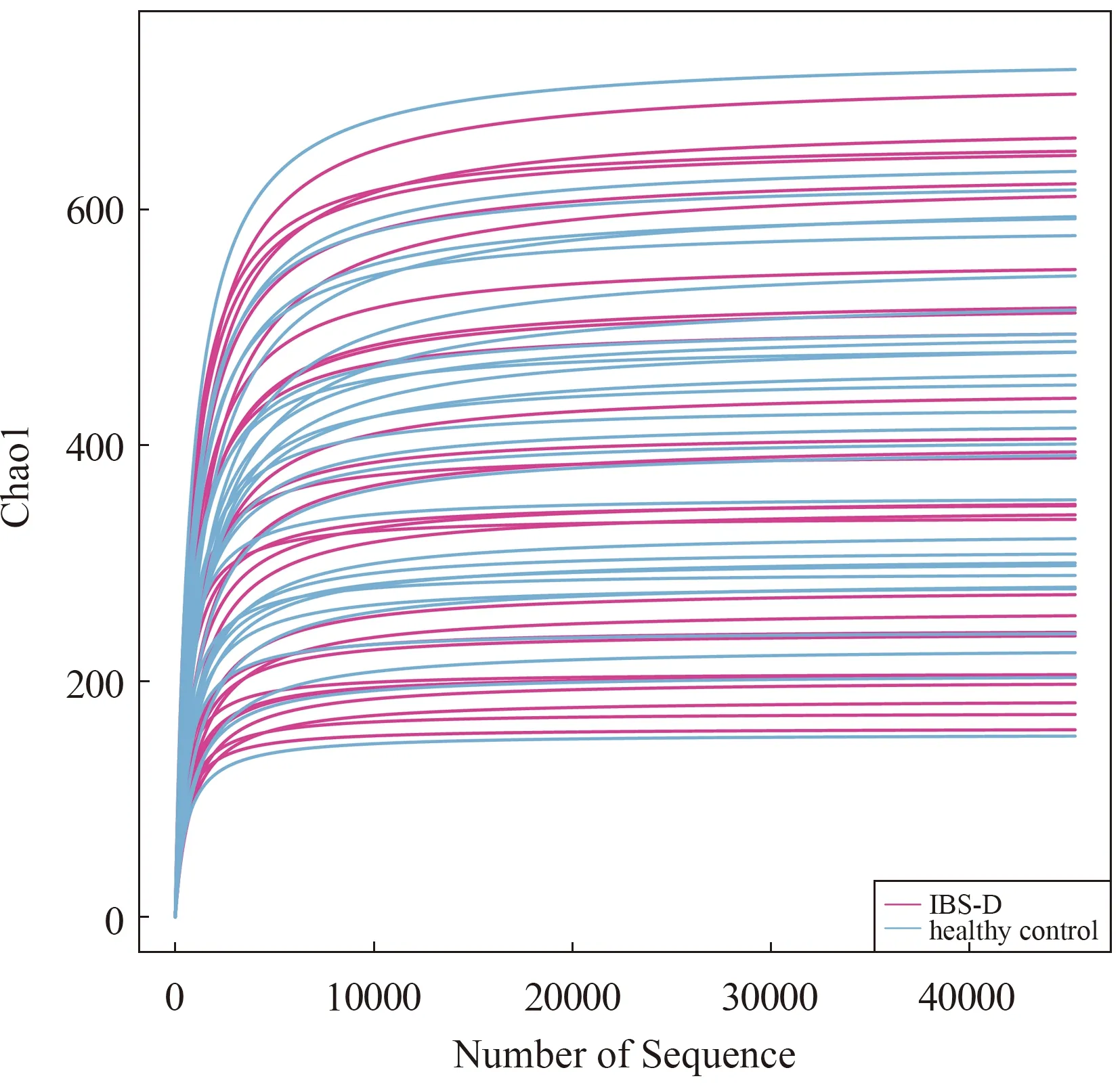
注:横坐标为测序序列,纵坐标为ASV。
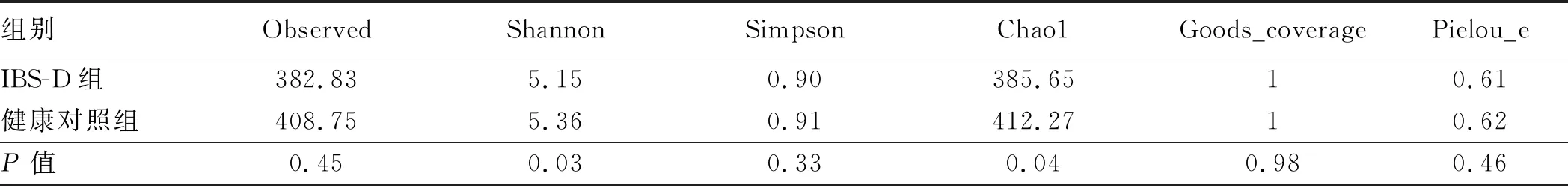
表3 IBS-D组与健康对照组Alpha多样性分析
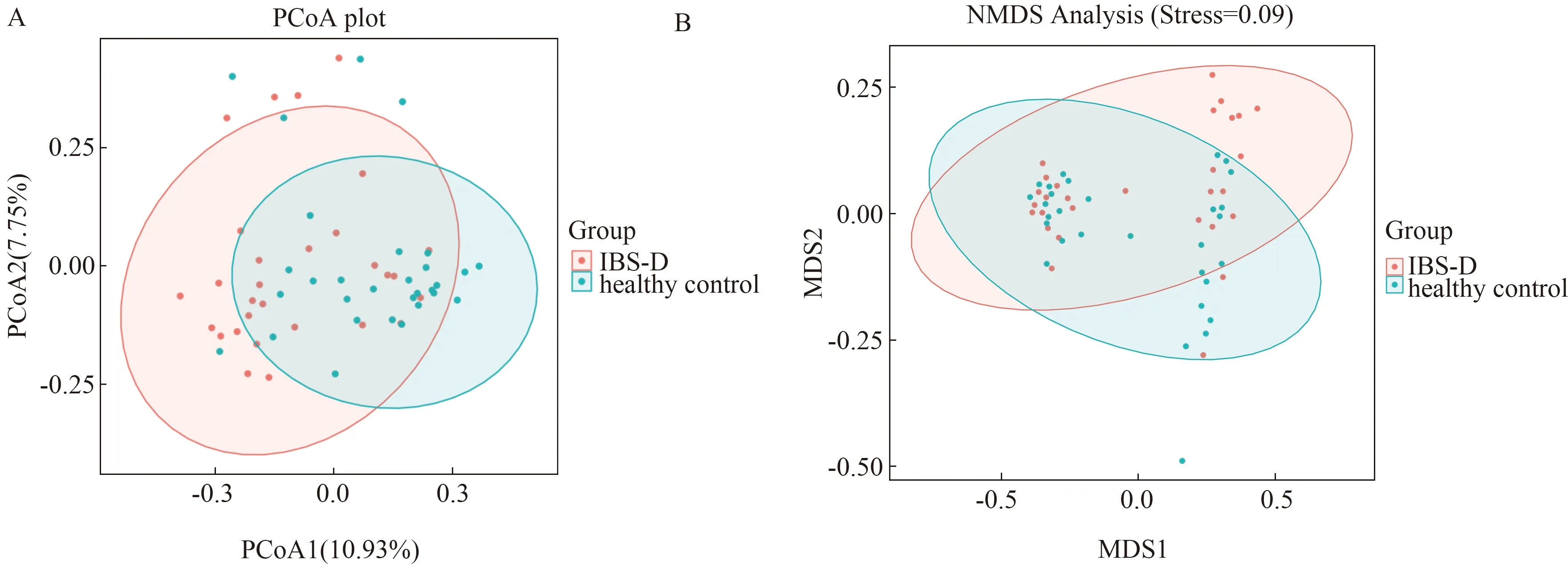
注:A:PCoA分析,X坐标代表第一个主成分,Y坐标代表第二个主成分,百分比代表主成分对样本差异的贡献。B:NMDS分析。图2 IBS-D组与健康对照组PCA和NMDS分析
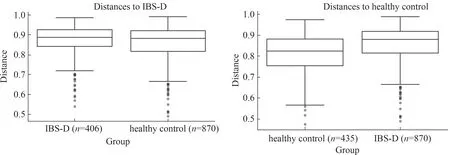
注:横坐标为样品,纵坐标为距离的秩。图3 IBS-D治疗前与健康对照组Anosim分析
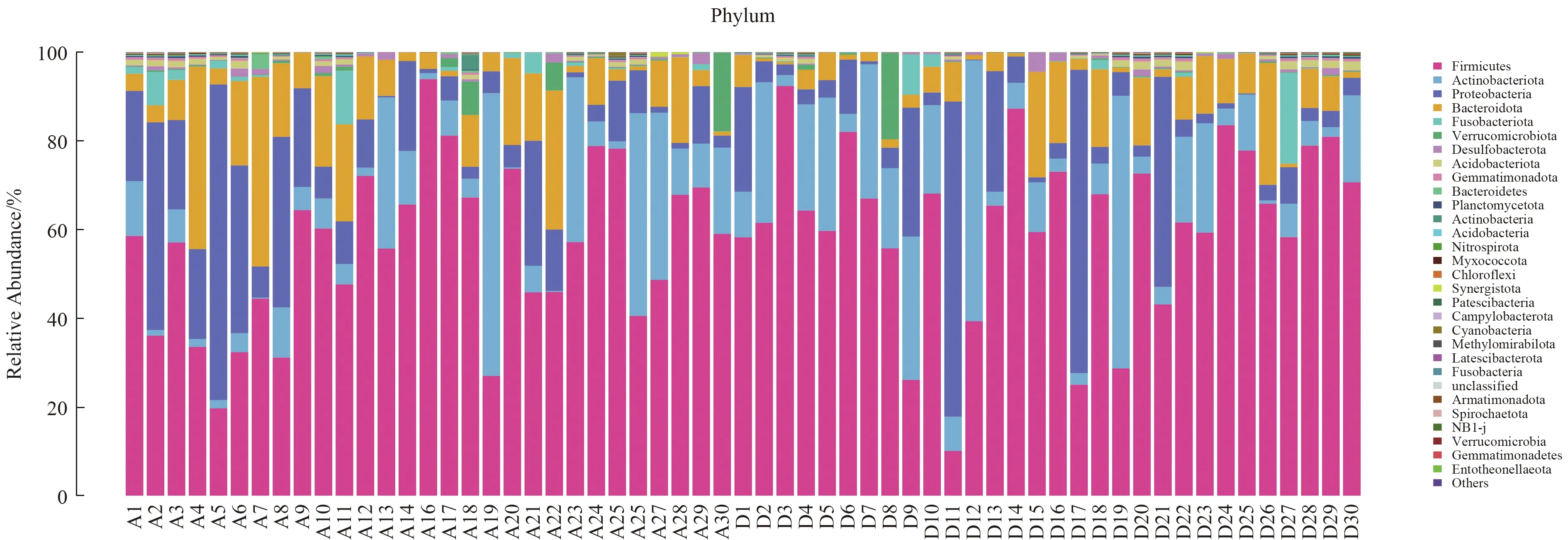
图4 各标本物种相对丰度前30直方图(门水平)
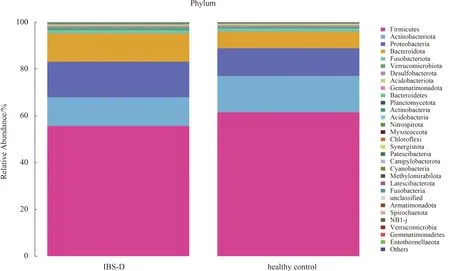
图5 IBS-D组与健康对照组丰度前30直方图(门水平)
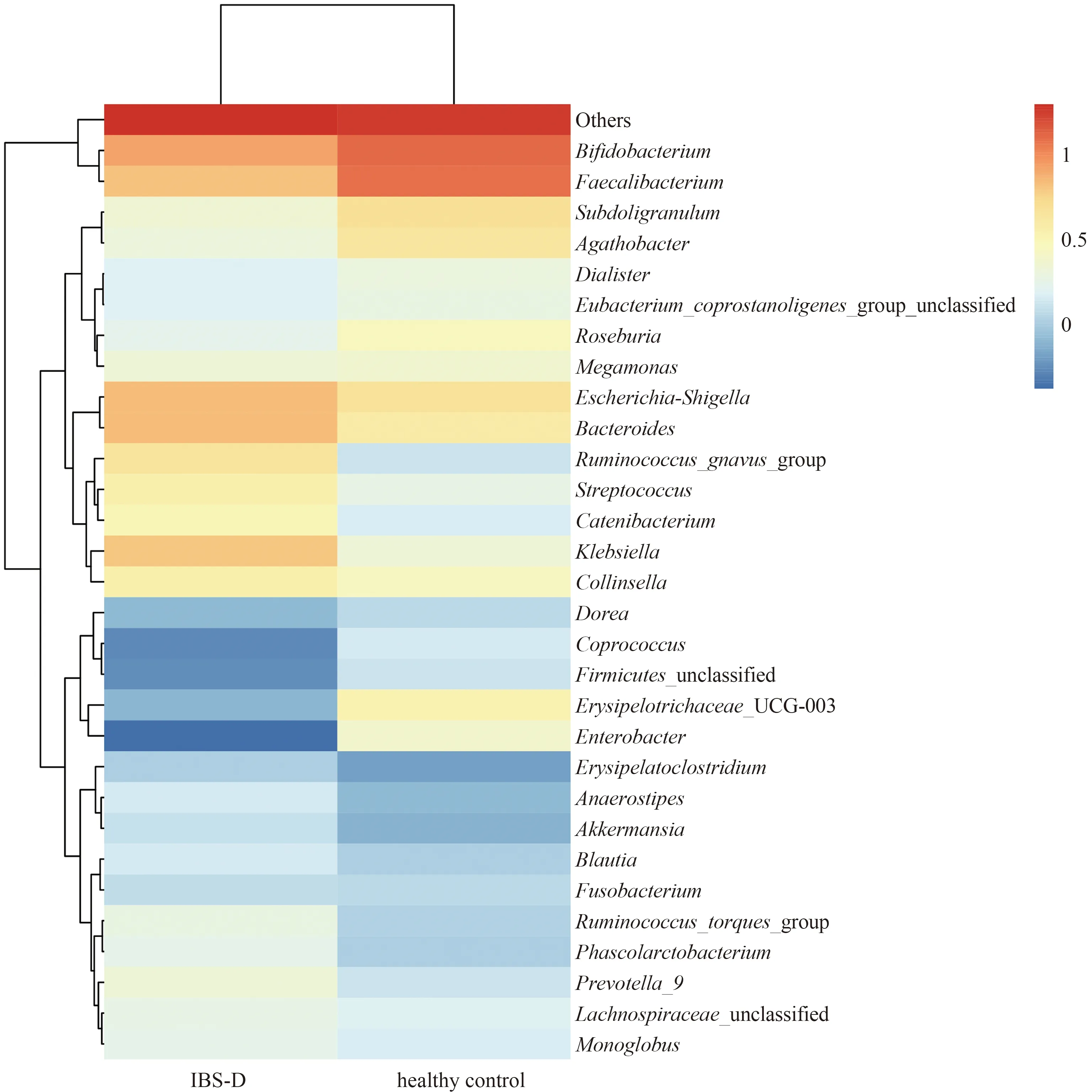
图6 各标本物种相对丰度前30热图(属水平)
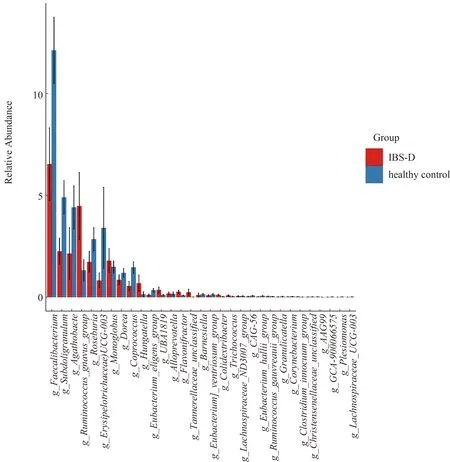
图7 IBS-D组与健康对照组丰度前30直方图(属水平)
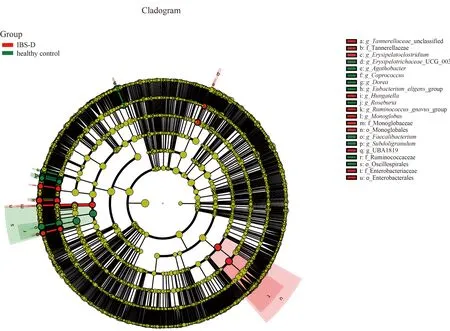
注:图中圆圈从内到外依次为界、门、纲、目、科、属、种七个分类级别,每个不同分级的圆圈代表一个物种分类,圆圈直径与该物种丰富度成正比。红色和黄色分别代表显著差异、无差异。
3 讨论
肠道菌群被视为人体“第二基因组”,每个个体的肠道菌群都是独一无二的,肠道菌群与宿主间存在着精细、微妙的动态平衡关系。其肠道菌群平衡紊乱,破坏肠道黏膜屏障、攻击黏膜免疫系统、影响脑-肠轴等多方面从而诱发IBS-D的发生。研究表明,Raskov等[6]指出相当一部分急性感染性肠炎患者经治疗后,出现IBS样症状(感染治疗2年后仍有IBS症状,IBS的这一亚群被称为感染后IBS,即IBS-PI),其中36%患者同时感染空肠弯曲菌和大肠杆菌,此类菌群可以通过特定途径使肠道通透性持续升高,继而出现腹泻等消化道症状以及炎症反应的激活。研究表明,来自肠道的感觉信号在大脑中进行处理,岛叶皮层起着重要作用。其他大脑区域,如海马和杏仁核,也很重要,因为它们参与调节焦虑和抑郁,这是IBS的两种主要精神共病[8]。随着对肠道微生态研究热度的不断增加,越来越多证据提出了微生态-脑-肠轴的概念。有研究者发现,将接受IBS-D的粪便微生物的小鼠出现更快的肠道转运速度、肠道屏障功能出现异常以及出现焦虑行为[9],可以说明脑-肠轴的存在[10]。H2葡萄糖呼气试验表明,IBS近1/4患者存在小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO),SIBO是菌群失调的一种表现,在IBS中非常普遍,当肠道古细菌和产甲烷菌(Methanobrevibactersmithii)过多,从而导致氢气(H2)和甲烷(CH4)产生增多时,其中CH4导致口-盲传输时间延长,与IBS-C有关,这与SIBO密切相关[11]。研究表明,给予乳酸双歧杆菌、嗜酸乳杆菌等有肠道益菌及神经递质调节药物干预有助于维持或增强肠道屏障功能,进而减缓IBS-D症状的发生[9]。
由于人们的饮食等生活行为习惯不同,不同地域的人群肠道菌群结构组成是有差异的。生活在热带地区以海鲜食品为主要饮食习惯的海南地区的人群肠道菌群状态未见报道。这是本课题研究的创新点之一。我们课题的初步研究结果显示:长期生活在海南地区的人群肠道菌群中双歧杆菌属(Bifidobacterium)测序含量最高。Ming等[12]收集了同一山区中59例土瑶族、47例汉族、28例壮族粪便标本进行分析,三个种族的优势菌属菌为类杆菌属(Bacteroides)和普雷沃菌属(Prevotella),饮酒量越高的种族,类杆菌属丰度越高,普氏栖粪杆菌属(Faecalibacterium)的丰度越低。汉族人群粪便微生物群中Megamonas的数量明显高于壮族人群,瑶族粪便微生物群中Succinvibrio高于汉族与壮族。Deschasaux等[13]应用16S测序技术检测肠道菌群得出,摩洛哥人、土耳其人、加纳人等人群中以普雷沃菌属(Prevotell)含量显著增高,非洲苏里南人、南亚苏里南人以拟杆菌属(Bacteroides)为主,荷兰人则以梭菌属(Clostridiales)为主。上述结果可能与其长期饮食有关,例如Prevotella通常与富含膳食纤维的植物性饮食有关,而类杆菌丰度通常被视为西方/城市化饮食的指标,与饮食富含脂肪、动物蛋白和糖含量丰富的食物相关。
以往多数研究结果显示,在肠道菌群“门”水平,IBS患者常见肠道菌门的排序为厚壁菌门(Firmlicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes ),而与对照组比较,IBS-D患者中放线菌门、厚壁菌门比例降低,拟杆菌门增多[14-16]。在属水平上,IBS和健康对照组之间检测到大量不同的属,不同研究的结果差异很大,研究表明,在肠道菌属水平,中国人群IBS-D患者肠道菌群中双歧杆菌、乳酸杆菌丰度下降,大肠杆菌、瘤胃球菌(Ruminococcus)升高[17]。Pittayanon等[18]纳入了来自22篇文章的24项研究发现,与对照组相比,IBS患者肠杆菌科(变形杆菌门)、乳酸杆菌科和拟杆菌属增加,而IBS患者粪杆菌属(包括Prausnitzii粪杆菌)、双歧杆菌属减少。研究发现,与健康对照组比较,IBS组中Acidamincoccaceae、Sutterellaceae和Desulfovibrionaceae的丰度显著升高,Enterococcaceae、Leuconostocaceae、Clostridiaceae、罕见小球菌属(Subdoligranulum)、直肠无杆菌属(Agathobacter)的丰度显著降低[19]。本课题研究结果显示:(1)在肠道菌群“门”水平,本地区IBS-D组与健康对照组人群中97%的肠道优势菌门排序为厚壁菌门、变形菌门、放线菌门、拟杆菌门,但IBS-D组厚壁菌门丰度降低,拟杆菌门丰度增加,这与多数研究[18-19]结果一致。(2)在肠道菌群“属”水平,IBS-D组瘤胃球菌(Ruminococcus_gnavus)丰度增加,普氏栖粪杆菌属(Faecalibacterium)、罕见小球菌属(Subdoligranulum)、直肠无杆菌属(Agathobacter)、毛螺杆菌科(Lachnospiraceae)、丹毒丝菌属(Erysipelotrichaceae)、罗斯氏菌属(Roseburia)、粪球菌属(Coprococcus)丰度减少,差异有统计学意义。
既往研究指出当肠道菌群“门”水平比例失调可能导致疾病发生,其可能发病机制探讨如下:(1)厚壁菌门(Firmicutes)一方面参与机体能量的吸收,与机体肥胖及糖尿病关系密切,另一方面其代谢产物生成自由基清除剂、炎症抑制因子等抑制肠道黏膜的炎症反应过程[20]。炎症性肠病及IBS-D患者中常检测到肠道菌群的厚壁菌门比例降低;已有研究证明了IBS-D肠道存在低度炎症状态;并说明厚壁菌门减少可引起IBS-D的低度炎症状态。研究还报告在既往的小鼠研究中发现小鼠精神行为改变与肠道微生物群中厚壁菌群比例紊乱存在显著相关性[21]。(2)变形菌门多数是革兰氏阴性菌,是机会致病菌。研究表明其增多与糖尿病相关,还与儿童营养不良等相关,还在特定条件下引起机体免疫异常进而出现胃肠道症状[22]。在肠道菌群“属”水平:(1)普氏栖粪杆菌属(Faecalibacterium)是一种革兰阴性杆菌,属厚壁菌门,可以合成并释放短链脂肪酸中的丁酸盐,丁酸盐经过β氧化为肠道黏膜提供能量,即可通过受体介导通路修复黏膜屏障,维持肠壁细胞的更新,一定程度上可以减轻焦虑抑郁精神障碍。普氏栖粪杆菌属(Faecalibacterium)为正常肠道菌群的显著标志物(占比5%以上),其数量的减少与肠道炎症和多种肠道疾病有关(包括克罗恩病、溃疡性结肠炎、IBS、慢性便秘和结直肠癌)[23]。(2)直肠无杆菌(Agathobacter)是一种产生丁酸盐的肠道有益菌,丁酸盐既可以为肠道黏膜提供能量,还可以减轻焦虑抑郁精神障碍,睡眠障碍的自闭症儿童粪便中检测Agathobacter明显降低[24]。(3)Ruminococcus_gnavus瘤胃球菌属于厚壁菌门,研究发现在炎症性肠病患者肠道中剧烈但短暂的瘤胃球菌大量繁殖,通常与疾病活动的增加同时发生[25]。Baumgartner等[26]通过结肠活检联合粪便16S测序检测发现,IBS-D及炎症性肠病患者瘤胃球菌过度生长,干预胆汁酸的积累与粪便胆汁酸排泄相关,从而加重腹泻的发生。
本课题通过16S rDNA测序技术比较海南地区IBS-D患者与健康对照者菌群的不同,其中主要表现为IBS-D患者肠道菌群的多样性、丰度降低,肠道有益菌减少。这些菌群的变化是通过何种途径引起IBS-D症状的出现,未来是否可作为IBS的生物标志物?本研究样本量较少,后续可进一步多中心研究,扩大样本量进行更深入的研究。

