红树林来源内生真菌活性产物研究进展
陈必婷,梁振益,温珍昌,郭志凯,徐 静*
(1.海南大学 化学工程与技术学院,海南 海口 570228;2.海南省热带农业生物资源保护与利用重点实验室 中国热带农业科学院海南热带农业资源研究院,海南 海口 571101;3.海南省热带微生物资源重点实验室 中国热带农业科学院热带生物技术研究所,海南 海口 571101)
红树林主要由木本植物组成,在亚热带和热带气候的沿海地区河口生长繁茂[1-3]。在海洋生态系统中,由灌木、蕨类、棕榈树等构成红树林的特殊生存环境系统,具有高盐、高温、强紫外辐射、缺氧、寡营养和频繁潮汐等特征,其独特的生境使得红树林成为最具适应力和生产力的生态系统之一[4-9]。目前全球范围内红树林可以分为9目20科27属,约70种,总面积约1700万hm2[10-11]。尽管不同地理环境下的红树林种类和特征不尽相同,但都有大量植物组织和微生物药用属性的报道[12-13]。
内生真菌是指寄生在植物组织内,在植物系统中度过生命周期的一部分而不会引起任何明显致病症状的真菌[14-17]。内生真菌大多属于子囊菌属,是一个多种类的群体[18]。据报道,高等植物中可能存在一种或多种内生真菌,宿主植物与内生真菌的相互作用可能会产生多种生物活性代谢物。内生真菌是一类重要的红树林真菌[19],红树林内生真菌作为海洋真菌第二大类群[27],其次级代谢产物的研究是一个极具潜力的新领域。红树林内生真菌与宿主植物共生而不断进化,形成了独特的生物活性物质合成途径或代谢途径,能够从中代谢出丰富的新颖结构和/或具有特殊功能的生物活性物质,如抗肿瘤、抗生素、神经保护、抗氧化、抗炎、抗病毒和免疫调节剂等[20-25]。
近年来,前人综述了红树林内生真菌产生的次级代谢化合物,如萜烯、色酮、香豆素、多酮、生物碱和多肽等[1,26,28],显示多种药理活性,是值得进一步研究的潜力药物[29]。科研工作者把目光集中在筛选先导药用化合物方面,并取得不少显著的成果[30-31]。下面将对红树来源内生真菌代谢的148个代表性活性的化合物按照不同生物活性分类,并从起源、化学结构、生物活性(如抗氧化、抗菌、抗肿瘤活性、免疫抑制等)等进行综述,以期为红树林来源内生真菌的进一步研究提供合理可靠的理论依据。
1 细胞毒性类化合物
从红树林植物新鲜叶片(海南文昌东寨港)中的内生真菌曲霉属Aspergillussp.HN15-5D的次级代谢产物中分离鉴定出2个异香豆素衍生物aspergisocoumrins A-B(1~2)[32],化合物1和化合物2对人乳腺癌细胞具有细胞毒性,其IC50值分别为(5.08±0.88)µmol/L和(4.98±0.74)µmol/L。Liu等从红树林植物Avicennia marina中分离得到的黑曲霉Aspergillus nigerMA-132中分离2个新α-吡喃衍生物(3~4),生物活性测试结果表明,化合物3对人胰腺癌细胞、人乳腺癌细胞和人肺癌细胞均有细胞毒性,IC50值分别为38、48和43µmol/L,均比阳性对照氟尿嘧啶的活性强,化合物4对HepG2细胞显示选择性活性,其IC50为62µmol/L[33]。Wang 等从海洋半红树林(广东省雷州半岛,中国)植物的根部来源的内生真菌链格孢Alternariasp.R6.分离出3个新的白藜芦醇衍生物(5~7),对所测试的3种人类癌症细胞系均具有抑制活性,包括MDA-MB-435、HepG2和HCT-116(IC50<50µmol/L),其中,化合物5 和6 都表现出对MDA-MB-435 和HCT-116 细胞系显著的细胞毒性,IC50<10µmol/L[34]。Huang 等从真菌Aspergillus tubingensis(GX1-5E)的乙酸乙酯粗提物中分离鉴定出1 个新的二聚萘吡喃化合物(10)以及3 个已知的化合物(8~9、11),在体外细胞毒性测试中结果表明,化合物8 对MCF-7、MDA-MB-435、Hep3B、Huh7、SNB19 和U87 MG 等肿瘤细胞系具有抑制活性,其IC50值在19.92~47.98µmol/L之间,化合物9、10和11同时也显示出轻微的细胞毒性[35]。2个新的四羟基蒽酮二聚体(12~13)被Yu 等从红树内生真菌Aspergillus versicolorHDN1009 中分离到,化合物12~13 对多种肿瘤细胞(HL-60、K562、H1975、MGC803 和HO-8910)表现出显著的细胞毒性,其IC50值范围为1.7~16.1µmol/L[36]。从蛇萝木叶内生真菌Cladosporiumsp.RSBE-3中分离2个具有细胞毒性的新化合物(14~15),Khan等通过对人白血病细胞(K-562)的WST-1测定,得到IC50值分别为3.97µg/mL和3.58µg/mL,可能是潜在开发细胞毒的先导化合物[37]。Meng 等从海洋红树林植物内生真菌青霉菌Penicillium brocaeMA-231的提取物中分离鉴定出4个新disulfide-bridged二酮哌嗪衍生物(16~19),化合物16~19对多种肿瘤细胞(Hela、HepG2和SW480等)均有细胞毒性,IC50值范围为0.89~9.0 µmol/L[38]。4 个新的大环内酯是从红树林内生真菌小孢子拟盘多毛孢Pestalotiopsis microsporaDL-F-3 中分离得到,即化合物(20~23)对小鼠淋巴瘤细胞株L5178Y 具有明显的细胞毒性,其IC50值分别为0.7、5.6、3.4和3.9µmol/L;化合物22对癌细胞株A2780具有明显的细胞毒性,IC50值为1.2µmol/L[39]。Chen 等从红树植物内生真菌Fusariumsp.2ST2 的乙酸乙酯浸提物中分离出2 个新的化合物(24~25),均对人A549细胞系具有明显的细胞毒性,IC50值分别为8.7和4.3µmol/L[40]。Wei等从红树来源的真菌Cytosporasp.JGM-9的发酵产物中分离出2个已知的化合物(26~27),它们对HepG2显示出明显的细胞毒活性,IC50值分别为(5.98±0.12)和(9.97±0.06)µmol/L,比阳性对照5-氟尿嘧啶[IC50值为(43.50±3.69)µmol/L]更强[41]。化合物1~27的结构见图1,其生物活性与产生菌的来源见表1。

表1 细胞毒性化合物1~27的生物活性与产生菌的来源Table 1 Biological activities of cytotoxic compounds 1~27 and sources of producing bacteria
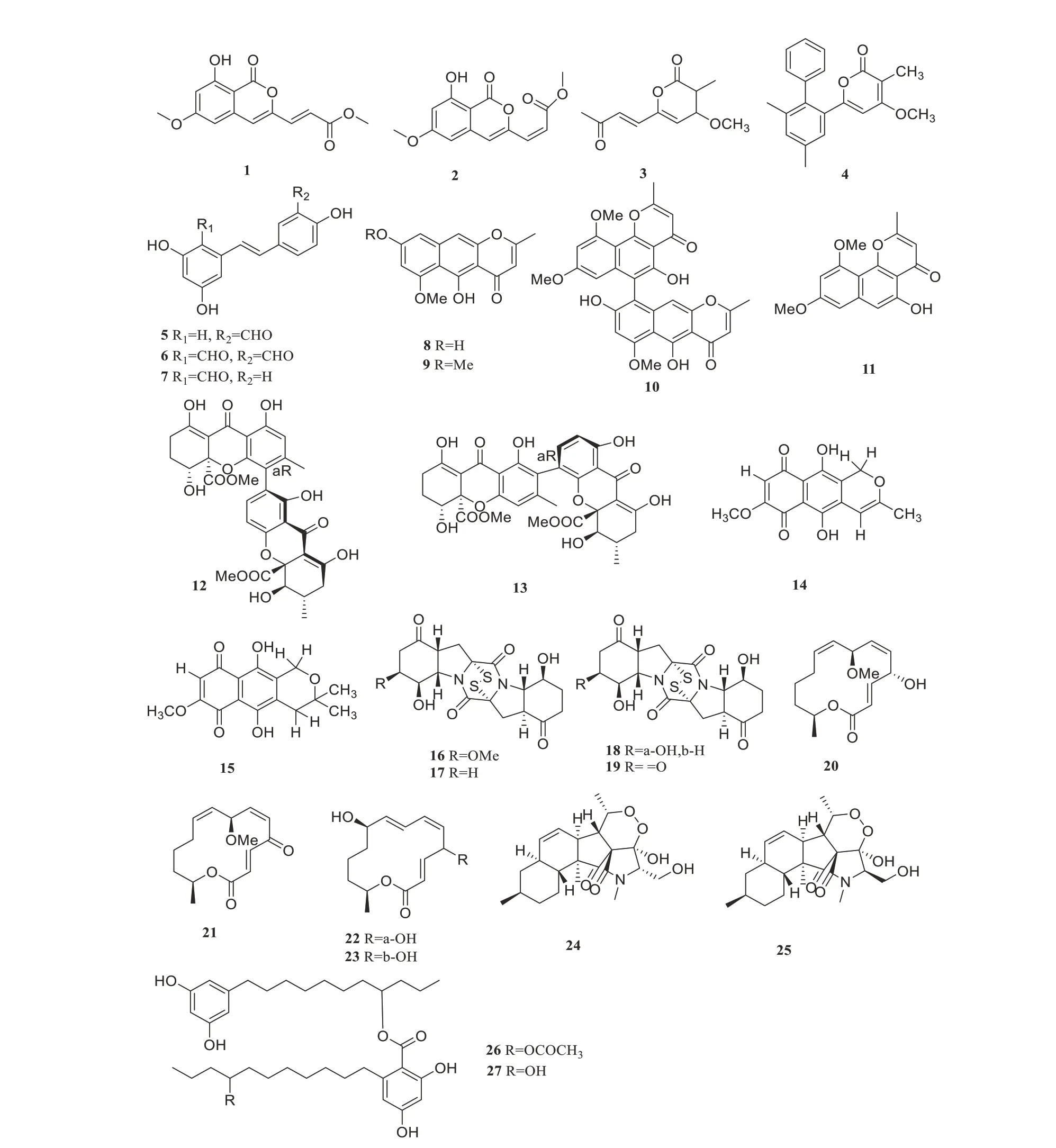
图1 细胞毒活性化合物1~27Figure 1 Cytotoxic compounds 1~27
2 抗菌活性类化合物
从红树林植物Myoporum bontioides根部来源的红树内生真菌Aspergillus clavatusR7分离鉴定出1个新的香豆素衍生物(28)和2 种已知的香豆素(29~30)[42],化合物28-30 对尖孢镰刀菌有显著抑制作用,其抑菌活性均高于阳性对照三唑酮,表明这些化合物可作为新型杀菌剂的先导。于红树林来源的内生真菌Parengyodontium albumV-4-L-1 的浸提物中获得2 个新化合物(31)和(33)和1 个已知化合物torrubiellin B(32),化合物31~33 显示出对金黄色葡萄球菌和MRSA 具有显著的抗菌活性,其MIC 值为0.39~3.12 mg/mL 之间[43]。Wang等从红树林植物(泰国)Xylocarpus叶子来源的内生真菌曲霉Aspergillussp.xy02的次级代谢产物里分离出来4 种新型酚类化合物(34~37),均对金黄色葡萄球菌ATCC 25923 表现出中等抑制活性,IC50在31.5~41.9µmol/L之间[44]。从红树林真菌青霉Penicillium dipodomyicolaHN4-3A 的次级代谢产物中分离到2 个新的生物相关化合物(38-39)[45],对MptpB具有较强的抑制活性,IC50值分别为(0.16±0.02)和(1.37±0.05)µmol/L。Chen等从红树林内生真菌的子囊菌类Ascomycotasp.CYSK-4中分离得到1个新的异香豆素(40)以及2个已知的类似物(41~42)[46],化合物40~42对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、肺炎克雷伯菌和乙酸钙不动杆菌均有一定的抑菌作用,MIC 值为25~50 mg/mL。同年Yang 等又从内生真菌Aspergillus nidulansMA-143来源的乙酸乙酯提取物中得到1个新的化合物isoversicolorin C(43)和1个相关代谢物(44),化合物43和44对部分被测微生物(大肠杆菌、黄体分枝杆菌、创伤弧菌、鳗弧菌、溶藻弧菌、伊塔鲁弧菌和副溶血性弧菌)具有较强的抗菌活性,其MIC值为1~64 mg/mL[47]。Chen等从红树林Acanthus ilicifolius健康叶片中内生真菌Lasiodiplodia theobromaeZJ-HQ1 中分离得到2 个新的氯化前体素chloro-preussomerins A 和B(45~46),以及4个已知的前体素类似物(47~50),抗菌实验结果表明,化合物45~50对金黄色葡萄球菌具有明显的抑菌活性,其MIC值在1.6~13 mg/mL之间[48]。化合物28~50的结构见图2,其生物活性与产生菌的来源见表2。

表2 抗菌活性化合物28~50的生物活性与产生菌的来源Table 2 Biological activities of antibacterial active compounds 28-50 and the source of producing bacteria
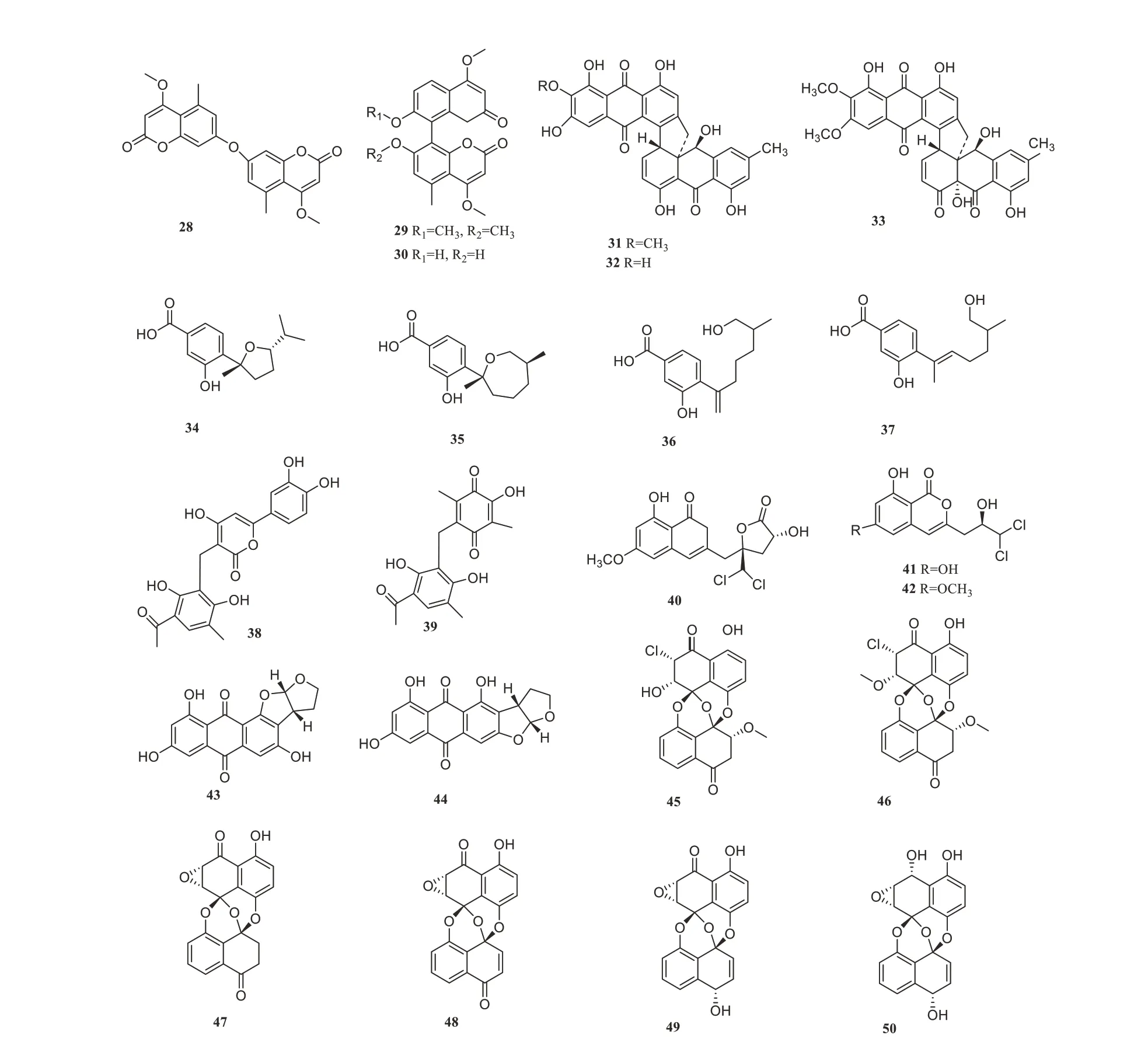
图2 抗菌活性化合物28~50Figure 2 Antibacterial compounds 28~50
3 抗氧化活性类化合物
Yan等从内生真菌Epicoccum nigrumSCNU-F0002中获得了3个新的异苯并呋喃酮化合物(51~53),以及3个已知的相关二聚体(54~56),化合物(51~56)的抗氧化活性优于阳性对照没食子酸和维生素C,IC50值在10.2~15.3µmol/L之间[49]。2个新的苄基衍生物aspergentisyl A(57)和aspergentisyl B(58)以及7个已知的戊烯基苯甲醛衍生物(59~65)被Sun等从海洋源真菌Aspergillus glaucusHB1-19中分离得到,化合物57~65均表现出较强的自由基清除活性,IC50值在9.3~24.2µmol/L之间[50]。Zou等从红树植物鲜叶的内生真菌Epicoccum nigrumMLY-3得到2个新代谢物(66~67)与3个已知化合物(68~70),化合物66~68、70显示DPPH自由基清除活性,IC50值为14.7~29.3µmol/L,化合物66~70 可有效清除ABTS 自由基,IC50值在18~29.2µmol/L 浓度范围内,比抗坏血酸阳性对照[IC50=(33.6±0.8)µmol/L]的活性更高[51]。Guo等从红树植物Rhizophora stylosa根际土壤中获得的Penicillium solitumGWQ-143 分离得到了化合物71和72,它们对DPPH具有较强的自由基清除活性,IC50值在4.7~15.0µmol/L之间[52]。化合物51~72的结构见图3,其生物活性与产生菌的来源见表3。

表3 抗氧化活性化合物51~72的生物活性与产生菌的来源Table 3 Biological activities of antioxidant compounds 51-72 and the source of producing bacteria
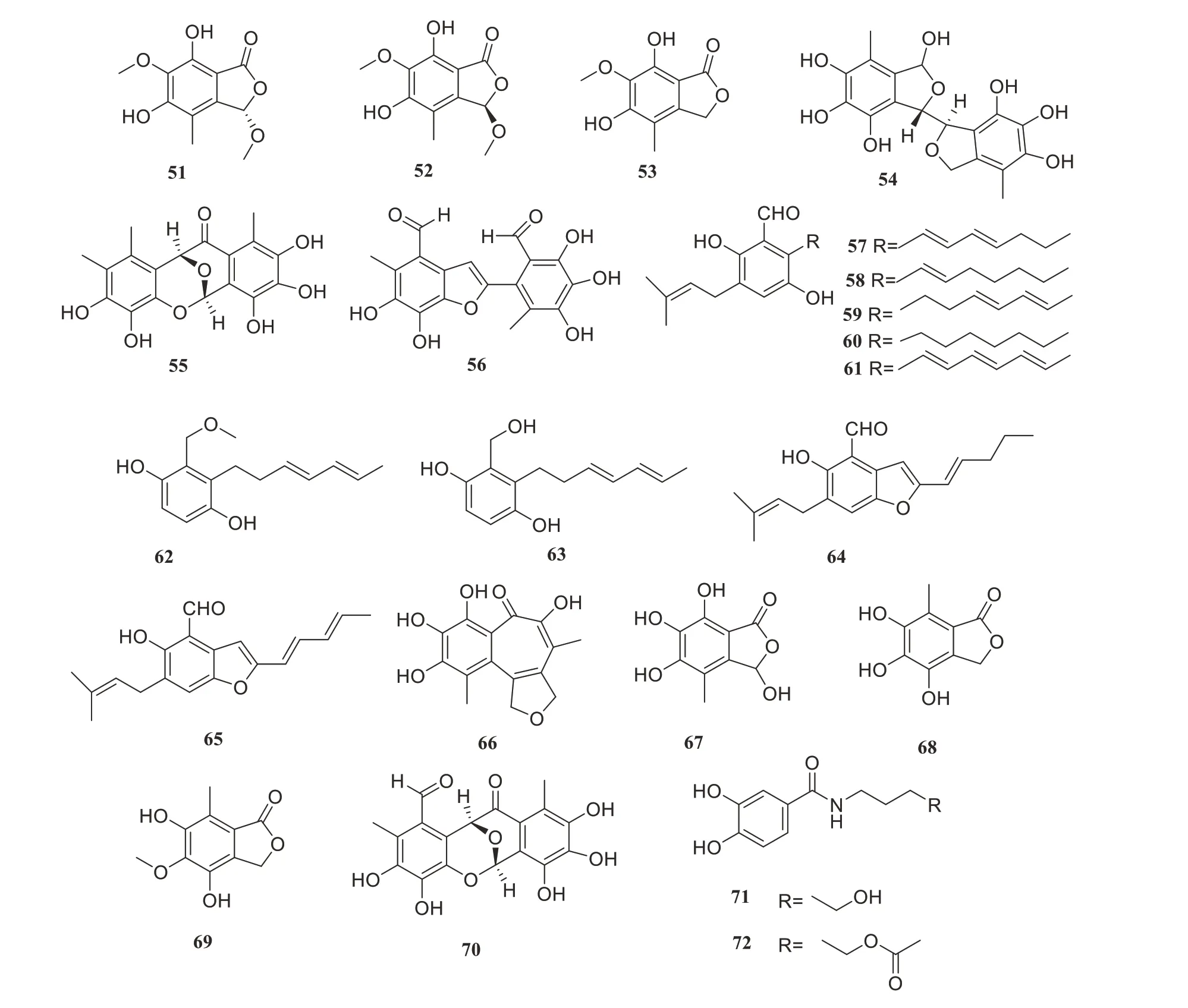
图3 抗氧化活性化合物51~72Figure 3 Antioxidant Compounds 51~72
4 抗炎活性类化合物
红树林内生真菌可产生许多抗炎活性的次级代谢产物,研究者从红树内生真菌Phomasp.SYSU-SK-7中分离鉴定出2 个新类固醇激素甾醇A-B(73~74)和1 个已知的类似物(75),化合物(73~75)抑制脂多糖(LPS)诱导RAW264.7细胞的毒性的IC50值分别为13.5、25.0和12.5µmol/L[53]。同年Chen等从红树林内生真菌分离Phomopsissp.SYSUQYP-23得到1个新inomalein H(76)和1个新线性融合的戊烯基吲哚生物碱(77),连同4个已知化合物(78~82),化合物76~82有突出的抗炎活性,IC50值在4.5~25µmol/L浓度之间[54]。Cui等从红树来源的内生真菌Diaporthesp.SYSU-HQ3的粗提取中分离获得5个新化合物和2个已知物(83~89),7个化合物具有抗炎活性,IC50值在4.2~9.0µmol/L 浓度之间[55]。Qin等从红树林植物Acanthus ilicifolius叶片上的内生真菌Aspergillussp.GXNU-Y45中分离得到3个未描述的化合物guhypoxylonols A-C(90~92)和1个先前报道的代谢物(93),它们对一氧化氮(NO)的产生具有抑制活性,其IC50值分别为(14.42±0.11)、(18.03±0.14)、(16.66±0.21)和(21.05±0.13)µmol/L[56]。3个未描述的氮芥菌素衍生物(94~96)被Jiang 等从1种红树林内生真菌青霉Penicillium sclerotiorumZJHJJ-18 发酵培养基中分离,显示明显的抗炎活性,IC50的范围值为6.30~9.45µmol/L[57]。Liu等从红树林真菌Aspergillussp.DM29中分离得到了2种新的麦角甾酸(97~98),化合物97~98在4.5~3.6µmol/L浓度范围内表现出较强的体外抗炎作用[58]。Liu等从红树林内生真菌Talaromycessp.SK-S009的乙酸乙酯粗提物中分离鉴定出1个新的衍生物99和10个已知化合物(100~109),这些化合物的IC50值在1.7~49.7µmol/L之间[59]。化合物73~109的结构见图4,其生物活性与产生菌的来源见表4。
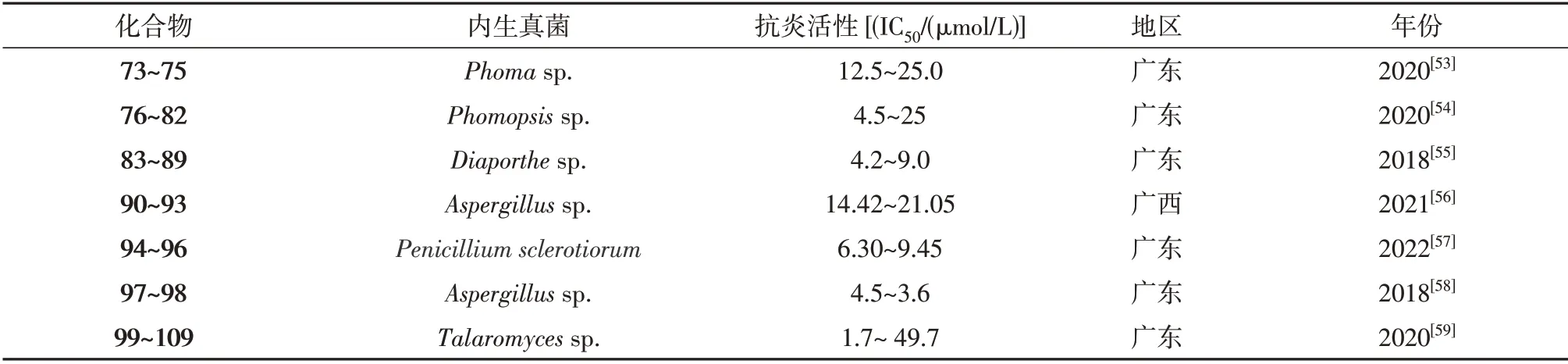
表4 抗炎活性化合物73~109的生物活性与产生菌的来源Table 4 Biological activities of anti-inflammatory active compounds 73-109 and sources of producing bacteria
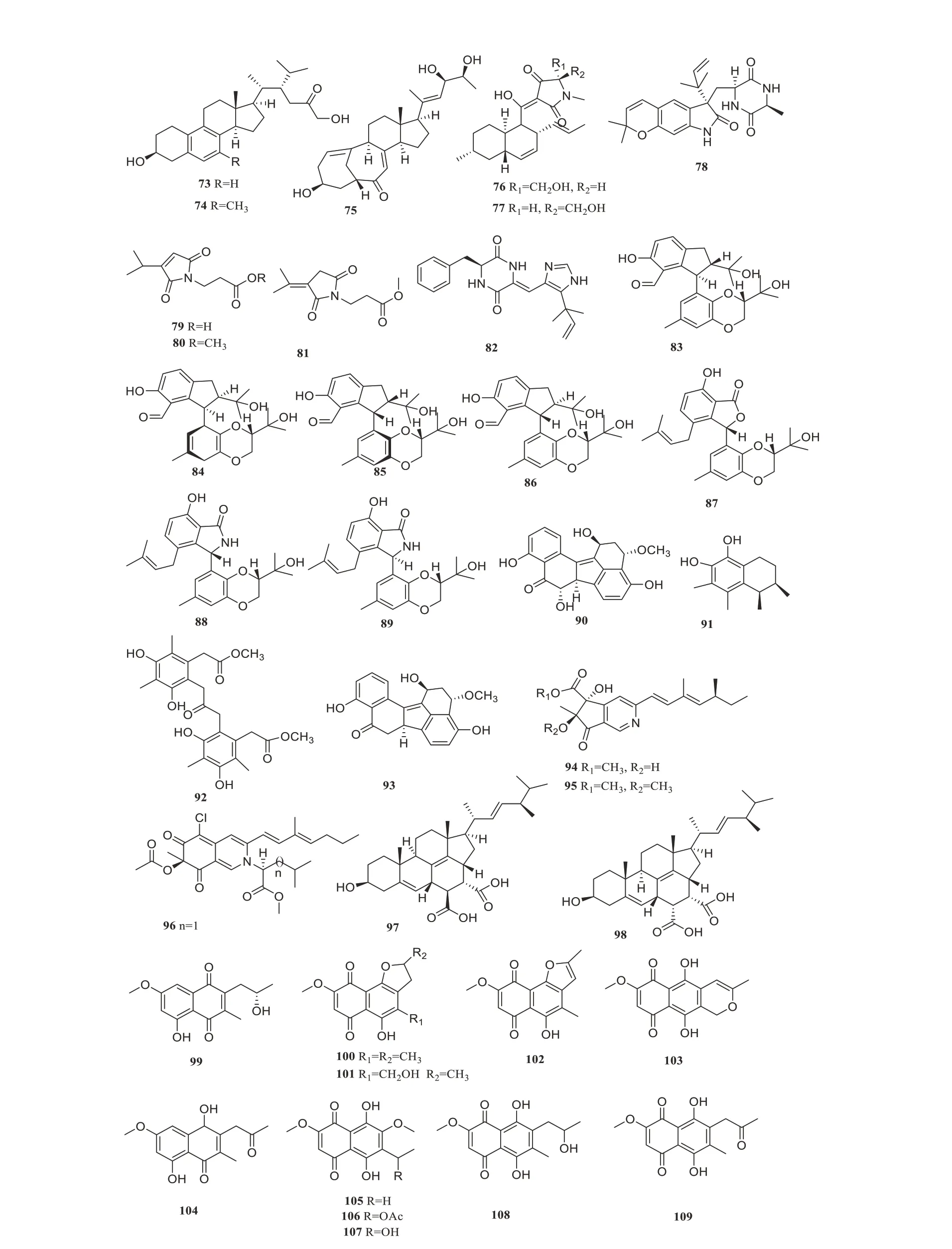
图4 抗炎活性化合物73~109Figure 4 Anti-inflammatory compounds 73-109
5 α-葡萄糖苷酶抑制活性类化合物
Zheng 等从红树真菌Dothiorellasp. ML002 中分离到2 个新的cytosporone 类衍生物dothiorelone K 和L(110~111)和1 个已知的dithiorelone I(112),化合物110~112 对α-葡萄糖苷酶具有抑制活性,IC50值分别为22.0、77.9 和5.4µg/mL,结果表明cytosporone 类衍生物可作为1 种有效的糖尿病控制药物[60]。Cui 等从南海红树林植物海桑(Sonneratia ovata)的新鲜支系中内生真菌Nectriasp.HN001的培养物中分离得到2个新聚酮类化合物(113~114),在α-葡糖苷酶抑制活性筛选后,化合物113 和114 具有较强的抑制活性,其IC50值为23.5µmol/L 和42.3µmol/L,分别比阳性具有更强有力的抑制作用(阿卡波糖,IC50为81.3µmol/L)[61]。Cai等又从红树林来源的内生真菌Aspergillussp.ZJ-68的发酵培养基中分离到1个新的苯并丙烷类衍生物(115),其明显抑制α-葡糖苷酶的活性,IC50为12.4µmol/L[62]。2015年Chen等从红树林植物秋茄(Kandelia obovata)内生真菌Meyerozyma guilliermondii(HZ-Y2)中分离到3 个新的botryorhodines(116~118)以及3 个已知化合物(119~121),6个化合物均表现出较强的α-葡萄糖苷酶抑制率,IC50范围值为2.1~13.3µmol/L[63]。Yang等从红树植物内生真菌Talaromycessp.CY-3分离5个新化合物(122~126),抑制α-葡萄糖苷酶的活性优于阳性对照1-deoxynojirimycin[IC50=(80.8±0.3)µmol/L],其IC50值在(12.6±0.9)~(57.3±1.3)µmol/L 之间[64]。Chen 等从红树林内生真菌Talaromyces amestolkiaeYX1中分离得到1个新的异香豆素类化合物以及3个已知的异香豆素类似物(127~130),化合物127~130 表现出α-葡萄糖苷酶抑制活性,IC50值分别为89.4、17.2、36.4 和38.1µmol/L[65]。Ye 等从红树林来源的真菌Aspergillussp. 16-5c 的发酵产物中分离到2 个新的生物碱aspergiamides A-B(131~132)和4个已知生物碱(133~136),化合物131和133显示显著的抑制α-葡萄糖苷酶活性,IC50值分别为18.2和7.6µmol/L;化合物132、134、135和136表现出中等程度的抑制α-葡萄糖苷酶活性,IC50值在40.7~83.9µmol/L 之间[66]。Chen 等从真菌青霉Penicillium steckiiSCSIO 41025 的粗提物中分离鉴定得到2 个已报道的化合物(137~138),具有α-葡萄糖苷酶抑制活性,IC50值分别为64.1 和91.4µmol/L[67]。化合物110~138的结构见图5。
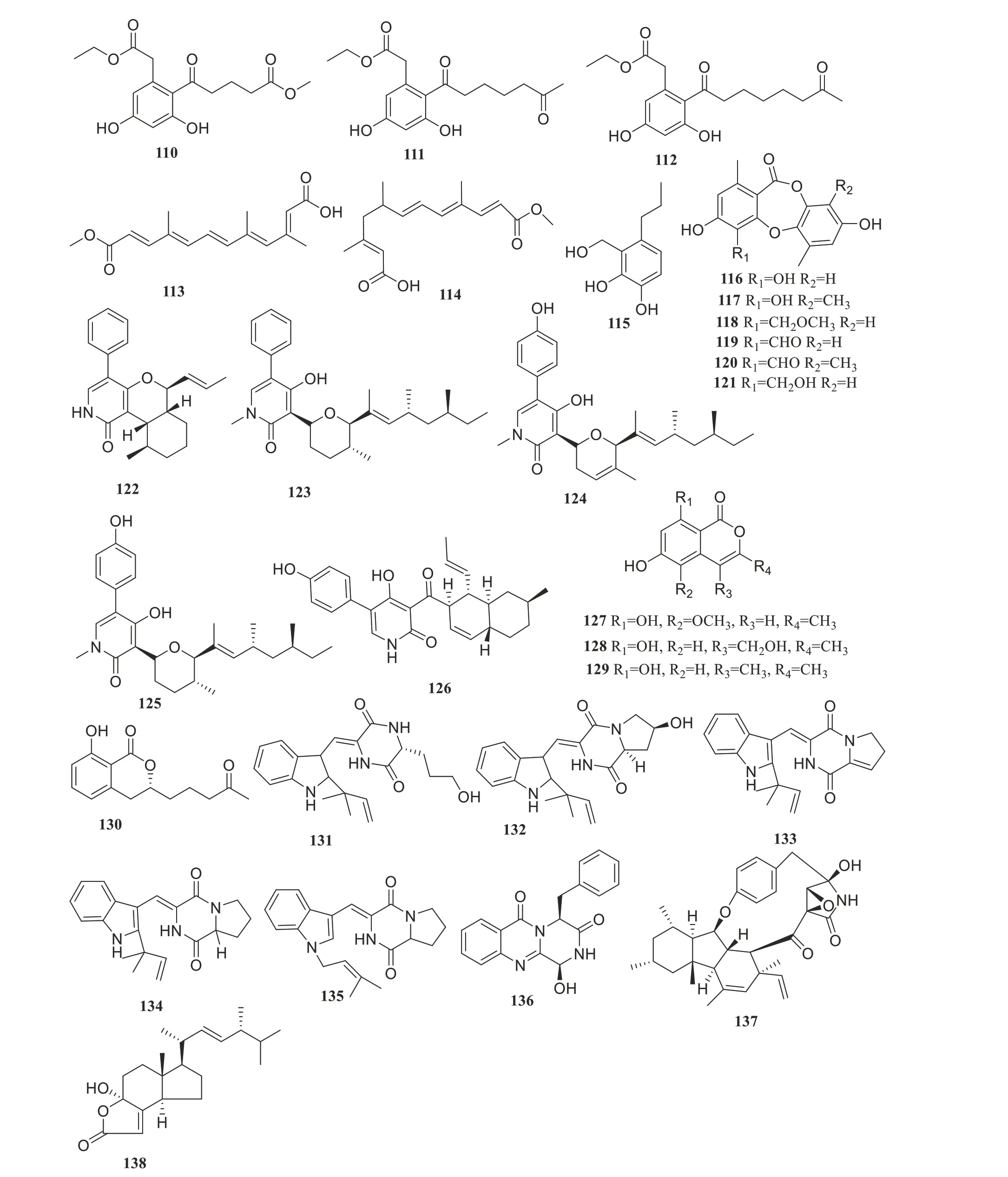
图5 α-葡萄糖苷酶抑制活性化合物110~138Figure 5 α-glucosidase inhibitory compounds 110-138
6 其他生物活性类化合物
An等从海洋红树林植物Rhizophora stylosa叶片中的内生真菌Aspergillus nidulansMA-143中分离并鉴定出4 个新的喹唑啉酮类生物碱,即aniquinazolinone A~D(139~142),对分离得到的化合物139~142 进行了盐水对虾毒性检测,发现化合物对盐水对虾的IC50值分别为1.27、2.11、4.95和3.42µmol/L,均强于阳性对照秋水仙碱(IC50值为88.4µmol/L)[68]。同年An 等从海洋红树林植物Rhizophora stylosa新鲜叶片内生真菌Aspergillus nidulansMA-143中分离并鉴定了2个新的4-苯基-3,4-二氢喹诺酮衍生物(143~144)和相关的黄曲喹诺酮A(145),在生物筛选实验中,化合物对卤虾的IC50值分别为7.1、4.5和5.5µmol/L[69]。Guo等在红树林植物Acrostichum specioum叶片中的烟曲霉Aspergillus fumigatusJRJ111048提取物中分离到1个新的酸酐衍生物aspergide(146),化合物146对斜纹假丝酵母初孵幼虫有较强的杀虫活性[5]。Meng 等从海洋红树林植物Avicennia marina新鲜组织中内生真菌Penicillium brocaeMA-231分离到1种新的多氧二氢吡喃[2,3-c]pyrroles-4,5-dione衍生物pyranonigrin F(147)和一种相关的已知化合物pyranonigrin A(148)。化合物147~148具有广泛的抗植物病原菌活性,MIC为0.5 mg/mL,强于阳性对照博莱霉素[70]。化合物139~148的结构见图6。
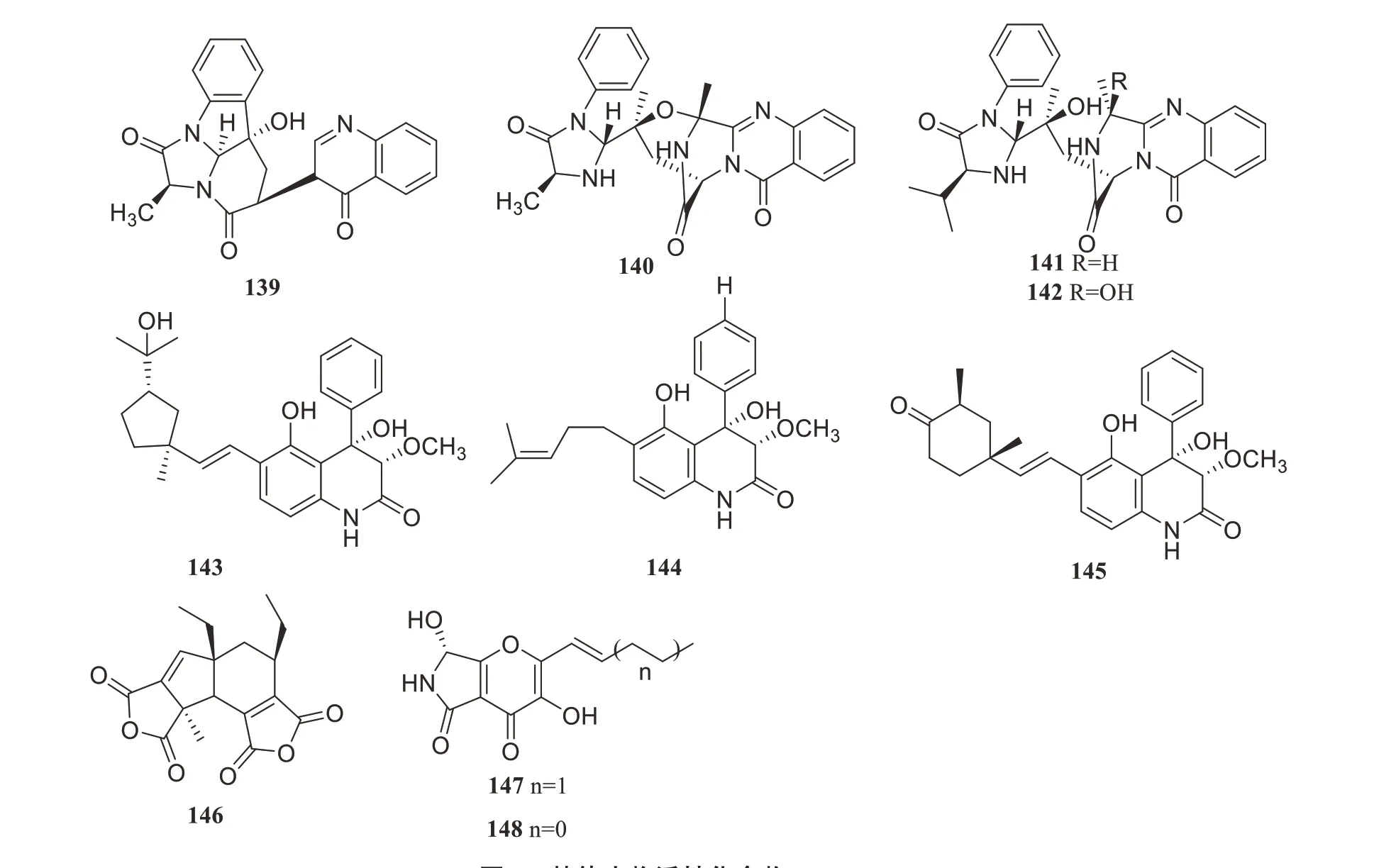
图6 其他生物活性化合物139~148Figure 6 Other active compounds 139-148
7 结论
红树林内生真菌因其在独特的生存环境决定了其新颖的结构特征和广泛的生物活性,与现代临床药物相比,有些化合物的生物活性更加显著,是天然药用分子的重要来源。本文总结了从红树林内生真菌中分离得到148个活性产物,结构类型为生物碱(31个,21%)、醌类(25个,17%)、酚类(22个,15%);生物活性主要为细胞毒性活性(27个,18%)、抗菌活性(23个,16%)、抗氧化活性(22个,15%)、抗炎活性(37个,25%)、抗α-葡萄糖活性(29个,20%)。目前对红树林内生真菌的研究主要集中在独特结构次级代谢产物的分离鉴定以及常见生物活性初步筛选评价,对红树林内生真菌的代谢物进行了有限的化学研究;另一方面,研究中发现的具有不同作用模式的各类结构骨架,可能在药物发现中发挥重要作用。
目前对红树林内生真菌其次级代谢产物的研究存在很大的创新研究空间,必须引导新的手段获取结构独特活性显著的代谢物,从而加快药物发现的进程。表观遗传学方法可以通过激活“沉默基因”进一步帮助更大规模地转化生物活性代谢物的生产。随着对微生物天然产物生物合成基因簇的挖掘和随之进行的相关酶催化机制研究的进一步深入,增加新化合物的可能性和多样性,多模型筛选代谢产物中寻找新型活性物质,对获得的天然产物进行深入的化学与生理活性和作用机制研究,以确定疾病的靶标,从而获得更多药物先导化合物。

