全面生化反应和血清学检验在沙门菌临床检验中的应用研究
蒋涵超 宋良
随着人们生活水平不断提升,人们外出就餐的机会越来越多,在外出就餐过程中,通常不能完全保证食品安全问题。根据临床大量研究表明[1],全球范围内食物中毒事件以沙门菌感染为主。沙门菌主要存在于人体肠道当中,一旦出现沙门菌感染就会引起患者呕吐、恶心等症状,严重者甚至会出现休克等症状,对患者的生命安全带来一定威胁。肠热症是因沙门菌感染导致的疾病,发病率较高,临床上主要通过全面生化反应、血清学检验等检查方式进行干预,有助于及时对疾病进行诊断,并为患者提供临床治疗依据[2]。本文主要以张家港市第五人民医院收治的40 例肠热症患者作为研究样本,对患者实施全面生化反应与血清学检验方法,分析其检验准确率,现报道如下。
1 资料与方法
1.1 一般资料
选取张家港市第五人民医院2020年1月至2021年7月期间接受治疗的疑似肠热症患者40 例作为研究对象,主要判断依据:急性起病,有发热、畏寒症状,常伴有恶心呕吐、咳嗽、腹痛、腹泻,粪便多为黄色或绿色稀水便,带有黏液或血等[3];经病原菌的分离与培养、药物敏感分析确诊以上40例均为沙门菌感染。男性22 例,女性18 例;年龄20~49 岁,平均(33.46±3.04)岁。本研究得到医院医学伦理委员会批准。
纳入标准:(1)经过病原菌分离、培养,药物敏感分析确认为沙门菌感染患者;(2)患者知情研究内容,且已经与医院签署相关协议书。排除标准:(1)患者存在其他严重感染性疾病;(2)伴随着重要脏器疾病或功能障碍;(3)合并认知障碍、精神疾病等。
1.2 方法
(1)样本采集:根据患者不同的疾病情况选择不同的样本采集方法:①在患者发病1 周之后采集患者的空腹静脉血液;②患者发病3 周后采集患者的骨髓液;③对于需要采集粪便、尿液患者来说,标本采集时间为发病15 d 左右,如患者的临床症状表现为急性期,则患者入院早期就要根据患者病情及时采集粪便,采集时间为晨起用药之前;④发病2 周之后对患者的尿液标本进行采集,尿液标本采集之后予以离心沉淀处理后待用;⑤如患者属于沙门菌类食物中毒疑似病例,除了尿液、粪便、血液等标本之外,还要对患者的呕吐物标本进行采集。以上样本分别接受常规检验、全面生化反应检验及血清学检验,其中常规检验设为参照组,全面生化反应检验及血清学检验作为试验组,同一患者采用同一样本进行检测。
(2)设备材料:检验中应用到的设备包括接种棒、显微镜、灭菌平皿、均质器、灭菌吸管、毛细管、镍络丝、玻璃棒、温箱、酒精灯、小试管等。配置试剂以及培养基过程中,应用氯化镁孔雀绿增菌液以及四硫磺酸钠煌绿增菌液;琼脂方面应用亚硫酸铋琼脂、HE 琼脂以及沙门氏菌琼脂等。
(3)检测方法:①常规检验方法:通过沙门菌的培养,进行细菌分离培养,根据培养基上生长特征来判定沙门菌;②生化反应试验及血清学试验:该方法主要通过采集患者的样本,先进行菌落培养初步判断,再通过血清学检测对生化反应结果进行验证。具体方法是先将可疑的菌落接种在1%的TSI 琼脂中,进行初步排除;凝集之后方能进行血清学检验,大部分沙门菌都处于A~F 群当中,在凝集这一环节期间,通常是以O 多价血清A~F 作为主要模式;采用血清因子定群措施,指标为6 个O 群因子,而后以H 单个因子血清采用凝集措施,促使第一相与第二相凝集,得到最终结果就能判定患者的具体血清型。在全面生化反应检验之前需要及时挑选出可疑菌落,将其与三糖铁琼脂进行接种,观察其反应;如只有斜面产酸,且有阴性硫化氢菌株,即可排除。在三糖铁琼脂接种期间,主要接种方案在于蛋白胨水,能在靛基质实验中直接应用,同时还要接种尿素琼脂、氰化钾培养基、赖氨酸脱羧酶培养基以及对照培养基等,培养时间为24 d,培养环境为35~37℃,如有必要可延长培养时间到48 h。
1.3 观察指标
比较两组患者的沙门菌检出率。常规检验方法通过采集患者样本放于灭菌生理盐水试管中,然后进行细菌分离培养,在培养基上划线培养,根据培养基上细菌的生长特征,即培养24 h 形成中等大小、圆形、表面光滑、无色半透明、边缘整齐的菌落,同时通过TSI 琼脂斜面判定是否斜面为红色,底部变黑并产气,如有以上特征,判定为有沙门菌阳性。全面生化反应试验阳性标准:液面试剂表现为红色,证明结果为阳性,如液面试剂表现为黄色,则表明结果为阴性[4]。血清学检验标准:副伤寒沙门菌的H 凝集效价在1 ∶80 及以上,O 凝集效价在1 ∶80 及以上,H 凝集效价在1 ∶160 级以上,则说明沙门菌抗血清呈阳性[5]。
1.4 统计学方法
数据均输入SPSS 21.0 统计软件进行分析,沙门菌检出率纳入到计数数据中,以n(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
试验组患者的沙门菌检出率明显高于参照组,对比差异有统计学意义(P<0.05)。见表1。
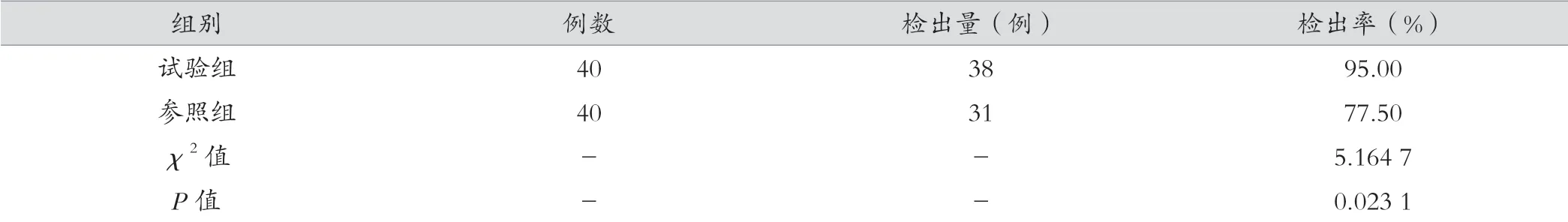
表1 两组患者的沙门菌检出率对比
3 讨论
沙门氏菌是近百年来在全世界范围内引起食物中毒最常见的诱因,是一种革兰阴性菌,分为6 个亚属,目前被鉴定的血清型已经超过2 500 种,是比较重要的人畜共患病病原体[6]。人体感染沙门氏菌之后,细菌会损伤人体的免疫系统,从而引起多种疾病,大多数患者会出现肠胃炎,少数血清型会引起肠热,属于一种比较严重的疾病,如副伤寒沙门氏菌A、伤寒沙门氏菌等,与人类疾病相关的最常见的血清型还包括肠炎沙门氏菌等。临床相关研究表明[7],美国每年都有140 万人以上向疾控中心报告感染沙门氏菌;欧洲每年感染沙门氏菌的患者有16 万人次以上,发生率为0.035%;从我国沙门氏菌发病率上进行统计分析,我国出现多起因沙门菌引起的食物中毒事件,给人们的身体健康带来较大的影响。细菌性食物中毒大部分都是因感染沙门氏菌引起,对我国人民群众的身体健康以及生命安全均有严重危害,已经逐渐成为目前比较关注的公共卫生问题。
目前针对沙门氏菌的检验以及鉴定方法多种多样,传统沙门氏菌分离主要是采用选择性预富集对制订的体积样品或质量进行干预,而后予以选择性富集步骤,铺在选择性琼脂上,确认其可疑菌落的血清学以及生化检验结果。传统的检验方法结果可靠,灵敏性以及特异性均比较高,但是传统检验方法耗费的时间比较长,如患者属于食物中毒感染,则不能及时回应,对患者的治疗产生一定影响。血清学鉴定方法就是充分应用抗原抗体的特异性反应,从而观察到明显的凝集现象。
从目前沙门氏菌检验步骤上分析,基本可将其归纳为预增菌、选择增菌、选择平板分离、生化试验以及血清学分型鉴定这些步骤。这些步骤涉及面比较广泛。
(1)从预增菌上分析:尽管沙门氏菌在自然界中分布相对广泛,但是偶尔会受到不同因素影响,不同类别样品中的额沙门氏菌会受到不同程度损伤致残,处于濒死状态,因此不容易检出。采用无选择性增菌培养液,能促使致残细菌得以修复、繁殖,而后选择性增菌培养就能进一步提升阳性检出率,且应用预增菌之后,避免样品对增菌液中抑制剂干扰,充分发挥选择增菌液作用,进一步提升阳性检出率。预增菌这一方法国内应用相对较晚,1985年卫生部在食品微生物检验方法当中提出使用缓冲蛋白胨水操作规程、注意事项、附加规范以及处理方法进行干预,结果显示其阳性检出率有明显上升,能提升其检出率。预增菌的缺点在于不能鉴别增殖的沙门氏菌;分离结果比较依赖于采样者的实践经验以及实验室操作水平;标本接种量以及培养液之间的比例从理论上并没有找到依据。
(2)从选择增菌这一步骤上分析:选择增菌的目的在于抑制样品中其他杂菌生长,有助于促进沙门氏菌增殖,进一步提升阳性检出率。不同沙门氏菌对抑制剂的耐受力不同,部分抑制剂可能会导致增殖的沙门氏菌本身破坏以及死亡,目前标准方法是应用四硫磺酸钠亮绿培养基(linearguide training box,TTB)、亚硒酸盐胱氨酸(selenite cystine,SC)同时进行增菌。但是TTB 对甲型副伤寒沙门氏菌有一定抑制作用,对伤寒沙门氏菌增菌效果也并不理想。本研究应用氯化镁孔雀绿增菌液以及四硫磺酸钠煌绿增菌液作为增菌液,具有良好的增菌效果。导致选择增菌产生误差的主要原因在于标本接种量,不同接种量有比较明显的差别,但是接种量比例目前存在一定争议,增菌液品种不同的接种量也有一定差异。
(3)从选择平板分离这一步骤上进行分析:比较常见的分离培养基可根据选择性强弱分为不同类别,其中亚硒酸铋琼脂属于强选择性;酚红煌绿琼脂为中选择性;麦康凯琼脂为弱选择性[8]。平板分离培养基尽管不能将不同菌型进行有效鉴别,但是在选择性检出率、促进沙门氏菌生长、减少物质消耗等方面有一定作用。近年来通过对沙门氏菌的营养进行相关研究,结果显示大部分沙门氏菌均需要谷氨酸,绝大部分沙门氏菌利用对氨基苯甲酸等作为生长因子,将克式双糖铁成分与靛基质、赖氨酸、尿素等综合在一支试管当中,经24 h 后可观察到8种生化反应,能达到沙门氏菌检验项目相关要求。
(4)从生化试验方面分析:全面生化反应试验能对可疑记录进行收集,并有效培养,进而判定沙门菌,应用范围比较广泛[9]。
(5)从血清检验方面分析:在生化试验检验基础上对沙门氏菌血清型进行研究,相关报道并不多,主要集中于以下方面:①双相菌第2 相H 抗原缺失;②复合的双相H 抗原;萨林纳斯沙门氏菌属于一种具有复合双相H 抗原的沙门氏菌,这一菌种具有两套H 抗原基因,一旦被H:d 抗血清诱导,就会产生4,12,e,h:e,n,215,与圣地亚哥血清型不能区别。③H 抗原的R 相;④无动力菌隐藏的H 抗原;⑤O 抗原的点突变。O 抗原是由脂多成分构成,经多个重复寡糖单元链接而成,在细胞外膜中分布[10]。多糖侧链部分能产出O 抗原,其特异性也是来自于此。编码为O 抗原基因主要包括菌体表面抗原合成基因、O 抗原转位酶编码基因等,大多数都有高度特异性,基因的表达调控机制比较复杂。O 抗原具有多样性特点,引起这一特点的原因多种多样,主要有肽键多样性、单糖种类多样性等。沙门氏菌当中含有多种O 抗原,不同种类O 抗原个数、种类均有一定差异,可根据其类别不同将其归属于不同种类,只有A~E 群感染才会导致人体患病。H 抗原是鞭毛蛋白,主要由鞭毛素组成,鞭毛素并不耐热,因此H 抗原也有不耐热的特性[11]。鞭毛对沙门氏菌的运动、侵袭等有重大作用,根据临床相关研究表明:通过临床统计得知,已经发现的H 抗原已经有百余种,沙门氏菌大部分表达为2种H 抗原,少数仅仅含有单一相H 抗原,也被称之为单项菌[12]。
沙门菌的血清型不同,其宿主也有所不同,但也有相同的宿主,可根据宿主选择性将沙门氏菌分为两种,一种是宿主适应性,另一种是非宿主适应性。前者血清型对宿主的要求为:宿主本身需要具备一定的选择性,如伤寒沙门氏菌、马流产沙门氏菌、羊流产沙门氏菌等;非宿主适应性血清型对宿主的选择性则相对来说比较广泛,包括肠炎沙门氏菌等。目前针对血清型分型方法也比较多,分别有玻片凝集反应、抗体微阵列技术、全基因组信息或PCR 扩增等[13]。从玻片凝集反应上进行分析,这一试验就是根据菌体与相应单价血清反应进行判断抗原成分,分析其凝集现象发生与否进行判断。对沙门氏菌实施玻片凝集反应前,需要对沙门菌进行鉴定以及纯化,之后需要对H 抗原以及O 抗原进行检测,检测期间进行液体培养。首先需要进行自凝试验,而后检测Vi 抗原,如在检测过程中与Vi 抗原产生凝集,则要适当加热予以破坏,而后进行O 抗原检测[14]。沙门氏菌的血清分型分析一般都需要2~3 d,是基础分析项目,要求检验人员在凝集试验结果判定期间需要有足够的经验。这种检验方法的分辨率相对较低,可能会出现交叉凝集甚至不凝集情况;且在检验期间需要耗费许多血清试剂,仅能检测比较差的血清型,在进化关系分析方面,血清分型并不能充分反映出遗传相关性[15]。本研究结果显示,试验组患者的检出率相比于参照组明显较高 (P<0.05),由此可见,相比于常规检验方法来说,血清检验与全面生化反应检验的应用效果更好。
为了弥补传统单一检测技术当中存在的不足之处,临床学者们应用多种检测技术,如纳米技术、光谱技术、电子显微镜技术、传感技术等,将多种技术相互结合,为沙门氏菌的检测以及鉴定带来新契机。在PCR 扩增之后通过扩增产物的差别,其溶解曲线也会发生相应的变化,通过对溶解曲线变化识别区分产物就是高分辨溶解曲线检测,核酸序列遗传差异,从而对沙门氏菌进行分类以及分型。通过对46 种不同血清型的417株沙门氏菌分离株进行高分辨率溶解曲线进行分析,结果显示能明确、简便鉴定其中37 种血清型,这一方式具有准确、经济以及简单等优势,应用效果比较好。电子显微镜技术等应用于沙门氏菌的血清型分型中,也能通过电化学阻抗谱监测获得良好的检测效果。
沙门菌的鉴定与沙门菌的分型都能为临床及时确定沙门菌感染疾病来源,从而及时予以控制,给予正确临床靶向治疗。针对沙门菌感染爆发事件,必须在短时间内对病原菌进行正确的分型,这一技术有望成为沙门菌感染治疗以及感染源控制的有效管理方法。目前在沙门菌分类以及沙门菌鉴定核心中,主要为血清型分型,但是在血清型分型中存在一定缺陷,检测的灵敏度、特异度等均是一个挑战,随着临床对各种新技术的研究越来越深入,一些技术逐渐从研究阶段逐渐应用于临床,对传统血清学分型方式予以补充。在沙门菌血清型分型中,不同的应用方法有各自的特色,但是理想的血清型分型方式不但能有快速的反应能力,还能准确鉴定病原菌,追踪传染源,确定同源性以及进化关系等相关信息,目前正在不断探索中。
综上所述,沙门氏菌临床检验中应用全面生化反应检验与血清检验的应用价值比较高,其检验准确率、检出率均比较高,相比于常规检验方法来说应用效果更为显著,值得临床推广;同时,本研究结果为全面生化反应与血清学检验方法检查沙门菌的后期标准制订提供了借鉴依据。

