直接铝-过硫酸钠微流体燃料电池性能研究
刘春梅,孙灿兴,高燕均,姜朋飞,刘靖洁
(河南科技大学 车辆与交通工程学院,河南 洛阳471003)
0 引言
随着手机、笔记本电脑等便携式电子设备的普及,锂电池由于能量密度低、运行时间短、环境温度适应性差等较为显著的缺点,愈来愈难以满足实际使用需求[1-3]。微流体结构利用多股流体在微通道内呈层流的特性,无需离子交换膜即可将燃料和氧化剂溶液隔开[4-7]。与传统锂离子电池相比,基于微流体结构的水系铝电池由于具有能量密度高、结构简单易集成、运行可靠、资源丰富等优点[8-9]而受到广大研究者的关注。
常见的水系铝电池有铝/空气电池[10]、铝/过氧化氢电池[11]、铝/二氧化锰电池[12]、铝/硫电池[13-14]、铝/氧化银电池[15]等。文献[16]提出了一种酸碱双电解液铝/空气微流体电池,发现相较于单一的碱性电解液,电池拥有更高的产电性能,但是空气阴极反应需贵金属催化剂,且无法在缺氧或无氧环境中使用。文献[17]合成了一种新的阴极材料,所构建的铝/过氧化氢电池拥有优异的产电性能和稳定性,但是过氧化氢易自分解导致电池能量密度较低,且过氧化氢的还原反应需要贵金属催化剂。文献[18]通过浓缩水系电解液来调整铝离子的溶剂化结构,从而减少向二氧化锰电极的沉淀,有效地提高了产电性能,但是铝/二氧化锰电池反应产物不溶于水。文献[19]利用钴元素合成电池的催化剂,虽然一定程度上提升了电池的反应速率,但是钴元素对人体有害且钴元素较为稀缺。文献[20]构建了一种高度有序的针状氧化银晶体,有效地提升了电池产电性能,但是电池成本较高且反应产物不溶于水。因此,有必要寻找一种不需催化剂、反应速率快、反应产物溶于水、性质稳定、成本低廉的氧化剂,来构建一种高性能的水系铝电池。过硫酸钠(Na2S2O8)具有反应无需催化剂、理论电势高、氧化性强、价格低廉、环境友好、产物易溶解等特点[21],是水系铝电池理想的氧化剂。
本文基于微流体结构,以铝作为阳极材料、过硫酸钠作为氧化剂,提出并构建了一种直接铝-过硫酸钠微流体燃料电池。研究了阳极电解液NaOH浓度、阴阳极电解液总流速及其流速比、氧化剂过硫酸钠Na2S2O8浓度对该电池产电性能的影响。此外,在最佳产电性能的运行条件下,采用恒电流放电法获得该电池的放电特性。本文为水系铝电池氧化剂的选择提供了参考,并为水系铝电池的进一步发展提供理论基础。
1 试验装置及方法
1.1 电池结构
本文提出的直接铝-过硫酸钠微流体燃料电池结构示意图如图1所示。该电池由从上向下依次布置的阳极盖板、主流场板、阴极流场板、阴极盖板组成。阳极盖板和阴极盖板厚度均为5 mm,主流场板和阴极流场板厚度均为1 mm,上述各板材质均为有机玻璃。阳极盖板位于电池顶部,其上开设阳极电解液入口。阴极盖板位于电池底部,其上开设阴极电解液入口和废液出口。主流场板开设主流道(20 mm×1 mm×1 mm),阴极流场板上开设阴极电解液槽道(10 mm×1 mm×1 mm)和阴极流场废液出口。铝阳极和碳纸阴极分别位于主流道的两侧并相对布置。各层有机玻璃板四周开有6个直径为3 mm的孔,利用6个M3的螺栓紧固。将厚度为0.25 μm的钛箔压紧在电极边缘处以传导电子。

图1 直接铝-过硫酸钠微流体燃料电池结构示意图
电池运行时,阳极电解液由注射泵(LSP02-1B,兰格)输送至阳极盖板的阳极电解液入口,再进入主流场板的主流道;阴极电解液由注射泵输送至阴极电解液入口,进入阴极流场板的阴极电解液槽道内,再由亲水性碳纸阴极内部流过,进入主流场板主流道。在主流道内,阳极电解液和阴极电解液平行层流流动,阳极电解液从铝阳极表面流过时发生氧化反应,阴极电解液以穿流方式流过碳纸阴极时发生还原反应。最终溶液从主流道末端经阴极盖板的废液出口流出电池。化学反应如下:
阳极反应:
(1)
阴极反应:
(2)
铝自腐蚀析氢反应:
(3)
1.2 电极材料
试验中采用的铝阳极材料为1060型铝合金(海源铝业有限公司),铝阳极厚度为0.12 mm,参与电化学反应的铝阳极尺寸为3 mm×1 mm,即铝阳极电化学活性面积为0.03 cm2。在使用前,需要去除铝阳极表面的污物,步骤为:超纯水中清洗5 min→丙酮溶液中浸泡10 min→无水乙醇中浸泡5 min→超纯水冲洗→室温下晾干备用。阴极采用型号为HCP020N的碳纸(上海河森电气有限公司),参与电化学反应的尺寸为3 mm×10 mm×0.19 mm。碳纸阴极在使用前为去除其内部杂质,首先依次在超纯水和无水乙醇中清洗10 min,然后在80 ℃下1 mol/L稀硝酸溶液中浸泡5 h,最后用大量超纯水冲洗表面直至碳纸表面上水的pH值接近中性。为了进一步提高碳纸表面的亲水性,在马弗炉中450 ℃高温处理10 h。
1.3 电化学测试方法
利用电化学工作站(ZAHNER Zennium)进行该直接铝-过硫酸钠微流体燃料电池的极化测试和放电测试。使用线性扫描伏安(linear sweep voltammetry,LSV)方法对电池进行极化测试,电化学工作站施加的电势扫描速度为10 mV/s,扫描范围为电池开路电压至0 V。电流密度和功率密度均以铝阳极有效面积(0.03 cm2)为基准进行计算。将Ag/AgCl参比电极(在饱和氯化钾溶液中)放置在阴极盖板废液出口处,利用数据采集装置(KEYSIGHT 34972A)测量电极与参比电极的电势差,从而获得电极电势。为获得该直接铝-过硫酸钠微流体燃料电池放电特性,对电池进行不同电流密度的放电测试,根据测试获得的放电曲线,通过以下方程计算电池的比容量密度[22]:
(4)
其中:Q为比容量密度,(mAh/g);I为放电电流,mA;t为放电时间,h;Δm为恒电流放电测试前后阳极质量变化量,g。在室温下测试,并且为了数据的可靠性,每次测试需要进行至少3次的重复试验。
2 结果与讨论
2.1 阳极电解液浓度对电池产电性能的影响
阴极电解液为1.0 mol/L H2SO4溶液和0.5 mol/L Na2S2O8溶液的混合溶液,阳极电解液为NaOH溶液,阳极电解液和阴极电解液流速均为50 μL/min,考察不同阳极电解液浓度对电池性能和阴阳极极化的影响,结果如图2所示。

(a) 电池性能曲线
由图2a可知:NaOH溶液浓度由0.25 mol/L增大到2.00 mol/L时,电池的开路电压为2.4~2.5 V。随着NaOH浓度从0.25 mol/L增加到2.00 mol/L,功率密度和电流密度的最大值逐渐增大。NaOH浓度为2.00 mol/L时,电池的产电性能最高,功率密度和电流密度最大值分别为160 mW/cm2和148 mA/cm2。这是由于随着阳极电解液NaOH浓度增大,铝阳极溶解速率增大[23],铝阳极表面暴露出更多的铝阳极反应活性点,OH-与铝反应更加剧烈。同时,电解液电导率随NaOH浓度提高而增大,减小了电池的欧姆内阻,提升了电池产电性能。由图2b可以看出:不同NaOH浓度下电池性能的差异是由阳极电势决定的。这说明阳极为电池的主要限制性因素。随着NaOH浓度的增加,阳极电势逐渐变得更负,表明阳极表面的电化学反应速率增强。当NaOH溶液浓度增加至3.00 mol/L时,电池的开路电压波动较大。这是因为随着阳极电解液NaOH浓度的增加,加剧了铝表面发生的自腐蚀析氢反应,阳极表面不断形成氢气气泡[24],导致主流道内层流流动无法保持,电池开路电压较大波动,从而无法测试电池的产电性能。因此,当阳极电解液为3.00 mol/L的NaOH溶液时,电池的性能并未在图2中示出。为维持稳定且较高的电池开路电压和产电性能,后续试验中阳极电解液NaOH浓度均为2.00 mol/L。
2.2 总流速以及流速比对电池产电性能的影响
阴极电解液为1.00 mol/L的H2SO4溶液和0.5 mol/L的Na2S2O8溶液组成的混合溶液,阳极电解液为2.00 mol/L的NaOH溶液,以此分别考察阴阳极电解液总流速及其流速比对直接铝-过硫酸钠微流体燃料电池产电性能的影响。
2.2.1 总流速对电池产电性能的影响
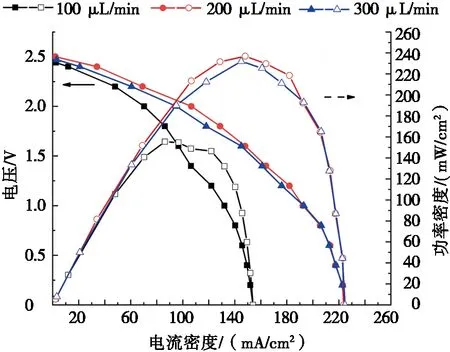
保持阳极电解液与阴极电解液流速比为1∶1,总流速分别为100 μL/min、200 μL/min、300 μL/min,考察不同总流速对电池性能和阴阳极极化的影响,结果如图3所示。
(a) 电池性能曲线
由图3a可知:不同的阴阳极电解液总流速下电池的开路电压变化不大,为2.45~2.5V。当总流速从100 μL/min增加到300 μL/min,电池产电性能呈现先增大后减小的趋势。在总流速为200 μL/min时,电池的产电性能最高,其功率密度和电流密度最大值分别为237 mW/cm2和224 mA/cm2。这是因为当总流速从100 μL/min增大到200 μL/min时,阳极电解液和阴极电解液流速随之增加,不仅有利于反应物向电极表面的传输,也有利于反应产物从电极表面的排出,使得阳极电势更负阴极电势更正(见图3b),电池性能有了较大的提升。继续增加总流速至300 μL/min,阳极电势进一步降低,由于主流道内的流体流动发生了水力失稳,层流界面被扰乱,导致阳极反应物溶液扩散至阴极,使阴极附近pH值升高,造成了阴极电势下降(图3b),从而导致电池最大功率略微下降。因此采用200 μL/min作为后续试验的总流速。
2.2.2 流速比对电池产电性能的影响
保持阴阳极电解液总流速为200 μL/min,考察阳极电解液与阴极电解液流速比分别为100 μL/min∶100 μL/min(1∶1)、133 μL/min∶66 μL/min(2∶1)、150 μL/min∶50 μL/min(3∶1)时对电池性能的影响,结果如图4所示。

(a) 阴阳极极化曲线
从图4a可知:随着阳极电解液与阴极电解液的流速比增大,电池性能逐渐下降。流速比为1∶1时电池性能最高,功率密度和电流密度的最大值分别达到237 mW/cm2和224 mA/cm2。从图4b可以看出:流速比从1∶1变化到3∶1,阴极电势变得更低,这是因为阴极电解液流速的减小,导致阴极反应物和产物的传输减慢,阴极产电性能下降。阳极电势几乎没有变化,这是因为阳极电解液流速增大对阳极产电性能的提升效果有限。
阳极电解液与阴极电解液流速比为1∶2时,电池开路电压波动较大,电池不能稳定产电。因此流速比1∶2的电池性能未在图4中示出。这是由于酸性阴极电解液扩散到阳极表面加剧了铝的自腐蚀析氢反应所致。因此,选择阳极电解液和阴极电解液的流速比1∶1为后续试验的流速比。
2.3 氧化剂浓度对电池产电性能的影响
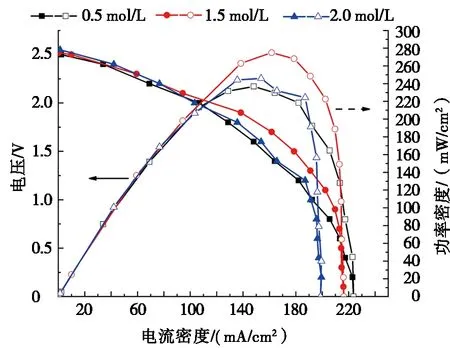
在阳极电解液为2.00 mol/L的NaOH溶液,阴极支持电解液为1.00 mol/L的H2SO4溶液,阳极电解液与阴极电解液流速均为100 μL/min条件下,研究了Na2S2O8浓度对直接铝-过硫酸钠微流体燃料电池性能的影响,其结果如图5所示。
(a) 电池性能曲线
由图5a可知:Na2S2O8浓度由0.5 mol/L增大到2.0 mol/L,电池的开路电压略微提升,最大达到2.57 V。随着Na2S2O8浓度增加,电池功率密度的最大值先增大后减小。当Na2S2O8浓度为1.5 mol/L时,电池产电性能最高,此时功率密度和电流密度达最大值,分别为275 mW/cm2和216 mA/cm2。从图5b可以看出:Na2S2O8浓度从0.5 mol/L增加到2.0 mol/L,阴极电势变得更正,这是因为浓度增大增强了Na2S2O8向阴极的传输,提升了阴极的产电性能。当Na2S2O8浓度从1.5 mol/L增加到2.0 mol/L时阳极电势变得更正,这是因为较高的浓度导致氧化剂扩散到阳极表面,导致铝阳极表面OH-浓度降低,阳极产电性能下降。因此选择1.5 mol/L为后续恒电流放电时的氧化剂浓度。
将该直接铝-过硫酸钠微流体燃料电池与其他水系铝电池进行产电性能比较,如表1所示。

表1 直接铝-过硫酸钠微流体燃料电池与其他水系铝电池产电性能比较
由表1可知:与文献方法相比,本试验所构建的直接铝-过硫酸钠微流体燃料电池开路电压、最大功率密度和最大电流密度的数值均有不同程度的提升。
2.4 电池恒电流放电性能
阳极电解液为2.00 mol/L NaOH溶液,阴极电解液为1.5 mol/L Na2S2O8溶液和1.0 mol/L H2SO4溶液的混合溶液,分别以100 μL/min流速流入电池,利用电化学工作站对该电池进行不同电流密度下的放电测试,结果如图6所示。
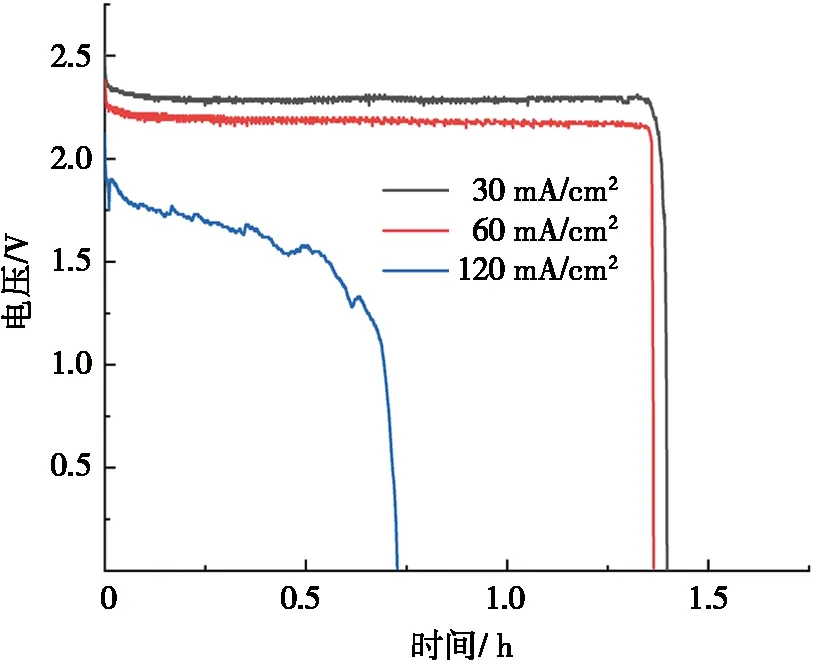
图6 不同电流密度下直接铝-过硫酸钠微流体燃料电池的放电曲线
在30 mA/cm2和60 mA/cm2下恒电流放电时电池电压较为稳定,分别为2.3 V和2.1 V。而当以120 mA/cm2恒电流放电时,电池电压不再稳定。这是因为铝氧化反应(反应式(1))分为铝氧化(反应式(5))和氢氧化铝溶解(反应式(6))2个连续步骤[16]:
铝氧化反应:
Al+3OH-→Al(OH)3+3e-;E0=-2.3 V。
(5)
氢氧化铝溶解反应:
(6)
3 结论
(1)随着阳极电解液NaOH浓度从0.50 mol/L增加到2.00 mol/L,电池性能随之增加。
(2)随着阴阳极电解液总流速从100 μL/min增加300 μL/min,电池性能先增加后降低;随着阳极电解液与阴极电解液流速比从1∶1增加到3∶1,电池性能反而降低。
(3)随着氧化剂Na2S2O8浓度从0.5 mol/L增加到2.0 mol/L,电池的性能先增加后减小。在氧化剂浓度为1.5 mol/L时,电池性能达到最优,此时开路电压为2.56 V,功率密度和电流密度的最大值分别为275 mW/cm2和216 mA/cm2。与其他水系铝电池相比,本文提出的直接铝-过硫酸钠微流体燃料电池具有最高的产电性能。
(4)对电池进行不同电流密度的恒电流放电测试,得到电池在120 mA/cm2放电时比容量密度最大,为2 760 mAh/g。

