GSTM 5在前列腺癌中的表达及其对前列腺癌进展的潜在机制
张 莹 ,孙 娜 ,郭亚收 ,史传道 ,刘一笑
(1.陕西中医药大学公共卫生学院,陕西咸阳 712046;2.咸阳市中心医院泌尿外科,陕西咸阳 712000)
前列腺癌(prostate cancer,PCa)是一种发生在前列腺上皮细胞的恶性肿瘤,发病率在全球男性恶性肿瘤中排名第二[1]。与欧美国家相比,中国的PCa发病率和死亡率虽然较低,但近年来其发病率呈迅速上升趋势,已成为负担较重的男性恶性肿瘤之一[1-4]。
PCa病情隐匿,早期检查往往缺乏典型体征,临床上主要依靠前列腺肿瘤标志物(prostate specific antigen,PSA),但其特异性不高[5]。前列腺活检为其诊断的金标准,但却是一种侵入性操作,而且增加肿瘤转移的可能性[6]。因此,寻找敏感性高的分子标志物,早期发现并及时诊断是目前临床面临的重要问题。本研究主要基于生物信息学方法,探究PCa发生发展的分子机制,筛选出可能作为PCa的潜在生物标志物,为后期临床医学提供科学依据。
1 材料与方法
1.1 微阵列数据的获取
1.2 差异表达基因的筛选
使用联川生物云平台(https://www.omicstudio.cn/index)中R 软件limma 包对三个数据集进行分析,筛选正常前列腺与PCa患者的差异表达基因,标准为P<0.05,FC(Fold Change)≥2。
1.3 差异表达基因的韦恩图
将从3 个数据集得到的不同表达基因导入Venny2.1.0 在线工具进行交集分析,并绘制韦恩图。筛选出的三个数据集中共同表达的基因,即是最终的差异表达基因(DEGs)。
1.4 蛋白-蛋白交互作用(protein-protein interactions network,PPI)
将最终筛选的DEGs 输入STRING 数据库(https.//string-db.org),调节相关参数构建PPI网络。下载PPI tsv文件导入Cytoscape 3.8.2软件,利用Cyto-Hubba插件筛选MCC(maximal clique centrality)评分前30位的基因作为关键基因(Hub genes,Hub基因)。
1.5 Hub基因GO 功能富集及通路分析
利用DAVID 数据库(https://david.ncifcrf.gov/tools.jsp)对Hub基因进行GO 和KEGG 通路富集分析,结果以柱状图和圈图形式导出。
1.6 Hub基因的诊断能力评价
对30个Hub基因采用GraphPad Prism 软件绘制ROC 曲线(receiver operating characteristic curve),以期获得同时在3个数据集中有诊断意义的基因。AUC(area under the curve) 值代表ROC 下方的面积,越接近于1,表明诊断效果越好,取值在0.7~0.9,诊断有一定的准确性。
1.7 Hub基因的验证
利用GEPIA 数据库对在3 个数据集中均有诊断意义的Hub基因进行验证,分析其在PCa及正常前列腺组织的相对表达水平,同时在GEPIA 进行生存分析,分析9个Hub基因表达水平对患者的总体生存率(OS)的影响。
1.8 UALCAN 分析
为了验证Hub基因的表达与PCa 的Gleason分级是否有相关性,利用UALCAN(http://ualcan.path.uab.edu/)进行分析,结果具有明显相关性时,可认为该基因的表达与不同Gleason分级有关,其在临床治疗中也存在意义。
2 结果
2.1 差异表达基因的筛选结果
以P<0.05,FC≥2为标准进行PCa及正常前列腺组织的差异表达基因筛选,GSE55945 共获得428个,其中低表达基因291个(68%),高表达基因137个(32%);GSE46602共获得727个,其中低表达基因444 个(61%),高表达基因283 个(39%);GSE69223共获得1 285个,其中低表达基因840个(65%),高表达基因445个(35%)。
本系统程序设计采用顺序功能图进行编程,将复杂的控制过程分成若干工作步,步与步之间通过转移条件连接。图8和图9为根据系统控制要求编制的顺序功能图,根据该功能图在西门子smart 200软件中编程,并分别下载到PLC中运行,即可分别实现集热系统对太阳高度角和方位角的追踪,制冷系统中对太阳能清洗电机、溶液泵电机和循环泵电机的控制。通过主站S7-300来实现对两个从站S7-200之间数据的读写操作,完成整个系统的通信,从而实现太阳能制冷系统的功能。
2.2 差异表达基因的韦恩图
将3个数据集分析得到的差异表达基因(428个、727个和1 285个)导入Venny进行交集分析,通过构建韦恩图,最终得到105个共同DEGs(图1)。

图1 PCa及正常前列腺组织的差异表达基因的韦恩图Fig.1 Venn diagram of differentially expressed genes
2.3 DEGs的PPI网络及Hub基因筛选
将105 个DEGs输入STRING 进行蛋白-蛋白作用分析,得到一个包含83个节点,179条边的PPI网络(图2)。利用Cyto Hubba 插件筛选MCC 评分排名前30位的枢纽蛋白及其所对应的枢纽基因,节点颜色越深代表该基因的MCC 评分越高(图3)。MCC评分见表1。

表1 PCa及正常前列腺组织的差异表达基因中前30位Hub基因MCC评分Tab.1 MCC score of top 30 Hub genes

图2 PCa及正常前列腺组织的差异表达基因的蛋白-蛋白作用图谱Fig.2 Protein-protein action map of differentially expressed gene for PCa and normal prostate

图3 PCa及正常前列腺组织的差异表达基因中前30 位Hub基因Fig.3 Top 30 Hub genes of DEGs for PCa and normal prostate
2.4 Hub基因的GO 及KEGG富集分析结果
利用DAVID 数据库对30个Hub基因进行GO和KEGG富集分析,共得到生物过程(BP)条目169个,细胞组成(CC)条目58个,分子功能(MF)条目66个,按照P<0.000 1筛选得到BP 条目21个,CC 条目15个,MF条目10个,参与的生物过程主要包括蛋白激酶B 信号的正向调节、细胞分化、转录的正调控、转化生长因子β受体信号通路负调控、细胞迁移的正向调节等,按基因数取每项富集前10进行柱状图绘制(图4)。
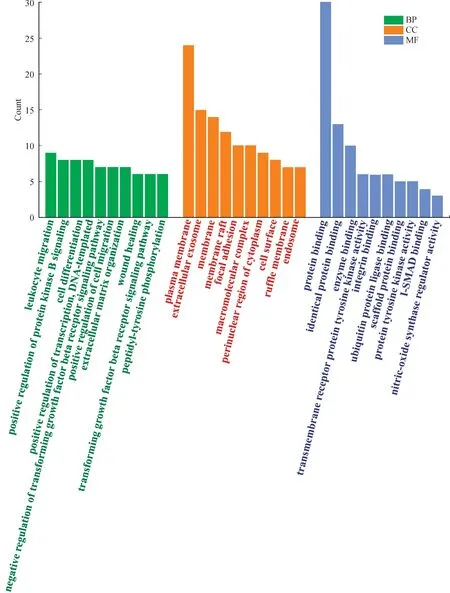
图4 Hub基因的Gene Ontology(GO)分析Fig.4 Gene Ontology(GO)analysis of Hub genes
KEGG 通路富集分析共富集出54条信号通路,按照P<0.000 1进行筛选得到9条信号通路,主要涉及粘着斑、雌激素信号通路等(图5)。

图5 Hub基因的KEGG 通路分析Fig.5 KEGG pathway analysis of Hub gene
2.5 Hub基因的诊断能力
对3 个数据集中的30 个Hub 基因分别绘制ROC曲线,结果显示其中9个基因同时在3个数据集中诊断能力有统计学意义。9 个Hub 基因为:CAV1、KDR、CAV2、TGFBR1、SLC7A11、GSTM2、GSTM3、GSTM5、MYO6,其中GSTM5分别在3个数据集中的散点图和ROC 曲线显示,曲线下面积分别为0.826 9、0.813 5和0.973 3,诊断能力均较好(图6)。
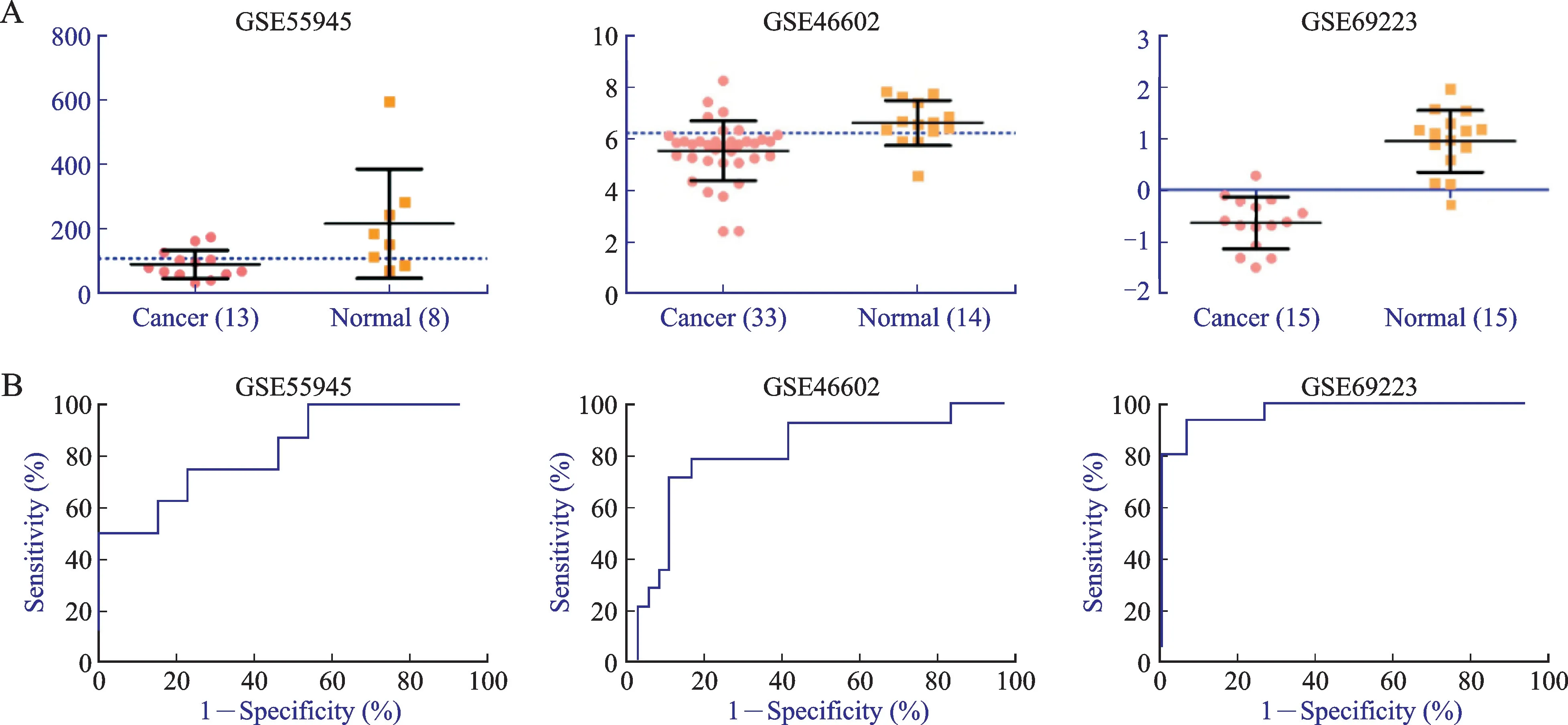
图6 GSTM 5基因的散点图和ROC曲线Fig.6 Scatter plot and ROC curves of GSTM 5
2.6 Hub基因的表达验证
GEPIA 在线网站包含TCGA 数据库中492 例PCa组织和152例正常前列腺组织相关信息。9个Hub基因通过GEPIA 网站验证显示,其中CAV1、KDR、CAV2、TGFBR1、GSTM2、GSTM3、GSTM5在PCa中呈低表达,而SLC7A11、MYO6在PCa中呈高表达,差异有统计学意义(P<0.05,图7)。
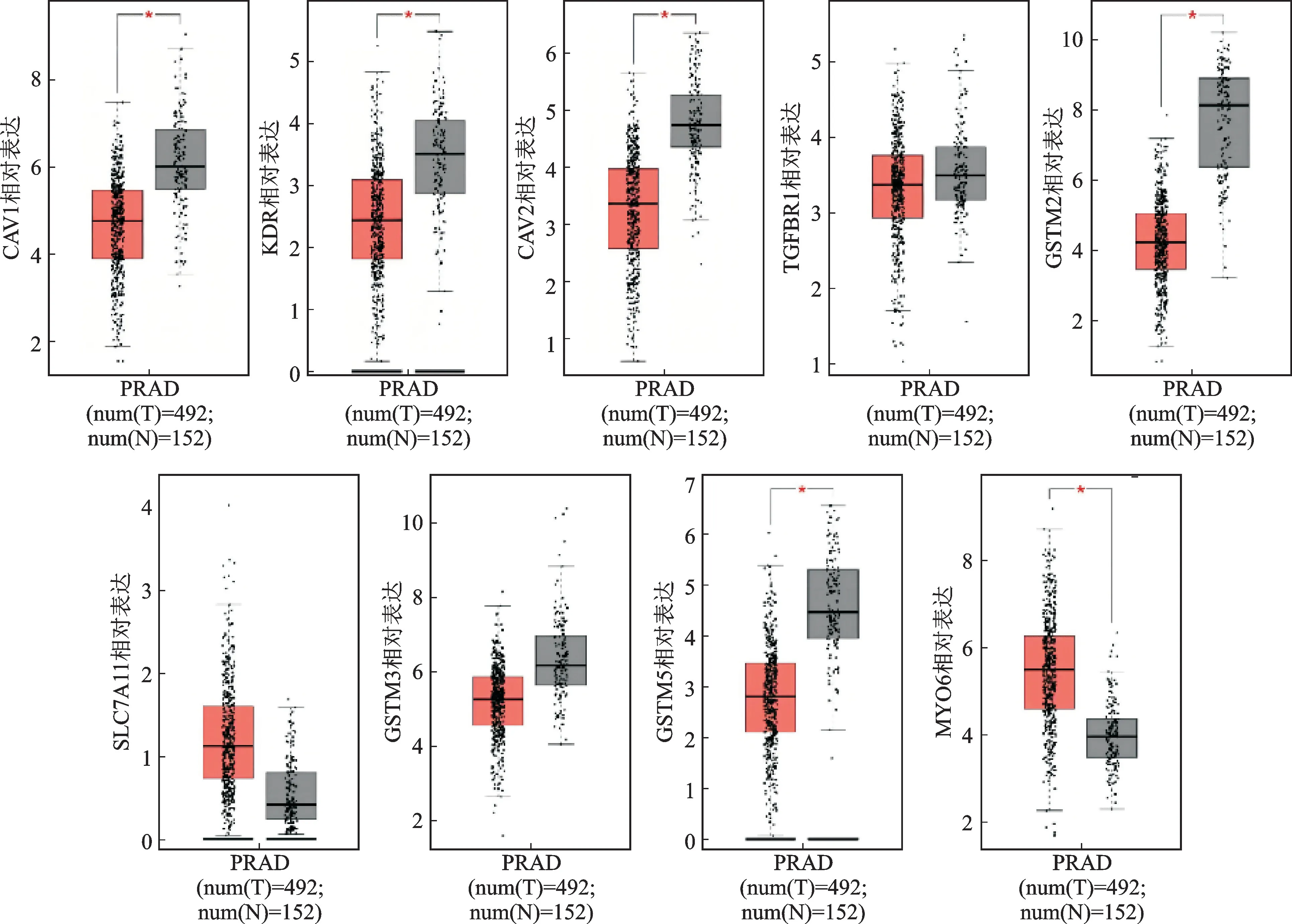
图7 前列腺癌及正常前列腺组织中9个Hub基因的表达比较Fig.7 Validation of expression levels of 9 Hub genes in prostate cancer and normal prostate tissue
同时,在GEPIA 网站分析9个Hub基因表达对患者的OS的影响,以Hub基因的相对表达中位值为界,结果显示GSTM5 高表达时PCa患者OS 延长,差异有统计学意义(P<0.05,图8)。
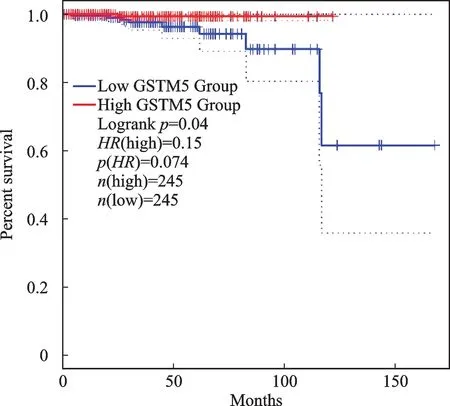
图8 GSTM 5表达与OS的关系Fig.8 The relationship between GSTM5 expression and OS
2.7 GSTM 5的表达与Gleason分级的关系
采用UALCAN 分析验证GSTM5的表达在PCa临床治疗中的意义,结果显示,GSTM5 基因的表达与Gleason分级有明显相关性,并且随着Gleason 评分的增加,GSTM5基因的表达减弱(图9)。
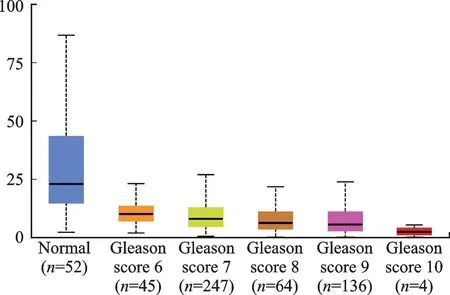
图9 GSTM 5表达与Gleason分级的关系Fig.9 The relationship between GSTM5 expression and Gleason
3 讨 论
PCa已成为全球性的公共卫生问题,严重威胁着男性的生命和健康[7]。在其发生发展过程中,许多基因产物表现出异常的调控功能[8],因此,积极探索PCa发生发展的差异表达基因,阐释其分子机制,筛选出潜在的生物标志物,对于PCa的早期诊断和及时治疗,减少病患负担具有重要的现实意义。本研究选择了GEO公共数据库中3个数据集(GSE55945、GSE46602和GSE69223),共获得37例正常前列腺和64例PCa组织,得到105个DEGs。进一步运用Cytoscape中的Cyto Hubba 插件筛选出前30位作为Hub基因。
Hub基因的功能富集分析表明,其涉及的生物过程主要包括蛋白激酶B 信号的正向调节、细胞分化、转录的正调控、转化生长因子β受体信号通路负调控、细胞迁移的正向调节等。蛋白激酶B 即Akt,有研究表明Akt信号通路的活化和过度表达与PCa的侵袭和转移密切相关,磷酸化Akt的水平伴随Gleason分级升高而升高,与PCa的存活率有关[9]。胡余攀学者[10]研究表明,转化生长因子-β(TGF-β)在肿瘤的初期表现为抑制作用,在晚期发挥促进作用,并且有研究已证明前列腺基质细胞中TGF-β活性的丧失,促进了PCa的发生[11]。KEGG 通路分析表明Hub基因主要参与粘着斑、雌激素信号通路等。黏着斑信号通路参与细胞与细胞外基质的黏附,调节上皮间质转化(EMT)和肌动蛋白细胞骨架重塑的过程,进而调节细胞的黏附和运动,与肿瘤的侵袭和转移密切相关[7]。雌激素受体是前列腺发育的重要受体之一,在细胞中雌激素结合并激活雌激素受体ESR1、ESR2,促进细胞有丝分裂和分化[12],干预雌激素信号通路调控前列腺上皮细胞以及PCa细胞的生长增殖等生物学过程[13]。
通过ROC曲线对3个数据集中的Hub基因诊断能力进行评价,结果显示其中CAV1、KDR、CAV2、TGFBR1、SLC7A11、GSTM2、GSTM3、GSTM5 和MYO6共9个基因同时在3个数据集中的诊断能力有统计学意义。9个Hub基因通过GEPIA 网站验证显示,其 中CAV1、KDR、CAV2、TGFBR1、GSTM2、GSTM3、GSTM5 在PCa中呈低表达,而SLC7A11、MYO6在PCa中呈高表达,本研究结果与其一致。
通过分析9个Hub基因表达与患者的OS间的关系,除GSTM5基因差异有统计学意义外(P<0.05),其余基因均没有统计学意义,且GSTM5高表达时PCa患者OS延长。采用UALCAN 分析进一步验证的结果显示,GSTM5基因的表达与Gleason分级有明显相关性,并且随着Gleason 评分的增加,GSTM5基因的表达减弱。谷胱甘肽S-转移酶(GST)是谷胱甘肽代谢信号通路中的关键酶,可通过催化亲核性谷胱甘肽与亲电子性的外源性化合物结合,在体内具有解毒作用,并且在细胞炎症反应、细胞凋亡、增殖分化中也起着重要作用[14-19]。当前列腺组织出现癌变,机体GST 处于较低水平时,对肿瘤细胞的清除作用较弱,从而可通过表达沉默参与PCa的发生。GSTM5属于GST 家族,位于人类1号染色体[19]。有研究结果显示,GSTM5 在膀胱癌组织中表达低于正常组织,且GSTM5的过表达降低了细胞增殖和迁移的能力[20]。也有研究者发现GSTM5的高表达与胃癌患者的低OS 密切相关,GSTM5 表达与黏附、血管生成、凋亡过程、细胞生长、增殖、迁移及TGF-β信号通路相关[21]。亦有研究表明GSTM5是间质分子标记,可能在乳腺癌和PCa的进展中起关键作用[22],但有关其在PCa发展中的具体作用机制研究鲜少。
综上所述,本研究通过挖掘高通量GEO 芯片数据库并对差异基因进行系统分析,发现CAV1、KDR、CAV2、TGFBR1、GSTM2、GSTM3、GSTM5 在PCa中呈低表达,而SLC7A11、MYO6在PCa中呈高表达,其中GSTM5基因与PCa生存率有关,并随着Gleason评分的增加,GSTM5基因的表达减弱。这提示GSTM5可能是PCa潜在的生物标志物。但由于本研究纳入的样本量存在一定局限性,以后尚需进一步进行临床实验验证,以期为临床提供更为确凿的诊疗依据。

