植物生长调节剂噻苯隆对农作物影响及在农产品中残留分析的研究进展
张志才, 刘腾飞, 杨代凤
(1.江苏省金湖县农业技术推广中心,江苏金湖 211600; 2.江苏太湖地区农业科学研究所,江苏苏州 215105)
噻苯隆,化学名称N-苯基-N′-1,2,3-噻二唑-5-脲,是一种人工合成的苯基脲类化合物,具有极高的生物活性,常用作植物生长调节剂(plant growth regulators,PGRs),在粮食、果蔬等农业生产中广泛使用,为农产品增产提质发挥了积极作用[1-4]。但是,噻苯隆对哺乳动物具有潜在的刺激性,能抑制中枢神经系统,并对肾脏存在一定的危害[5],而且被农作物吸收后,可转化为具有细胞毒性的代谢产物,如3-羟基-噻苯隆、4-羟基-噻苯隆等[6]。基于其安全性考虑,许多国家针对噻苯隆都制定了严格的最大残留限量(maximum residue limit,MRL)标准,如美国、日本规定其在棉籽中的MRL值均为0.3 mg/kg[7-8],澳大利亚规定其在棉籽、奶类及哺乳动物可食内脏和肉中的MRL值分别为0.5、0.01、0.05 mg/kg[9],中国规定其在棉籽上的MRL值为1.0 mg/kg,在番茄、黄瓜、苹果、鲜枣、葡萄和甜瓜类水果中的MRL值均为0.05 mg/kg[10]。近年来,有关噻苯隆在农业生产上的使用、残留现状、降解特点及检测分析等方面的研究日益增多,但缺乏系统的整理与总结。鉴于此,本文在查阅文献的基础上,从上述4个方面对噻苯隆目前的研究成果进行综述,以期为今后噻苯隆在生产中的合理使用及相关研究提供参考。
1 噻苯隆在我国农业生产上的使用
1.1 噻苯隆在农作物上登记情况
通过中国农药信息网查询[12],截至2022年11月15日,在我国登记使用噻苯隆产品的农作物数量共有21个,主要登记农作物为棉花,产品登记数量达103个,主要作用为脱叶和调节生长,其次是葡萄,产品登记数量为26个,主要用于调节生长、提高产量和促进果实生长。登记使用的噻苯隆产品共计145个,均为制剂产品,其中单剂76个,复配剂69个,复配产品有氨基寡糖素·噻苯隆、24-表芸·噻苯隆、14-羟芸·噻苯隆、赤霉·噻苯隆、噻苯隆·28-高芸薹素内酯、赤A4+A7·噻苯隆、敌草隆·噻苯隆、敌·苯·乙烯利,其中以赤霉·噻苯隆产品最多(表1)。
1.2 噻苯隆的使用效果
噻苯隆在我国常作为脱叶剂在棉花上使用,能够促进棉叶中脱落酸的生成,加快棉叶衰老进程,从而提高脱叶率[13],对棉花的脱叶效果随其用量的增加而提高[14-15]。噻苯隆对棉花进行脱叶,也是对其生长的一种胁迫。高丽丽等发现喷施噻苯隆后棉花叶片发生光抑制,光系统Ⅱ复合体受到损伤并伴随光合电子传递受阻,光合功能受损,叶片膜系统受破坏严重[16]。噻苯隆在马铃薯、谷子、玉米、小麦等作物上使用,具有增产作用,对不同作物生产力的影响因作物品种而异。例如,噻苯隆可以调控大豆氮代谢相关酶活性,促进氮素转化和籽粒干物质积累,使籽粒体积增大、干质量提高,单株荚数显著增长,达到增产效果,增产率可达14.89%[17]。噻苯隆能促进马铃薯植株生长,增加马铃薯株高、茎粗和大薯率,使产量增加7.1%~20.2%[18]。噻苯隆对谷子株高具有一定的促进作用,能增加谷子穗长和千粒质量,提高单位面积产量,增产率为3.07%~20.75%[19]。它还可促进小麦分蘖成穗、增加穗粒数、提高千粒质量,从而实现产量提高,增产率为3.9%~18.6%[20]。此外,噻苯隆对饲草玉米株高和产量具有显著的促进作用,在喷施噻苯隆后,株高和产量分别增加1.14%~6.54%和13.09%~19.56%[21]。噻苯隆也可与其他药剂进行复配来提高作物产量。例如,在小麦孕穗期施用14-羟芸·噻苯隆复配剂,可增加小麦穗长、穗实粒数和千粒质量,增产率为5.77%~13.98%[22]。在蜡熟期喷施噻苯隆-乙烯利复配剂,能够加快玉米籽粒脱水速率,降低玉米收获期籽粒含水量,提高产量,与对照相比,含水量可降低5.72%~6.32%,产量增加13.44%~10.50%,并使熟期提前5~6 d[23]。除了增产作用外,噻苯隆还可以有效改善作物品质。研究发现,噻苯隆可降低芒果、金橘等水果可滴定酸(titratable acidity,TA)含量,增加可溶性固形物(total soluble solids,TSS)、维生素C和总糖含量[2,24],并对增加果实果径、提高坐果率、改善果形、防止裂果等具有明显的效果[25-27],但也有研究发现噻苯隆处理会降低果实香气成分和TSS含量,增加TA含量,使果实品质下降[3,28]。

表1 噻苯隆在我国农作物上登记情况
2 噻苯隆在农产品中的残留现状
关于农产品中噻苯隆的残留状况已有很多研究报道,主要在豆芽、猕猴桃、草莓、葡萄、番茄等果蔬类农产品中残留较多[29-32],但检出率和检测值均不高。例如,对山东省烟台市14种市售水果中6种PGRs进行分析,在蓝莓样品中检测到噻苯隆,检出率只有0.4%,检测值在0.002 8~0.01 mg/kg之间[33]。对河北省市售水果(草莓、葡萄、猕猴桃、樱桃和西瓜)中6种PGRs进行分析,在樱桃样品中检测到噻苯隆,检出率为2.6%,检测值只有 0.000 7 mg/kg[34]。对云南省优势水果(葡萄、香蕉、草莓和芒果)中20种PGRs进行监测,在葡萄和草莓中同时检出噻苯隆,最大检测值分别为 0.042 mg/kg 和0.048 mg/kg[35],在葡萄中的残留量低于国家标准[10]规定的限量值(0.05 mg/kg)。但是,对广西和海南两地芒果样品进行检测,在广西芒果果皮中检出噻苯隆,检测值为0.092 mg/kg,在海南芒果果皮和果肉中同时检出噻苯隆,检测值分别为0.16 mg/kg和0.11 mg/kg[36],残留量远高于国家标准[10]在水果中规定的限量值(0.05 mg/kg)。由于噻苯隆具有一定的毒性风险,因而其残留毒性不容忽视,需引起足够的重视。
3 噻苯隆在农产品中的残留降解
关于农产品中噻苯隆的残留降解情况,目前国外研究的较少,而国内已有较多的报道,对不同农产品、尤其是果蔬中噻苯隆的降解动态、最终残留等进行了研究,对于科学合理使用噻苯隆起到了重要指导作用。江唐鑫等研究报道,噻苯隆在农产品中的降解受到施药剂量的影响,施药剂量越大,降解速度越快[37]。在谢花后喷施不同剂量的噻苯隆,随着时间推移,芒果中噻苯隆残留均呈现下降趋势,降解速度由快到慢为20 mg/L>15 mg/L>10 mg/L,半衰期分别为3.57、3.71、3.89 d。张文等研究发现,在膨果初期施用不同剂量的噻苯隆,葡萄中噻苯隆的降解速度为由快到慢为0.8 mg/kg>0.6 mg/kg>0.2 mg/kg[38]。环境条件对噻苯隆在农产品中的降解也会产生影响。Yang等研究表明,由于室内条件下温度和湿度较高,室内种植草莓中噻苯隆的降解速度明显快于大田草莓,在室内和大田草莓种的半衰期分别为3.2~3.6 d和5.2~6.4 d[39]。噻苯隆在农产品中的降解还受到农产品部位的影响,即使在农产品不同部位的降解速度也存在差异,例如噻苯隆在葡萄穗轴中的降解速度比在葡萄果实中要快,而且在穗轴中的残留量高于果实中[38]。
表2列举了噻苯隆在部分农产品中的残留降解情况。可以看出,噻苯隆在生产上使用后,在农产品中的原始沉积量较低,半衰期较短,属于易降解性农药(半衰期<30 d),降解行为符合一级动力学规律,可用一级反应动力学方程Ct=C0e-kt来描述,式中k为噻苯隆降解速率常数,t为施药后的天数,C0为噻苯隆的初始质量浓度,Ct为t时刻农产品中噻苯隆的质量浓度。不同农产品中噻苯隆降解速度存在差异,这与农产品种类、农药剂型不同等原因密切相关,具体影响因素有待进一步研究探讨。

表2 噻苯隆在部分农产品中的降解情况
4 噻苯隆的残留检测
4.1 样品前处理
在不同农产品中噻苯隆的前处理过程中,一般使用乙腈[41,43,45-47]作为提取溶剂,并向其中添加一定量的酸,如甲酸或乙酸[30,38,44],它能够破坏样品中所含淀粉和蛋白质的结构,使这些物质在乙腈提取剂中沉淀,从而减少基质干扰,提高回收率。样品提取方法主要采用传统的振荡法[40-44]和超声法[29-30,36-37],与超声提取相比,振荡提取设备要求简单,提取效率更高,整个提取过程在3~15 min范围内即可完成,适用于同时处理大批量样品。净化方法则主要使用固相萃取法(solid phase extraction,SPE)[30,36,48]和分散固相萃取法(dispersive solid phase extraction,d-SPE)[34,38,41,44]。SPE法除了使用传统的弗罗里硅土(Florisil)、十八烷基硅烷键合硅胶(octadecylsilane bonded silica,C18)等作为吸附剂外,一些新型吸附材料也被用作SPE吸附介质。例如,将聚丙烯腈纳米纤维膜进行巯基修饰后作为SPE吸附剂,用于净化蔬菜中的噻苯隆等4种PGRs,获得了满意的效果,且重复使用6次后,吸附能力不发生改变[31];以离子液体修饰的酚醛树脂作为SPE吸附剂,用于黄瓜中噻苯隆和氯吡脲的萃取净化,可有效去除黄瓜基质干扰,得到满意的回收[49]。d-SPE法将吸附剂直接分散在样品提取液中,通过振摇使其充分接触,使干扰杂质尽可能地被吸附在吸附剂上,达到除杂净化的目的。常用的吸附剂包括C18、乙二胺-N-丙基硅烷(primary secondary amine,PSA)、石墨化炭黑(graphitized carbon blacks,GCB)及多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)等,在实际分析工作中,通常根据样品基质类型,将不同吸附剂进行组合使用,以获得更加理想的除杂效果。在上述吸附材料中,MWCNTs以其超大的比表面积、独特的中空管状结构表现出优异的吸附性能[50],用于果蔬类农产品中噻苯隆的前处理过程中,与传统的C18、PSA和GCB等相比,具有更优异的净化效果[51]。
4.2 定性定量检测
4.2.1 仪器检测方法 噻苯隆较易溶于甲醇、丙酮等有机溶剂,目前主要使用基于液相色谱的仪器方法进行检测,包括高效液相色谱法(high performance liquid chromatography,HPLC)[36,45,49]、HPLC-串联质谱法(HPLC tandem mass spectrometry,HPLC-MS/MS)[32-34,36,41]和超高效液相色谱-串联质谱法(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)[37-38,42-44]。
HPLC适用于沸点高、难气化或受热易分解农药残留的分析,是噻苯隆常用的检测方法之一,也是我国行业标准SN/T 4586—2016[52]中推荐的检测方法。通常采用C18色谱柱分离,以乙腈-水为流动相洗脱后,用紫外检测器(ultraviolet absorption detector,UVD)在特定波长下进行测定。王丽荣等将C18SPE前处理与HPLC相结合建立了芒果中噻苯隆等5种PGRs的检测方法,用UVD在210 nm波长下测定,5种农药获得了满意的灵敏度、准确度和稳定性,回收率在80.8%~92.2%之间,相对标准偏差(relative standard deviation,RSD)小于5.1%(n=5),检出限(limit of detection,LOD)和定量限(limit of quantification,LOQ)分别为2.9~24.0 μg/kg 和10~79 μg/kg[36]。Li等利用HPLC建立了黄瓜中噻苯隆和氯吡脲的检测方法,用UVD在278 nm波长下测定,2种农药获得了满意的回收率(91.4%~100.7%)和精密度(RSD≤6.0%),LOD值分别为1.95 μg/kg和1.69 μg/kg;将该方法用于检测农贸市场5个黄瓜样品,在1个样品中检测到噻苯隆,含量为0.043 5 mg/kg[49]。HPLC仪器价格较低,操作维护简单,易于推广普及,但该方法对样品净化要求高,仅依靠保留时间定性,容易出现假阳性问题。
三重四级杆质谱(triple quadrupole mass spectrometry,QqQ-MS)与HPLC或UPLC联用在多反应监测(multiple reaction monitoring,MRM)模式下具有高灵敏度、高选择性的特点,依据获得的特征母离子和子离子信息,可实现对复杂基质中多种类型农药的定性和定量分析,是目前噻苯隆残留检测的主流方法之一。Pu等采用HPLC-QqQ-MS建立了葡萄中噻苯隆等24种PGRs的检测方法,在MRM模式下测定,获得了较好的准确度(回收率>67.5%)和精密度(RSD<20%),LOQ值可达0.1~5 ng/mL[53]。Yan等利用UPLC-QqQ-MS建立了5种水果(苹果、葡萄、猕猴桃、桃子和橙子)中噻苯隆等6种PGRs的检测方法,在MRM模式下测定,6种农药在5种基质中的回收率在60.8%~119.4%之间,LOD值为0.003~0.18 μg/kg,LOQ值为0.01~0.59 μg/kg[54]。在我国标准GB 23200.121—2021[55]中,采用HPLC-QqQ-MS技术,在MRM模式下实现了植物源性食品中噻苯隆等331种农药及其代谢物的同时检测,并在准确度、灵敏度和重现性等方面均取得满意的结果。QqQ-MS虽然灵敏、可靠,但分辨率不足,只能用于靶向检测,即要用标准品才能对待测物进行准确分析,无法用于样品中未知物的快速筛查分析。四级杆-飞行时间质谱(quadrupole-time of flight mass spectrometry,Q-TOF-MS)和四级杆-轨道离子阱质谱(quadrupole orbitrap mass spectrometry,Q-Orbitrap-MS)在全扫描模式下可以获得精确质量信息,具有高分辨率和高灵敏度,是实现目标化合物靶向分析和非靶向筛查的有力工具[56-57]。莫迎等采用UPLC-Q-Orbitrap-MS技术,建立了快速筛查分析5种果蔬(韭菜、番茄、豆芽、葡萄和柑橘)中噻苯隆等15种PGRs的方法,采用全扫描数据依赖二级扫描模式测定,15种农药均获得了较高的准确度(70.3%~107.2%)和精密度(RSD<9.9%),LOQ值为10.0~20.0 μg/kg,对100批不同果蔬样品进行筛查,均未检测到噻苯隆[51]。姚恬恬等建立了UPLC-Q-TOF-MS/MS筛查检测3种果蔬(橙、黄瓜和葡萄)中噻苯隆等19种PGRs的方法,在MRM模式下测定,方法的LOD值为0.03~14 μg/kg,LOQ值为0.09~48 μg/kg,方法用于15批市售橙、黄瓜和葡萄样品的筛查分析,在15批样品中检测到噻苯隆等6种PGRs,含量在0.14~13 μg/kg之间[58]。虽然Q-TOF-MS和Q-Orbitrap-MS具有诸多优势,但设备价格昂贵,专业化程度高,使用复杂且维护难度大,不易推广普及。
表3列举了近年来部分农产品中噻苯隆残留检测实例。从表3可以看出,液相色谱与QqQ-MS联用是目前农产品中噻苯隆最主要的检测手段,QuEChERS方法因快速、简单、高效等特点,在样品检测前处理当中广泛应用。不同检测方法的准确度、精密度及灵敏度结果良好,部分检测方法在人参等一些复杂样品的检测过程中,甚至可省去样品净化过程[63-64],大大减少了检测步骤,提高了检测效率,但同时也增加了仪器污染的风险。
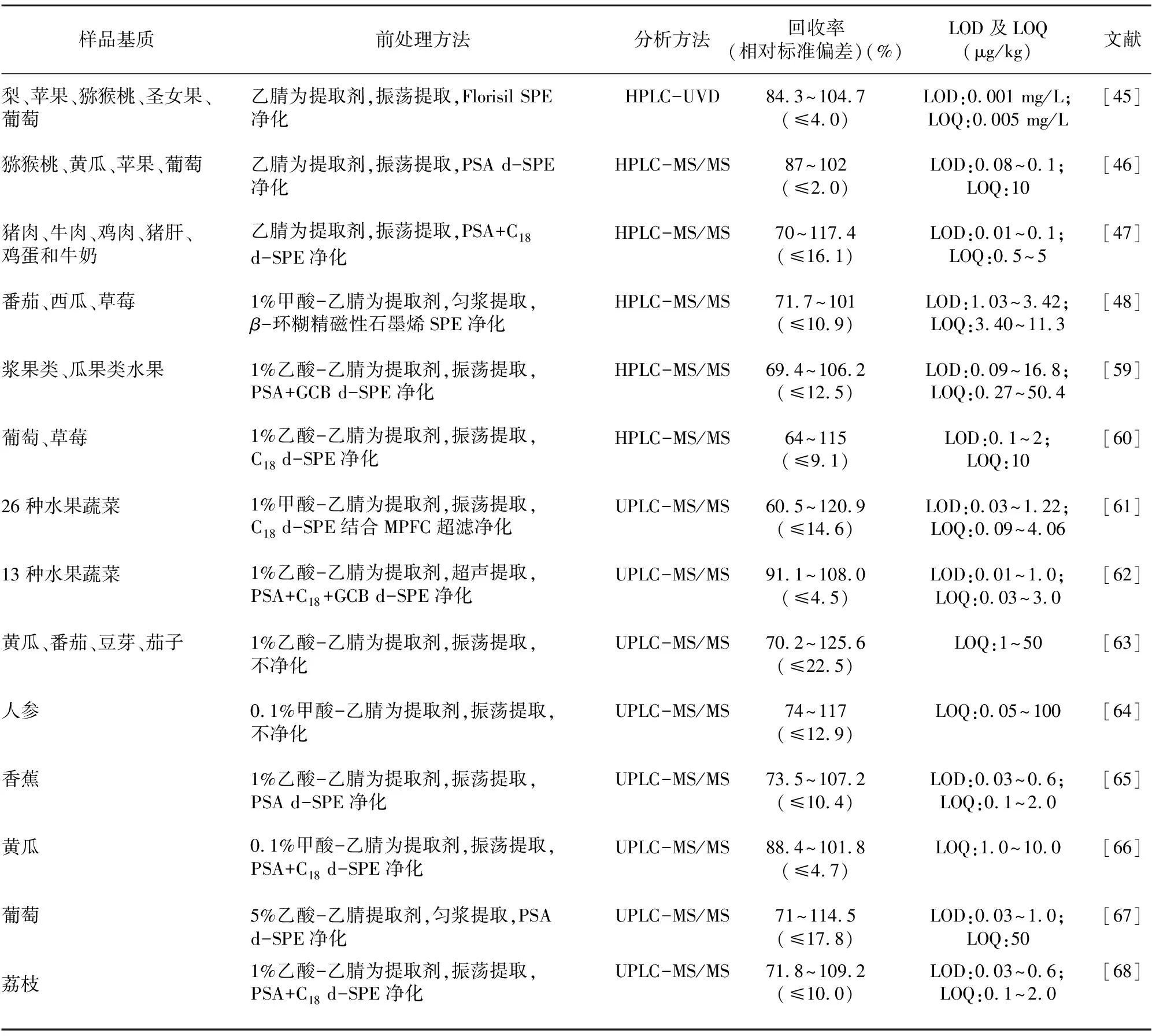
表3 不同农产品基质中噻苯隆残留检测方法实例
4.2.2 其他检测方法 表面增强拉曼光谱法(surface-enhanced raman spectroscopy,SERS)是入射光激发纳米尺度贵金属材料产生的一种拉曼散射增强效应,可实现对待测物的高灵敏“指纹”识别与检测[69]。与仪器方法相比,SERS技术具有特异性强,操作快速、简便,对大型仪器依赖小等优势,在现场快速检测当中展现出巨大的应用潜力。Chen等采用SERS技术建立了4种果蔬(葡萄、黄瓜、猕猴桃、番茄)中噻苯隆和氯吡脲的检测方法。样品采用乙腈为提取剂超声提取后,以3,5-二甲基苯氨基甲酰化β-环糊精键合硅胶为吸附剂进行SPE净化,结合SERS检测,获得了满意的检测结果,方法的回收率为78.9%~87.9%,LOD值均为15.0 μg/L[70]。但方法的不足是样品需要经过繁琐费时的萃取净化过程才能用于分析,尚无法真正应用于现场检测之中。
5 结语
综上所述,噻苯隆在我国主要的粮食作物、果蔬等农业生产上使用,为农产品增产和品质改善发挥了重要的调控作用。噻苯隆在农产品中具有易降解的特点,使用后很快被降解代谢,但过量或不当使用仍造成了其在农产品特别是果蔬类农产品中的残留问题,需引起一定的重视。在噻苯隆的残留分析中,液相色谱与QqQ-MS联用技术是目前采用的最主要的检测手段,但需要配套使用高效的前处理方法,才能满足样品高通量检测的需求。SERS技术操作快速、简单,设备轻便,然而目前仍限于实验室使用,克服样品前处理繁琐的不足,未来有望发展成为噻苯隆现场快速检测的重要手段之一。
基于目前的研究现状,提出以下3点建议:第一,加强噻苯隆在农业生产中的科学使用研究,以最小用量获得最大的效果,最大程度地减少其残留污染。第二,探明噻苯隆在农产品中的降解机理,充分认识噻苯隆的降解本质特征,研究能够去除和降解噻苯隆的控制技术。第三,在绿色、简便、快速的样品前处理新方法和技术产品上加强研究工作,为农产品中噻苯隆的快速、高效及现场检测提供支持。

