富氢气体脱除CO催化剂的制备及性能研究
王海光,刘永峰,张军
(北京建筑大学机电与车辆工程学院,北京市 海淀区 100044)
0 引言
燃料电池具有能量转换密度高、对环境友好、可靠性高及易维护等优点,被视为一个理想的机动车能量来源[1-2]。燃料电池采用Pt作为电催化剂,氢气中残留的CO对于Pt是一种很强的毒物,极易吸附于催化剂的表面,阻碍燃料的催化氧化,而且只要有大于10−5mol/L的CO,就可以给Pt电极带来很大的过电势,从而使燃料电池的利用率降低[3]。
目前,去除燃料电池富氢气体中CO的方法通常有吸附法、蒸馏法、Pd膜分离法和催化氧化法。其中:吸附法容量有限,脱除精度低;蒸馏法存在流程长、能耗高、投资大等问题;Pd膜分离法更换膜的成本高、效率低;催化氧化法则存在催化剂烧结和脱除不干净的问题[4]。因此,开发出具有高活性、耐热且成本低的CO脱除催化剂非常必要。
催化剂的孔道在控制催化活性和选择性方面起着重要作用。通常,大部分活性中心存在于钴基催化剂的孔道内。对于负载型钴基催化剂,载体的多孔结构决定了负载钴颗粒的大小。Borg等[5]研究表明,当Co3O4颗粒位于介孔氧化铝的孔中时,Co3O4的粒径随着氧化铝的孔径增大而增大。然而,当Co3O4颗粒位于介孔氧化铝表面时,Co3O4的粒径与孔径无关。有研究[6-7]证实,CO甲烷化反应属于结构敏感反应,钴粒径对CO转化有很大影响,当钴粒径为6~8 nm时可获得高CO转化率;当钴粒径小于6 nm时,CO转化率会降低;而对于粒径大于8 nm的催化剂,CO加氢的转换频率与钴粒径无关。
基于以上研究可以发现,载体对最终CO甲烷化催化剂的粒径及催化性能非常重要,选择具有合适孔径的载体是制备负载型钴基催化剂的一个重要因素。氧化铝因其热稳定性好、强度高、比表面积大,是CO甲烷化中常用的商业载体[8]。然而,氧化铝的孔径分布较难控制。
本文采用不同浓度的碳酸铵沉淀硝酸铝,制备了不同孔径分布及不同结构、性质的氧化铝,通过在氧化铝上浸渍钴获得了负载钴催化剂,通过改变碳酸铵的浓度来调节氧化铝的孔径分布、负载钴的粒径大小以及富氢气体脱除CO的催化性能。
1 试验部分
1.1 催化剂制备
采用Al(NO3)3·9H2O水溶液(1.0 mol/L)作为铝盐,采用碳酸铵水溶液(1.0、1.5、2.0 mol/L)作为碱性沉淀剂,先在50℃水浴中以400 r/min的搅拌速度进行沉淀;然后将水浴加热至80℃并保持1 h;最后,用2倍于悬浮液的去离子水洗涤和过滤沉淀物2次。在110℃下干燥过滤物质12 h,获得氧化铝前驱体,并命名为P-1.0、P-1.5和P-2.0。通过在500℃下分别煅烧P-1.0、P-1.5和P-2.0各4 h,获得氧化铝载体C-1.0、C-1.5和C-2.0。通过将Co(NO3)2·6H2O溶液浸渍到氧化铝载体,然后在110℃下干燥12 h,并在350℃下煅烧4 h,获得质量分数为15%的Co/Al2O3催化剂,分别命名为Cat-1.0、Cat-1.5和Cat-2.0。
1.2 催化剂表征
样品的形貌、尺寸、暴露的晶面是在日立JEM-2100F场发射透射电子显微镜(transmission electron microscope,TEM)上观测的,其测试的加速电压为200 kV。
样品的比表面积、孔容和孔径等织构性质是在ASAP 2460物理吸附仪上获得的;比表面积是通过Brunauer-Emmett-Teller方法计算而得,孔径是采用Barrett-Joyner-Halenda方法获得。
样品的粉末X射线衍射(X-ray diffraction,XRD)是在Panalytical X’pert3粉末衍射仪上进行测定的,扫描速度为8°/min,步长为0.02°。
H2程序升温还原(temperature-programmed reduction,TPR)采用天津先权的TP-5080多功能自动吸附仪,步骤如下:首先将样品装入石英管内,通入氩气,在30℃条件下吹扫;然后切换成V(H2)∶V(N2)=5%,并以10℃/min的升温速率升温至900℃。
H2程序升温脱附(temperature-programmed desorption,TPD)在AutoChem 2910吸附仪上测定,步骤如下:首先将样品装入石英管中,通入氩气,在120℃下吹扫,切换成H2,以10℃/min的升温速率升温至400℃,还原6 h;然后降至室温,氩气吹扫,再切换成H2吸附,尔后切换成氩气吹扫,以10℃/min的升温速率升温至800℃并记录。
1.3 催化剂性能测试
将所制备的催化剂粉碎并以60~80目的尺寸进行筛分,在不锈钢固定床反应器(内径为10 mm)中评价催化剂(2 mL)。催化剂首先在400℃下还原6 h并冷却至室温,然后切换为V(H2):V(CO):V(N2)=96∶2∶2的混合气,其中N2作为内标混入合成气中。废气分析首先采用带有热导池检测器(thermal conductivity detector,TCD)的碳筛填充色谱柱和带有火焰离子化检测器(flame ionization detector,FID)的Porapack-Q色谱柱,粗测产物各气体组分;然后采用德国EC Sense固态聚合物传感器TB200B-ES1/ES4-CO-10-01精测痕量CO的含量。只有在反应运行时间48 h后且氮平衡为100%±5%时,才算作有效结果。
2 结果和讨论
2.1 氧化铝前驱体的物相结构、组成及形貌
由于氧化铝前驱体决定着最终氧化铝载体的结构及性质,因此精确控制氧化铝前驱体的物相组成非常重要,且需要对其进行全方位的表征和分析。沉淀剂及其浓度对所制备的催化材料的组成和结构具有重要影响[9-10]。本研究采用碳酸铵水溶液作为沉淀剂,分别选择1.0、1.5、2.0 mol/L的碳酸铵水溶液沉淀1.0 mol/L的Al(NO3)3·9H2O水溶液。
前驱体的XRD图谱如图1所示。当碳酸铵的浓度等于Al3+浓度,即1.0 mol/L碳酸铵水溶液沉淀硝酸铝时,在氧化铝前驱体P-1.0中获得勃姆石物 相(γ-AlO(OH),JCPDS卡 号 为21-1307,2θ=14.4°,28.2°,38.3°,49.2°,55.2°,64°,71.9°[11])。但其晶相不完整,衍射峰很弱,且在2θ=14.4°没有出现相应的衍射峰。这种现象可以由式(1)进行解释,沉淀中的H+部分溶解了产生的AlO(OH)。当碳酸铵浓度为Al3+浓度的1.5倍时,在前驱体P-1.5中也观察到AlO(OH),其衍射峰强度强于P-1.0中的衍射峰,反应过程如式(2)所示。当碳酸铵的浓度为Al3+浓度的2倍时,在P-2.0中获得了碳酸铝铵(AACH,NH4Al(OH)2CO3,JCPDS卡 号 为42-0250,2θ=15.2°,21.8°,26.9°,30.7°,34.9°,41°,52.8°,55.3°[12]),反应过程如式(3)所示,其晶相完整,衍射峰强。
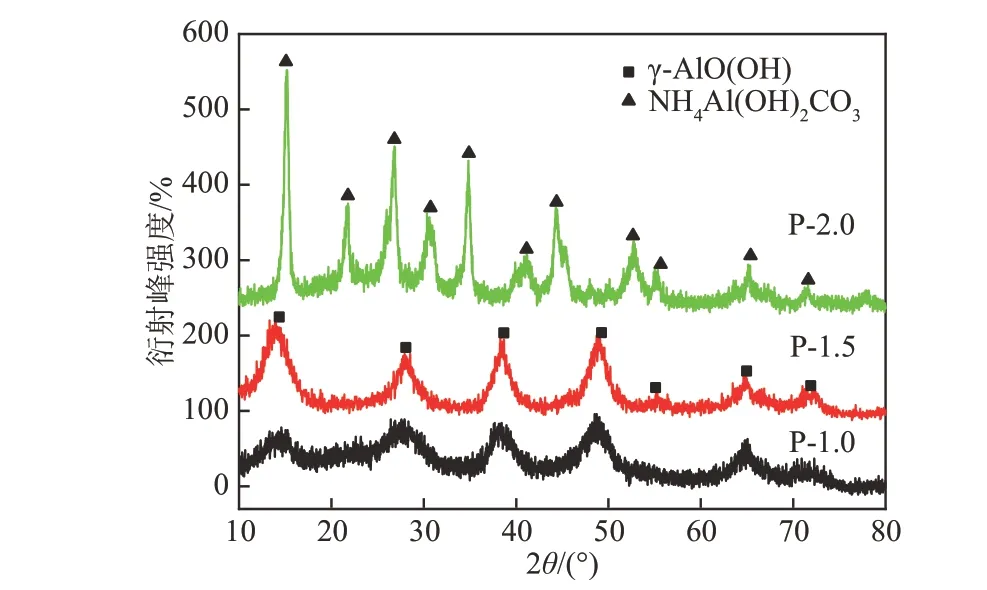
图1 氧化铝前驱体的XRD图谱Fig.1 XRD spectra of alumina precursors

2.2 氧化铝的结构与性能
图2为在500℃空气气氛中加热前驱体4 h所得氧化铝的XRD图谱。结合其前驱体P-1.0的XRD分析,由于前驱体P-1.0结晶度低,在焙烧过程未转化为完整的氧化铝晶体,因而在焙烧后氧化铝载体C-1.0中未观察到相应的衍射峰。在氧化铝载体C-1.5的XRD图谱中,明显的Al2O3衍射峰出现在2θ=37.60°,39.49°,45.80°,60.90°,67.03°(JCPDS卡号为10-0425)。在相同的位置,C-2.0也出现了明显的Al2O3衍射峰,且C-2.0的衍射峰强度大于C-1.5。
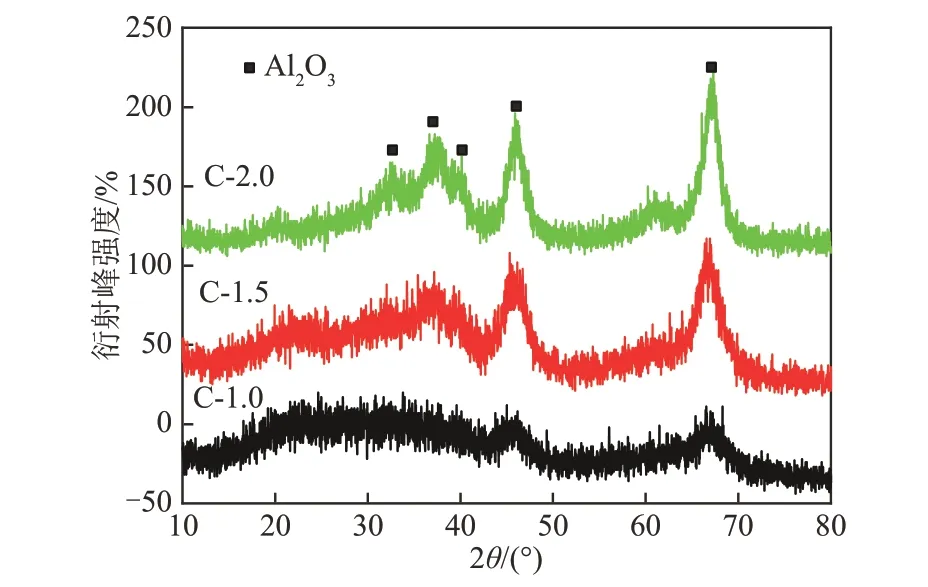
图2 氧化铝的XRD图谱Fig.2 XRD spectra of alumina
以上焙烧过程可以表示如下:
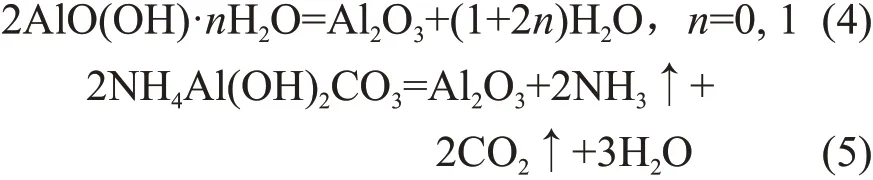
氧化铝的BJH孔径分布曲线如图3所示,其中:V为孔容;r为孔径;dV/d(lgr)为孔径r下的累积孔容。所有氧化铝都显示出双孔分布,小孔归因于表面孔,大孔归因于无序和团聚颗粒形成的堆积孔[13-14]。C-1.0的前驱体P-1.0结晶度低(见图1),且在煅烧过程中不会释放NH3或CO2,因而C-1.0的孔道主要由无序氧化铝堆积而成。尽管前驱体P-1.5在煅烧过程中没有释放NH3或CO2,但由于P-1.5结晶度较高,含水量大,焙烧过程水汽释放,C-1.5也具有丰富的表面孔,只是孔径较小,仅4~5 nm。与上述2个样品不同,前驱体P-2.0主要为碳酸铝铵,在煅烧过程中释放出大量的NH3、CO2和H2O,如式(5)所示,因而C-2.0具有较大的孔径,为7~8 nm。

图3 氧化铝的BJH孔径分布Fig.3 BJH pore distribution of alumina
图4为氧化铝 的TEM图。C-1.0在XRD图 中未出现Al2O3衍射峰,说明其没有明显的结晶;但TEM图中C-1.0却显示为块状,其表面未观察到明显的孔隙,也说明块状的氧化铝堆积形成了孔隙。C-1.5呈羽毛片状,分散性较好,其表面可观察到在焙烧过程由水汽溢出形成的大量微小孔,与BJH孔径分布一致。C-2.0呈棉絮状,显示为蓬松的状态,里面富含大量孔隙,且孔隙相互连通。氧化铝的织构参数如表1所示。如前面所述,由于在焙烧过程释放了大量的CO2、NH3和H2O,C-2.0比C-1.0、C-1.5具有更大的比表面积、孔体积和孔径;C-1.0因焙烧过程没有气体释放而具有最小的比表面积、孔体积和孔径;C-1.0和C-1.5的孔径主要由颗粒之间的堆积孔和填充孔组成。由此可见,各织构参数与孔径分布图、TEM图显示的信息一致。

图4 氧化铝的TEM图Fig.4 TEM images of alumina

表1 氧化铝的织构参数Tab.1 Texture parameters of alumina
2.3 负载型催化剂的相、形貌和还原行为
催化剂Cat-1.0、Cat-1.5和Cat-2.0是通过在C-1.0、C-1.5和C-2.0上等体积浸渍钴,经干燥焙烧得到。氧化铝负载钴催化剂的XRD图谱如图5所示,其TEM图如图6所示。表2中列出了根据Scherrer公式(2θ=37°)计算以及通过TEM图测量的Co3O4平均粒径。

表2 Co3O4、Co平均颗粒尺寸以及H2化学吸附结果Tab.2 Average particle sizes of Co3O4 and Co,and chemical adsorption results of H2

图5 催化剂的XRD图谱Fig.5 XRD spectra of catalysts

图6 催化剂的TEM图Fig.6 TEM images of catalysts
3个催化剂在相同的位置(2θ=18.2°,31.3°,37.2°,45°,55.8°,59.4°,65.2°,JCPDS卡编号为43-1003)出现了Co3O4衍射峰。Cat-1.0的Co3O4衍射峰很尖锐,因为氧化铝载体C-1.0呈大块状,且缺乏承载钴颗粒的孔道,因而对负载其上的钴颗粒没有限域作用,钴颗粒在焙烧过程很容易聚集长大,导致分散度剧烈下降。根据XRD图谱计算,Cat-1.0的Co3O4粒径为14.7 nm,通过TEM图测量其粒径为20.2 nm,更体现其真实大小。Cat-1.5的Co3O4衍射峰也比较尖锐,这是因为C-1.5在煅烧过程中形成了狭窄的孔,钴原子在浸渍过程先进入了孔道,但是由于孔道较小,在焙烧过程重新溢出,并在狭窄的孔口聚集长大,成为较大的钴颗粒,导致分散性变差,同时降低了还原度。
根据XRD图谱计算,Cat-1.5的Co3O4粒径为12.1 nm,通过TEM图测量其尺寸为11.1 nm。C-2.0具有大的孔体积和孔径,可以很好地分散负载其上的钴颗粒,因而Cat-2.0的Co3O4衍射峰不太尖锐。C-2.0上钴颗粒受到孔隙的限制,钴原子在焙烧过程不会溢出。根据XRD图谱计算,Cat-2.0的Co3O4粒径为10.8 nm,孔径大小适中,通过TEM图测量其尺寸为13.6 nm。
由表2可见,Cat-2.0的分散度最大,Cat-1.0的分散度最小,这与前面的催化剂XRD分析结果一致。另外,根据H2化学吸附结果计算的还原钴的半球直径小于相应的未还原Co3O4粒径,并且与未还原尺寸成比例,这真实反映了还原钴颗粒尺寸。H2-TPD结果表明,还原后Cat-2.0的钴粒径为8.0 nm,为最佳粒径[14];Cat-1.0的钴粒径最大,为12.3 nm;Cat-1.5的钴粒径最小,仅为6.2 nm。
为了考察不同催化剂中钴颗粒的分散度,进行了氢气吸脱附实验,并根据H2-TPD分析结果计算了3种制备催化剂中钴的分散度,并根据H2化学吸附结果估算了相应的钴粒径[15]。对于每个样品,获得的分散度是基于样品中钴物种完全被还原的假设。
催化剂的TPR曲线如图7所示。对于催化剂Cat-1.0和Cat-1.5,Co3O4的还原过程可分为3步;而对于Cat-2.0,其还原过程可分为2步。第1个还原峰归属为将Co3O4转化为CoO的还原过程;第2个还原峰归属为将CoO转化为Co的还原过程;第3个还原峰归属为难还原物质铝酸钴的还原过程[14]。3种催化剂的第1个还原峰均出现在230~290℃,这表明3种催化剂将Co3O4还原为CoO的难度基本相同。3种催化剂的第2个还原峰出现在不同的温度范围内,Cat-1.0为400~500℃,Cat-1.5为350~450℃,Cat-2.0为300~400℃。这些结果表明,3种催化剂将CoO还原为Co的难度不同,说明第2步还原取决于钴的粒度及其载体性质。Cat-2.0的第2个还原峰温度低于Cat-1.0和Cat-1.5的第2个还原峰温度,这是由于其钴粒径大小适中,分散性好。第3个还原峰只出现在Cat-1.0和Cat-1.5中,Cat-1.5中更为明显,这是因为钴与载体表面有强烈的相互作用,生成了难以还原的铝酸钴[16]。

图7 催化剂的H2-TPR曲线Fig.7 H2-TPR curves of catalysts
2.4 催化剂的富氢气体脱除CO性能
在给定相同的反应条件下(2 MPa,气体空速为1 000 h−1,V(H2)∶V(CO)∶V(N2)=96∶2∶2),分别在120、150、180、210、240、270℃时对3种催化剂进行评价。
CO残留量随反应温度变化如图8所示。当反应温度低于120℃时,催化剂脱除CO的性能较差;随着反应温度升高,CO残留量有些许波动,但基本呈下降趋势。在120℃时,Cat-2.0即可将CO脱除至300 nmol/L以下;在150℃时,Cat-2.0即可将CO脱除至约20 nmol/L,表现出很好的低温性能;在180℃时,3种催化剂都表现出较好的低温CO脱除性能,CO残留量均小于200 nmol/L,显示了优越性。当反应温度从180℃升至270℃时,Cat-1.0和Cat-1.5的CO脱除率反而下降,但Cat-2.0的脱除率随温度升高而提高,当反应温度为270℃时,CO残留量仅为0.2 nmol/L,完全满足Pt电极燃料电池的使用要求。
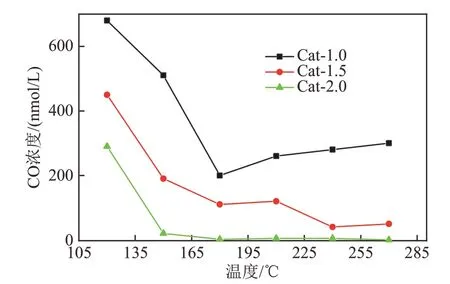
图8 催化剂的富氢气体脱除CO的催化性能Fig.8 Catalytic performance for CO removal from hydrogen rich gas mixture
CO甲烷化反应属于结构敏感反应,钴催化剂的性能在很大程度上取决于钴的粒径。结合图8中的数据可知,Cat-2.0因其合适的钴粒径(8.0 nm)而具有最优的CO脱除性能。Cat-1.0、Cat-1.5分别因其较大的钴粒径(12.3 nm)和较小的钴粒径(6.2 nm)而具有相对较差的CO脱除性能,这一结果与文献[6]中结果基本一致。
实际活性钴物种与催化剂的还原度成正比。催化剂的转化频率是根据H2化学吸附结果评估催化剂固有活性的有力参数。为便于分析比较,根据文献[17]中公式计算了催化剂的转化频率,结果如表2所示。在选定的反应温度下,CO转化率与催化剂的转化频率成正比,与CO甲烷化活性的顺序相同。Cat-1.0具有最小的转化频率,而Cat-2.0具有最大的转化频率。由此判断,CO转化率的大小顺序为Cat-2.0>Cat-1.5>Cat-1.0,即Cat-2.0的CO残留量最小。结合转化频率计算结果可知,Cat-1.0和Cat-1.5中产生较多的铝酸盐是CO残留量高的主要原因[18]。
综上所述,由于氧化铝载体C-2.0具有规则的孔结构和适度的孔径分布,负载钴催化剂Cat-2.0具有最佳的钴颗粒尺寸,提高了CO转化率和富氢气体脱除CO效率。
3 结论
1)采用2.0 mol/L碳酸铵沉淀法制备的氧化铝具有最佳的孔结构,负载的钴粒径约为10.8 nm,有利于提高富氢气体中CO的脱除效率;与1.0 mol/L和1.5 mol/L碳酸铵沉淀法制备的氧化铝载体相比,其性能更加优异。
2)当反应温度为270℃时,催化剂Cat-2.0的CO残留量仅为0.2 nmol/L,完全满足Pt电极燃料电池的使用要求。
3)通过研究得到了新型富氢气体脱除CO催化剂,优化后的氧化铝负载钴催化剂有望实现富氢气体脱除CO催化剂的工业应用。

