吡啶噻唑腙锌配合物晶体结构及性质*
吴文,欧纯宜,牟佳雪,李雄,邹训重
(广东省特种建筑材料及其绿色制备工程技术研究中心,广东轻工职业技术学院,广东 广州 510300)
自从顺铂在临床抗肿瘤上的里程碑式应用以来,金属配合物应用于生物活性药剂的研究得到了广泛关注[1-2]。然而,铂系药物伴随着严重的剂量限制和副作用,包括神经、肝和肾毒性等[3],新型高效、低毒性、高选择性和高生物活性的金属配位化合物是近年来热门的研究课题[4-5]。噻唑、吡啶端基为结构单元,具有有效的生物活性。其衍生物临床应用广泛,包括抗菌[6]、抗HIV 活性[7]、α- 葡萄糖苷酶抑制剂[8]、抗念珠菌[9]、抗克氏锥虫[10]、MAO 抑制剂[11-12]、蛋白酶抑制剂[13]等,已被用作药物研发设计中的关键药效团[14-16]。锌元素是人体中最重要和最丰富的金属之一,对不同金属蛋白的功能至关重要,含锌蛋白质参与重要的细胞过程,如分化、增殖和凋亡[17]。此外,由于锌离子的d10电子构型,其晶体场配位场稳定化能在所有配位环境中均为零[18-19],在不同环境下锌配位化合物的空间构象多样,对化合物的生物学性质有很大的影响[20-21]。本文合成了一种新型吡啶噻唑腙衍生物4-(2-吡啶基)-2-(N-3-吡啶亚甲基肼基)-噻唑,并通过其与对甲苯磺酸锌反应得到了其锌配合物[Zn(L)2(TsO)2]·2DMF,研究了配体及其锌配合物对10种病原菌的体外抑制活性。
1 实验
1.1 试剂及仪器型号
3-吡啶甲醛、2-乙酰基吡啶等试剂均为市售分析纯。
实验所用仪器:元素分析仪(Vario EL III),傅里叶红外光谱仪(Thermo Nicolet Avatrar 330,KBr压片);荧光光谱仪(Shimadzu RF5301PC);酶标仪(SpectraMax®ABS),核磁共振仪(Bruker AVANCE-III 500), 单 晶 衍 射 仪(Super Nova AtlasS2-CCD)。
1.2 配合物[Zn(L)2(TsO)2]·2DMF 的合成
化合物A,B根据已报道文献合成[22-23],如图1 所示;化合物 A(10.8 g,0.05 mol),化合物 B(10.8 g,0.05 mol) 在 160 mL 50% 乙 醇溶液中回流反应2 h,冷却并抽滤得到黄色固体;将固体用500 mL水溶解,然后用10% NaOH溶液缓慢调节pH至中性,抽滤干燥,甲醇重结晶得黄色晶状固体4-(2-吡啶基)-2-(N-3-吡啶亚甲基肼基)-噻唑(9.2g,65.5%)。IR (KBr压片,cm-1):3 125(w),3 056(w),1 602(s),1 587(s),1 574(s),1 515(s),1 476(s),1 422(s),1 362(s),1 333(s),1 250(s),1 100-400(m)cm-1.1H-NMR(400MHz,DMSO)δ12.40(s,1H),8.83(d,1H),8.63-8.50(m,2H),8.14-8.00(m,2H),7.94-7.80(m,2H),7.58(s,1H),7.47(dd,1H),7.32(ddd,1H).FAB-MS m/z(%) :281.9 (M+1)。

图1 配体及配合物合成路线图
配合物的合成:将配体(28.0 mg,0.10 mmol),Zn(TsO)2(40.7 mg,0.1 mmol)溶于 5 mL 的 N,N-二甲基甲酰胺中,过滤于干净的试管中,将试管放置于盛有乙醚的密封瓶内,三天后试管壁内出现淡黄色的晶状固体(30.8 mg,44.8%)。IR(cm-1):3 203(w),3 099(s),1 607(s),1 580(s),1 565(s),1 469(s),1 446(s),1 422(s),1 384(s),1 344(s),1 242(s),1 155(s),1 121(s),1 050(s),1 034(s),1 010(s),455(s),414(s)cm-1.1H-NMR(400MHz,DMSO)δ12.38(s,1H),8.84(s,1H),8.58(s,2H),8.00(d,5H),7.73-7.22(m,4H),7.11(d,2H),2.28(s,3H).C48H50N12O8S4Zn元素分析(%):C,51.63;H,4.51;N,15.05;S,11.49实 验 值(%):C,51.71;H,4.48;N,14.95;S,11.29。
1.3 晶体结构测试
选 取 0.13 mm×0.10 mm×0.08 mm 的 配 合物单晶进行测试,表1中列出了主要的测试条件和晶体学数据。采用CrysAlisPro程序进行还原吸收校正[24],采用Olex2和SHELXT程序解析晶体结构[25-26],并通过SHELXL-2018程序以全矩阵最小二乘法修正所有非氢原子坐标及其各向异性热参数[27],主要键长和键角列于表2。CCDC :2016088。

表1 配合物[Zn(L)2(TsO)2]·2DMF主要晶体学数据
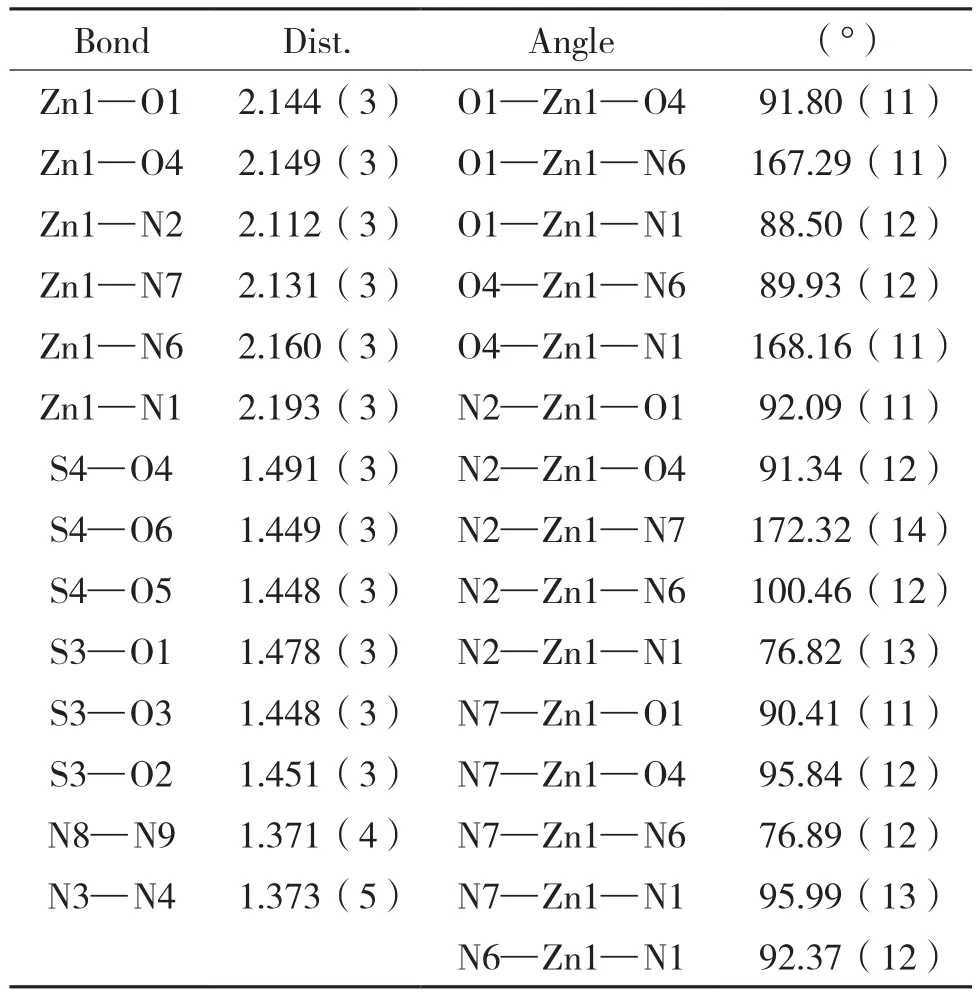
表2 配合物[Zn(L)2(TsO)2]·2DMF主要键长健角数据
2 结果与讨论
2.1 晶体结构分析
单晶结构解析表明该锌配合物属于空间群P1的三斜晶系。图2为配合物晶体结构中金属 Zn(II)离子的配位环境。Zn(II)原子分别与两个配体分子中的四个氮原子配位(Zn1-N2=2.112(3)Å, Zn1-N7=2.131(3)Å, Zn1-N6=2.160(3)Å, Zn1-N1= 2.193(3)Å),以及对甲苯磺酸银离子中两个氧原子配位(Zn1-O1=2.144(3), Zn1-O4=2.149(3)),Zn- O 和 Zn- N 键长与文献报导的 Zn(II)配合物的键长基本一致[28-29]。N2-Zn1-N1与N6-Zn1-N7 键角分别为 76.82(13)和 76.89(12)°,与氧原子配位形成的键角差异显著(O1-Zn1-O4=91.80(11)°,O1-Zn1-N1=88.50(12)°),所以Zn(II)原子位于一个不规则的N4O2八面体配位环境中。此外,腙基上的NH质子与配位氧原子形成氢键弱相互作用(N3-H3…O4=2.022 1(26)Å,N8-H8… O1=2.025 3(27)Å),不对称单元中还有两个游离甲醇分子和一个对甲苯磺酸盐离子,吡啶腙基上的N原子、配体上的S原子不参与配位反应。

图2 配合物中Zn(II)离子的配位环境
2.2 光谱分析
配体及配合物红外光谱图及主要官能团归属见图3和表3;与配体红外吸收光谱比较,配合物谱图中 1 155、1 121、1 050、1 034、1 010 cm-1一系峰归属于对甲苯磺酸盐阴离子中SO3官能团的反对称伸缩振动与对称伸缩振动峰[30],455、414 cm-1归属于 Zn-O、Zn-N 特征吸收峰[31]。

表3 配体及配合物主要官能团红外吸收数据表
图3 配体及配合物红外光谱图
配体及配合物的固体粉末荧光发射光谱如图4a所示,配体与配合物在546 nm和546 nm处出现荧光发射峰(λex= 352 nm),相比于配体,配合物的荧光强度明显增强,这可能是因为金属空轨道接收了来自配体的电子,使得整个分子的共轭度增加,刚性增强,从而产生荧光强度增强的效应[32]。此外,配合物在 310 nm 和 350 nm处出现了新的紫外吸收(图4b)。实验结果表明,该配合物在荧光性能上比配体表现得更强。
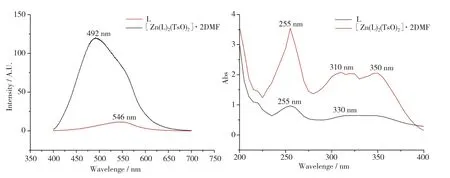
图4 (a)配体 L 和配合物的发射光谱(λex = 352 nm) ;(b)配体 L 和配合物的紫外吸收光谱
2.3 抗菌活性分析
采用96孔板细菌活力吸光度法测试所有化合物的抑菌效果[33-34]。将选取的10种致病菌株在细菌培养箱中培养后,用蒸馏水及液体培养基稀释到合适的浓度并定量(200 μL)加入至96孔板中。由于配合物水溶性较差,称取配体及配合物(2 mg)用超声波分散在PEG400 (0.2 mL)中并保存在4℃待用;取2 μL待测样品加入孔板中并通过酶标仪测定吸光度。以PEG400为空白对照,环丙沙星为对照抗菌药物,在相同条件下对所测化合物的活性进行评价。最低抑菌浓度(MIC)采用二倍稀释法测定。
体外抑菌试验结果表明(见表4),除了枯草芽孢杆菌和铜绿假单胞菌,配合物表现出广谱的抑菌效果,且抑菌活性较配体均有所升高。配合物对伤寒沙门氏菌的抑制活性与市售抗生素环丙沙星相同(见表5)。

表5 配体及配合物最低抑菌浓度(MIC)测定
3 结论
本研究报道了基于吡啶的新型噻唑腙衍生物及其锌配合物[Zn(L)2(TsO)2]·2DMF 的制备、表征和生物活性筛选。通过单晶X射线衍射确定了配合物属三斜晶系,配体L作为双齿剂通过吡啶氮和噻唑氮与Zn2+离子配位。金属配位导致配合物结构刚性增加,配合物与配体相比,荧光强度明显增强。体外抑菌试验表明配合物具有较好的抗菌活性,为新的抗菌材料的进一步设计和合成提供了理论依据。

