胃食管反流病中西医结合治疗研究现状
杨 涛,李天望
1.湖北省中医院脾胃病科(武汉 430061)
2.湖北中医药大学附属医院脾胃病科(武汉 430061)
3.湖北省中医药研究院(武汉 430061)
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃、十二指肠内容物反流至食管,引起反酸、胸骨后烧灼感、胸痛等,部分不典型症状患者可能累及至咽喉部或肺,主要表现为咽部异物感、声音嘶哑、哮喘、慢性咳嗽。GERD全球发病率高达20%,北美地区患病率为18.1%~27.8%,欧洲为8.8%~25.9%,东亚为2.5%~7.8%,中东为8.7%~33.1%[1]。我国GERD患病率为17.3%[2],由于国内GERD流行病学调查并不完善,实际患病率可能被低估。近年来,GERD患病率呈逐年上升趋势,但该病发病机制尚未完全明确,若不及时治疗,易对患者生活质量和身心健康造成较大影响。本文对近年GERD的病因、发病机制、中西医结合诊疗的研究进展作一综述,以期为GERD的防治提供参考。
1 西医对胃食管反流病发病机制的研究
GERD分型包括反流性食管炎(reflux esophagitis,RE)、非糜烂性食管炎(non-erosive reflux disease,NERD)和 Barrett食管(Barrett esophagus,BE)三类。GERD发病机制尚未完全明确,研究发现特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)、各种原因所致的食管黏膜细胞间隙扩大,以及食管受刺激后中枢神经系统的异常反应都与GERD相关[3]。食管上皮渗透性改变导致食管黏膜屏障功能降低,内脏高敏感性、迷走神经紊乱、食管裂孔疝、化学刺激与物理损伤、消化道微生态以及部分药物(如钙离子通道抑制剂、多巴胺、地西泮等)均可能导致GERD的发生[4-6]。肿瘤、食管憩室、贲门失弛缓症、全身性疾病如糖尿病等可继发GERD,风湿性关节炎与GERD具有双向关联性[7]。此外,研究还发现患者的精神心理因素与GERD密切相关[8-9],RE患者焦虑、抑郁患病率分别为36%、34%,NERD患者则分别为51%、45%[10],难治性GERD、NERD患者的焦虑、抑郁水平显著高于其他类型GERD患者[11],且焦虑、抑郁可能会增加患者对反流的敏感性,内脏高敏感性可能是NERD重要的发病机制之一[12]。食管下括约肌(lower esophageal sphincter,LES)功能障碍、食管酸廓清功能障碍、胃肠排空延缓是目前所知GERD的三大重要发病机制。近年研究表明幽门螺杆菌(helicobacter pylori,Hp)感染也与GERD密切相关,Hp感染导致胃黏膜慢性炎症,使胃黏膜收缩、细胞因子增加、胃酸分泌不足,根除Hp治疗后,部分患者反酸加重、胃酸分泌反跳[13],Hp感染可能会影响GERD的严重程度[14],但两者关系目前尚存争议[15-16]。
2 中医对胃食管反流病发病机制的研究
中医并无GERD对应病名,根据其临床症状可归属“吐酸”“吞酸”“嘈杂”“梅核气”“噎隔”等范围,现代学者结合其证候特点及疾病本质提出“食管瘅”的中医病名。GERD的病位在食管,与肝胆脾胃均关系密切,其病因复杂,主要与情志不遂、饮食不节、劳逸不均、药物损伤、脾胃虚弱等有关[17]。中医古籍文献中有大量类似该病的记载和描述,如《医贯》提出“咽系柔空,下接胃本,为饮食之路”;朱丹溪认为“吞酸者,湿热布积于肝,而出于肺胃之间”;《黄帝内经》记载“诸呕吐酸,暴注下迫,皆属于热”“诸逆冲上,皆属于火”,创造性提出了火热致酸的病机;《素问玄机原病式》指出“酸者,肝木之味也,由火盛制金,不能平木,则肝木自甚,故为酸也”,即由肝热所致,感寒初期为中酸,病久则化为湿热。现代研究表明部分胆胃不和证GERD患者伴有口苦[18],即如《灵枢·四时气》所说“善呕,呕有苦,长太息,心中憺憺,恐人将人将捕之;邪在胆,逆在胃,胆液泄则口苦,胃气逆则呕苦”。马辉提出食管受胆调控,胆病则食管调控失职,但病分寒热,则胆胃不和亦分寒热[19]。刘菊、王红梅、沈晨等研究认为GERD以脾胃虚弱为基础,因虚致实,胃气因虚上逆、肝气横逆,导致升降失衡,或本虚标实、脾失运化、气机阻滞、湿热内生、痰瘀互结、浊气上逆[20-22]。张声生等研究则认为胃气上逆、气机失调是GERD的关键病机,和降胃气贯穿治疗始终[23]。综上,中医认为GERD总体病机大致可分为肝胆郁热、肝气犯胃、脾胃虚弱三类,常因情志不遂或饮食不节诱发。
3 中西医对胃食管反流病的诊疗
3.1 诊断及一般治疗
通过临床症状、胃镜检查、食管pH值监测、食管阻抗监测、质子泵抑制剂(proton pump inhibitor,PPI)试验、胃蛋白酶检测等对GERD进行诊断[24],蓝激光内镜可观察食管乳头内毛细血管襻的形态,可能有一定诊断优势[25]。西医对GERD的治疗基于其发病机制,一般包括减肥、抬高床头、避免辛辣酸刺激、戒烟戒酒、睡前3小时避免进食、规律作息等[26-27],减少增加腹压的因素(如便秘、紧束腰带、肥胖等),可缓解部分临床症状。
3.2 西医药物治疗
3.2.1 抑酸类药物
抑酸药目前主要包括PPI、H2受体阻滞剂以及新型钾离子竞争性酸阻断剂(potassiumcompetitive acid blocker,P-CAB)。 传统 PPI类药物包括兰索拉唑、艾司奥美拉唑、雷贝拉唑、奥美拉唑、泮托拉唑、艾普拉唑等。PPI可用于GERD合并肺纤维化患者的治疗,通过减少胃酸分泌,控制肺部炎症及纤维化[28],有效降低BE相关食管癌的发生风险,但约10%~40%的患者对PPI治疗反应不佳[29],长期使用PPI类药物可能会引起如艰难梭杆菌感染导致的肠道菌群失调、骨质疏松导致的骨折,以及社区获得性肺炎和慢性肾病等副作用[30-31]。H2受体阻滞剂代表药物有西咪替丁、雷尼替丁、法莫替丁、拉呋替丁等。在CYP2C19基因快代谢型患者中,P-CAB类药物富马酸沃诺拉赞抑酸效果明显优于等剂量的艾司奥美拉唑,可作为难治性GERD患者新的选择[32-33]。
3.2.2 黏膜保护剂
黏膜保护剂的主要作用是在胃或食管黏膜表面形成镀层,或中和胃酸,阻止胃酸对黏膜的损伤,从而达到保护黏膜的作用。主要代表药物有海藻盐、硫糖铝、铝碳酸镁等。黏膜保护剂与抑酸剂联合使用,对改善患者烧心、打嗝、呕吐、反胃等症状的效果优于单独使用抑酸剂。
3.2.3 促胃肠动力药
临床常用的促胃肠道动力药为5-HT4受体激动剂,如莫沙比利、伊托必利、琥珀酸普芦卡必利等,通过增加LES压力、增强食管廓清能力以及促进胃肠蠕动等途径,减少GERD患者反流症状,但其对难治性GERD的临床疗效尚存争议[34]。
3.2.4 精神类药物
部分患者经抑酸剂、黏膜保护剂、促胃肠动力药常规治疗效果不佳,尤其是NERD和难治性GERD患者,可进行焦虑、抑郁状态评估,当确定合并焦虑、抑郁症状时,可考虑行心理治疗或使用抗焦虑、抗抑郁药物。GERD合并焦虑、抑郁时临床多表现为夜间睡眠障碍、夜间胃酸反流,严重影响规律睡眠,进而引起焦虑、抑郁、狂躁等,应及时疏导缓解情绪,避免身心产生恶性循环。针对内脏高敏感性的精神类药物主要包括三环类抗抑郁药(如去甲替林、美利曲辛)和选择性5-HT再摄取抑制剂(如氟西汀)等。褚源等研究表明常规治疗药物联合使用黛力新可改善GERD患者精神心理症状[35],另有研究显示氟西汀可明显缓解难治性GERD患者反酸烧心症状,有效改善食管高敏感患者症状,而对食管异常酸暴露患者疗效欠佳[36]。
3.2.5 抗反流药物
一过性LES松弛等食管胃动力异常是导致GERD的主要原因,针对其的靶向药物包括GABA-B受体激动剂和mGluR5拮抗剂,主要药物是巴氯芬,可有效缓解反流症状,临床应用受限于其嗜睡、头晕等中枢神经系统不良反应。
3.3 内镜或手术治疗
对于难治性GERD排除其他病因并多方权衡后可考虑内镜或手术治疗,主要包括内镜下注射或植入、胃底折叠术、内镜下贲门缩窄术、内镜下射频消融术、LES电刺激、抗反流黏膜切除术等[37]。新型腹腔镜下磁性括约肌增强术是一种新兴的使用磁性植入物治疗GERD的方法,与传统胃底折叠术相比,其操作简单、并发症较少、疗效明显。其他内镜下治疗虽创伤较小,但术后易并发气胀综合征,远期疗效尚不明确[38],酸或弱酸反流患者术后症状缓解率较高,弱碱反流患者术后症状可能加重,部分患者术后仍需规律服药加以控制,或再次重复手术。LES电刺激可能是有效治疗GERD的新方法,接受该方法治疗的患者食管酸暴露时间、PPI用量、症状评分均得到明显改善[39],同时该方法安全有效,目前暂无不良反应报道。抗反流黏膜切除术以内镜下黏膜剥离术、内镜下黏膜切除术为基础,利用黏膜愈合后形成纤维瘢痕的抗反流屏障,从而达到控制反流的目的,但仍需大样本的临床试验加以验证[40]。
3.4 中医、中西医结合治疗
《胃食管反流病中医诊疗专家共识意见(2017)》将GERD分为6种中医证型[41]。常用经典方剂如解郁合欢汤、木香顺气丸、半夏厚朴汤、旋覆代赭汤、橘皮竹茹汤等疗效较佳,可能与抗炎抗氧化、正向调节胃肠道蠕动以及调节情绪等有关[42]。朱生樑等研究提出“疏肝理气,降逆和中”,重视“木土同调”,重用枳壳、柴胡、佛手等疏肝理气之品,认为该病以肝郁为主,见肝之病,知肝传脾,当先实脾,故亦需肝脾同治[43]。也有研究表明疏肝和胃方可改善患者焦虑与抑郁状态[44],可能通过调控脑内发生的中枢敏化来改善食管内脏高敏感性[45]。李海丹、黄河、唐丽明等多项研究表明中药治疗GERD的症状缓解总有效率显著优于西药方案[46-48],相关研究基本情况见表1。中药治疗依据辨证分型,以经方为主结合临证加减,治疗方药也复杂多样,体现了中医个体化治疗的特色。
对于单纯中药或西药治疗疗效欠佳的患者,可考虑中西医结合治疗。多项研究表明,与单用中药或西药方案相比,中西医结合治疗GERD疗效更佳[49-54],相关研究基本情况见表1。现阶段中西医结合治疗模式一般是在西医治疗基础上加用中医药手段,结合中医整体观念和辨证论治,可做到个性化治疗并提高临床疗效,对临床症状缓解尤为明显,值得临床推广。
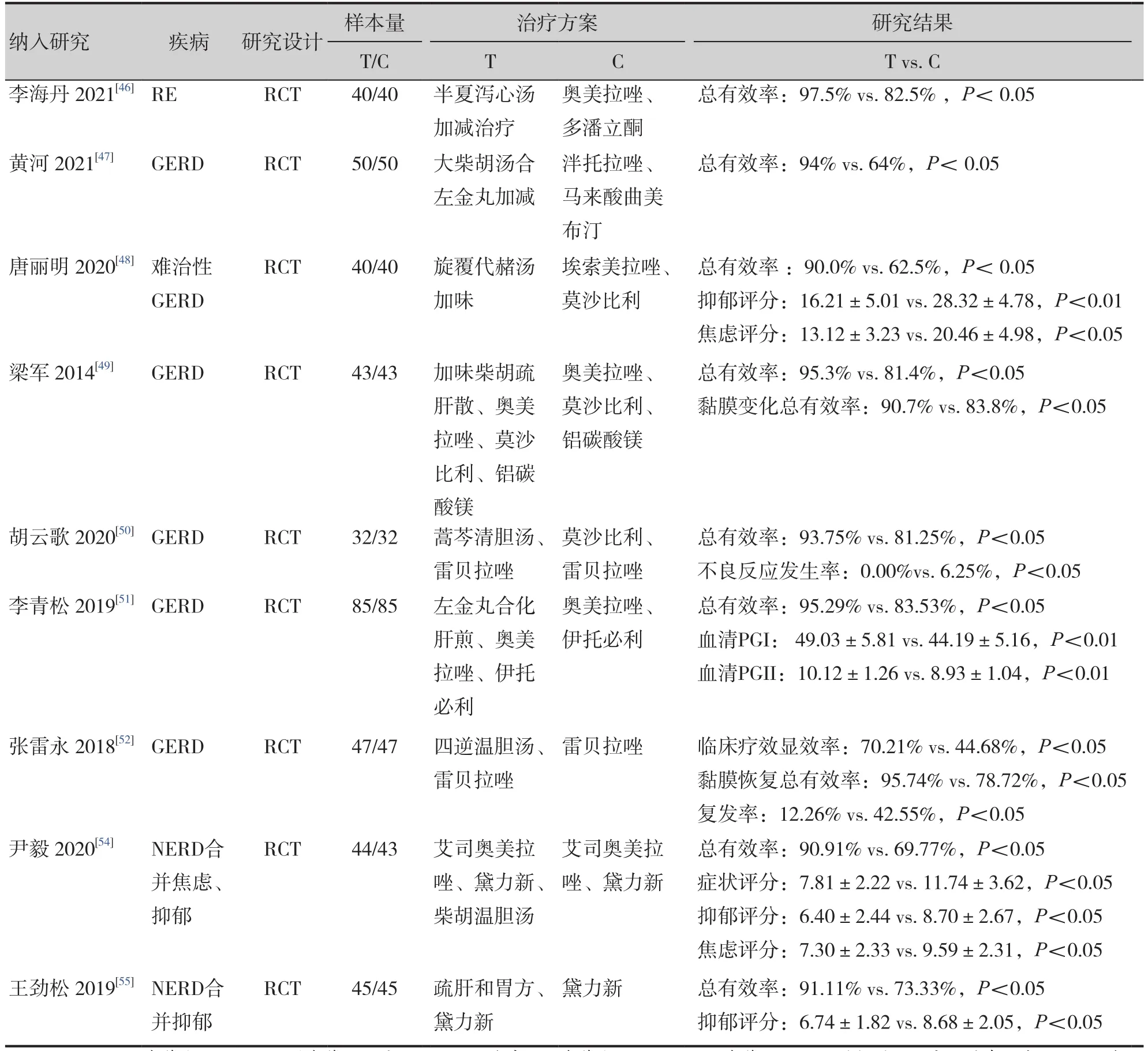
表1 中医、中西医结合治疗GRED的相关研究Table 1.Relevant research on the treatment of GRED by Traditional Chinese Medicine and Integrated Traditional Chinese and Western Medicine
3.5 中医外治法
中医治疗GERD经验较为丰富,特别是难治性GERD[56]。通过针刺与疾病相关的穴位,经过复杂的神经传导,调控化学、内分泌、体液、自身免疫等一系列复杂机制产生疗效[57]。针刺某些特定穴位如足三里、中脘、三阴交、内关等,可增加LES压力,提升抗反流能力,减轻患者的临床症状,与PPI类药物联用效果更好。黄雪等对督脉背段T3-12棘突下进行针刺,对照组口服艾司奥美拉唑,治疗8周后针刺组与对照组症状缓解有效率分别为60%、27%(P<0.05)[58]。贾剑南等将63例难治性RE淤血阻络型患者随机分为西药组、中药组、针刺中药并用组三组,西药予以雷贝拉唑、莫沙比利、铝碳酸镁,中药组予以活血通降方,针刺中药并用组在中药基础上加用针刺足三里、中脘、内关、血海、合谷、公孙,结果显示针刺中药并用组在症状缓解、症状评分方面均优于中药组和西药组[59]。张潇斌等采用针刺“鼻胃”穴配合隔药灸脐的疗法治疗RE疗效较好[60],另有研究也显示将针刺等中医外治法与中西医结合治疗GERD临床疗效更佳[61-62]。针灸、火罐、推拿、热奄包、敷贴、气功等各式中医外治治疗手段简单实用、方便操作、高效价廉、副作用小且易被患者接受,也体现了中医特色治疗的价值和优势。
4 结语
GERD发病机制尚未完全明确,考虑为多因素作用的结果。中医与西医治疗各具优势,亟需制定有效、经济、合理的治疗方案。临床患者使用抑酸剂联合黏膜保护剂、促胃动力药和中医药手段可加速缓解症状,部分患者合并精神心理因素可加用抗焦虑、抑郁药物。临床患者一般首选药物治疗,但长期使用PPI类药物可能引起不良反应。内镜下治疗虽能改善患者症状、减少用药,但增加了患者经济负担,部分患者手术后仍需规律用药或反复手术,其可接受性、安全性、缓解不典型症状是否有效,以及远期疗效等方面缺乏相应临床数据[63]。有机结合中医药理论和现代医学,可有效控制反酸、防止复发,是目前最有效且毒副反应最少的治疗方式,应用前景较大。未来仍需进一步加强中、西医的临床研究,以中医理论为基础,借助现代西医手段和思维,发挥中医药特色优势,推动GERD诊疗科学化、规范化。

