白内障手术不同方向角膜切口对术后泪膜稳定性及角膜神经损伤修复的影响
邹茜 刘志南 周栋 张骏 江一 邓国华
白内障是全球首位致盲性眼病,手术是白内障治疗的首选方法[1-2]。白内障超声乳化手术需做透明角膜切口,部分患者术后出现眼部干涩、角膜散光、角膜炎症、异物感等症状,降低了术后视力及患者生活质量[3-4]。角膜神经可保持角膜的健康,一旦受损会导致角膜感觉、营养、代谢的障碍,引起点状角膜炎、角膜溃疡延迟愈合、干眼等[5-6]。角膜上皮下神经纤维丛位于基底上皮细胞与前弹力层之间,表现为均一、高反射串珠样或线状结构,可见Y形分叉和H形神经纤维连接[7]。目前认为,切口位置是影响角膜功能恢复的关键因素之一[8-9]。如何减少损伤达到更好的术后效果成为白内障治疗医师的追求。但白内障手术不同方向角膜切口是否对角膜神经修复造成影响尚无定论。本研究以常州市第三人民医院年龄相关性白内障(Age related cataract,ARC)患者以及糖尿病性白内障(Diabetes cataract,DC)患者作为研究对象,分析常规不同角膜切口超声乳化对眼表以及角膜恢复的影响,旨在为常见白内障患者术式选择提供参考。
1 对象与方法
1.1 对象
纳入标准:①眼轴长度22~25 mm;眼压<21 mmHg(1 mmHg=0.133 kPa);②角膜曲率两垂直子午线Kl和K2差值为 0.75~1.00 D,角膜中央厚度在正常范围内;③泪液分泌实验Ⅰ(SchirmerⅠtest,SⅠT)及泪膜破裂时间(Break up time,BUT)正常;④DC患者的糖尿病病史大于白内障出现时间。排除标准:①角膜病变、葡萄膜炎、视网膜病变、视神经病变、玻璃体混浊及高度近视、高度远视等眼部患者;②肾脏疾病、全身结缔组织病以及自身免疫性疾病者;③内眼、屈光手术史及眼部外伤史;④术前应用影响泪液分泌及泪膜稳定性药物,如抗青光眼药物、人工泪液、皮质类固醇药物等;⑤术前角膜内皮细胞计数<1 500 个/mm2者;⑥中途退出研究或失访者;⑦合并全身性疾病者或其他术中术后并发症者。
收集2021年9—12月在常州市第三人民医院眼科行超声乳化白内障吸除联合人工晶状体植入术的ARC患者35例(40眼)以及DC住院患者32例(40眼)。本研究遵循赫尔辛基宣言,并获得常州市第三人民医院医学伦理委员会批准(批号:2021012),所有患者知情同意并签署知情同意书。
1.2 分组
35例(40眼)ARC患者按随机数字表法分为2组:Ⅰ组18例(20眼),行上方透明角膜切口,其中男9例(10眼),女9例(10眼),年龄(68.7±6.2)岁;Ⅱ组17例(20眼),行颞侧透明角膜切口,其中男8例(10眼),女9例(10眼),年龄(69.2±5.5)岁。32例(40眼)DC患者按随机数字表法分为2组:Ⅲ组16例(20眼),行上方透明角膜切口,其中男7例(9眼),女9例(11眼),年龄(70.1±5.6)岁;Ⅳ组16例(20眼),行颞侧透明角膜切口,男8例(9眼),女8例(11眼),年龄(68.9±5.9)岁。术前4组患者性别、年龄差异均无统计学意义(均P>0.05)。
1.3 眼表检查方法
术前,术后1 周、1 个月及3 个月行眼表检查。使用K5M眼表分析仪采集BUT、泪河高度(Tear meniscus height,TMH)。按照标准检查程序进行检查和数据采集,所有病例均由同一位技师完成。在不使用表面麻醉的前提下记录SⅠT值,反折一端,贴于患者结膜囊中外1/3处,另一端自然下垂,闭眼,5 min后取下滤纸,观测湿长。
1.4 手术方法及术后用药
所有患者术前行视力、裂隙灯显微镜、眼底、角膜曲率及眼部B超、角膜地形图、人工晶状体度数测量等常规检查。采用闭式透明角膜切口,Ⅰ组和Ⅲ组在上方角膜做主切口,Ⅱ组和Ⅳ组在颞侧角膜做主切口。所有手术操作均由同一人完成。术毕采用妥布霉素地塞米松眼膏包眼。术后采用妥布霉素地塞米松、左氧氟沙星、普拉洛芬滴眼液局部滴眼,术后第1 周每天4 次;第2 周每天3 次,依次递减,持续1个月。
1.5 眼前节光学相干断层成像扫描检查
术后1周、1个月及3个月时行眼前节光学相干断层成像扫描(Anterior segment optical coherence tomography,AS-OCT)检查,调整操纵台高度,让受检者前额和下颌放置于检查托架上,在设备控制界面使被测眼对准探头,通过调节探头的前后来实现聚焦,以角膜为顶点,调整轴向刚好通过角膜主切口从而获得切口面的二维形态。由固定人员采集图像并记录角膜切口哆开、基质水肿、后弹力层局部脱离和内皮错位发生情况。
1.6 角膜共聚焦检查
术后1个月及3个月时行角膜共焦显微镜角膜共聚焦(Corneal confocal microscopy,CCM)检查。采用德国海德堡HRT-3激光共聚焦角膜显微镜观察角膜神经丛。用盐酸奥布卡因对受检眼进行表面麻醉。在设备物镜前端涂上透明润滑剂后安装接触帽,让被测者下颌放在下颌托上,额头顶紧额托,调整镜头使其接触帽与角膜轻微接触,调节物镜焦点,当扫描至角膜上皮时,设置焦点为0 μm。微调物镜位置,调整共聚焦显微镜焦距至角膜前弹力层,选取角膜中央的清晰图像进行图像分析。所有操作均由同一位医师完成。目前,海德堡HRT-3激光共聚焦显微镜无自带量化角膜神经的软件,对患者术后角膜神经愈合类型按Linna等[10]的方法进行分类。将采集的图像用Image J图像分析软件进行定量观察,并计算角膜神经纤维参数[11],包括:①角膜神经纤维长度(Corneal nerve fiber length,CNFL):每平方毫米图像中神经纤维长度;②角膜神经纤维主干密度(Corneal nerve fiber density,CNFD):每平方毫米图像中神经纤维主干数量;③角膜神经纤维分支密度(Corneal nerve branch density,CNBD):每平方毫米图像中神经纤维主干的分支数量;④角膜神经纤维宽度(Corneal nerve fiber width,CNFW):每平方毫米范围内神经纤维的平均宽度。
1.7 统计学方法
前瞻性研究。采用SPSS 19.0统计学软件进行数据分析。呈正态分布的计量资料以表示,呈偏态分布的计量资料以中位数表示。计数资料采用率或构成比表示。各组间性别比较采用联列表卡方检验。各组BUT、TMH、SⅠT术后与术前分别比较采用t检验。各组间年龄、CNFD、CNBD呈方差齐性,采用单因素方差分析进行比较;CNFL、CNFW采用非参数Mann-Whitney检验进行各组间比较。以P<0.05为差异有统计学意义。
2 结果
2.1 泪膜检查
治疗前,每组BUT、TMH、SⅠT无明显差异。术后1周每组BUT、TMH、SⅠT均明显下降,与术前相比差异均有统计学意义(均P<0.05),Ⅰ组与Ⅱ组、Ⅲ组与Ⅳ组组间差异无统计学意义(均P>0.05);Ⅰ组与Ⅲ组、Ⅱ组与Ⅳ组相比,BUT、TMH、SⅠT值均较大,差异有统计学意义(均P<0.05)。术后1个月,每组BUT、TMH、SⅠT较术前稍有下降,与术前相比差异均有统计学意义(均P<0.05),Ⅰ组与Ⅱ组、Ⅲ组与Ⅳ组组间差异无统计学意义(均P>0.05);Ⅰ组与Ⅲ组、Ⅱ组与Ⅳ组组间差异也无统计学意义(均P>0.05)。术后3个月BUT、TMH、SⅠT均恢复到正常水平,与术前相比差异均无统计学意义(均P>0.05),各组组间差异无统计学意义(均P>0.05)。见表1。
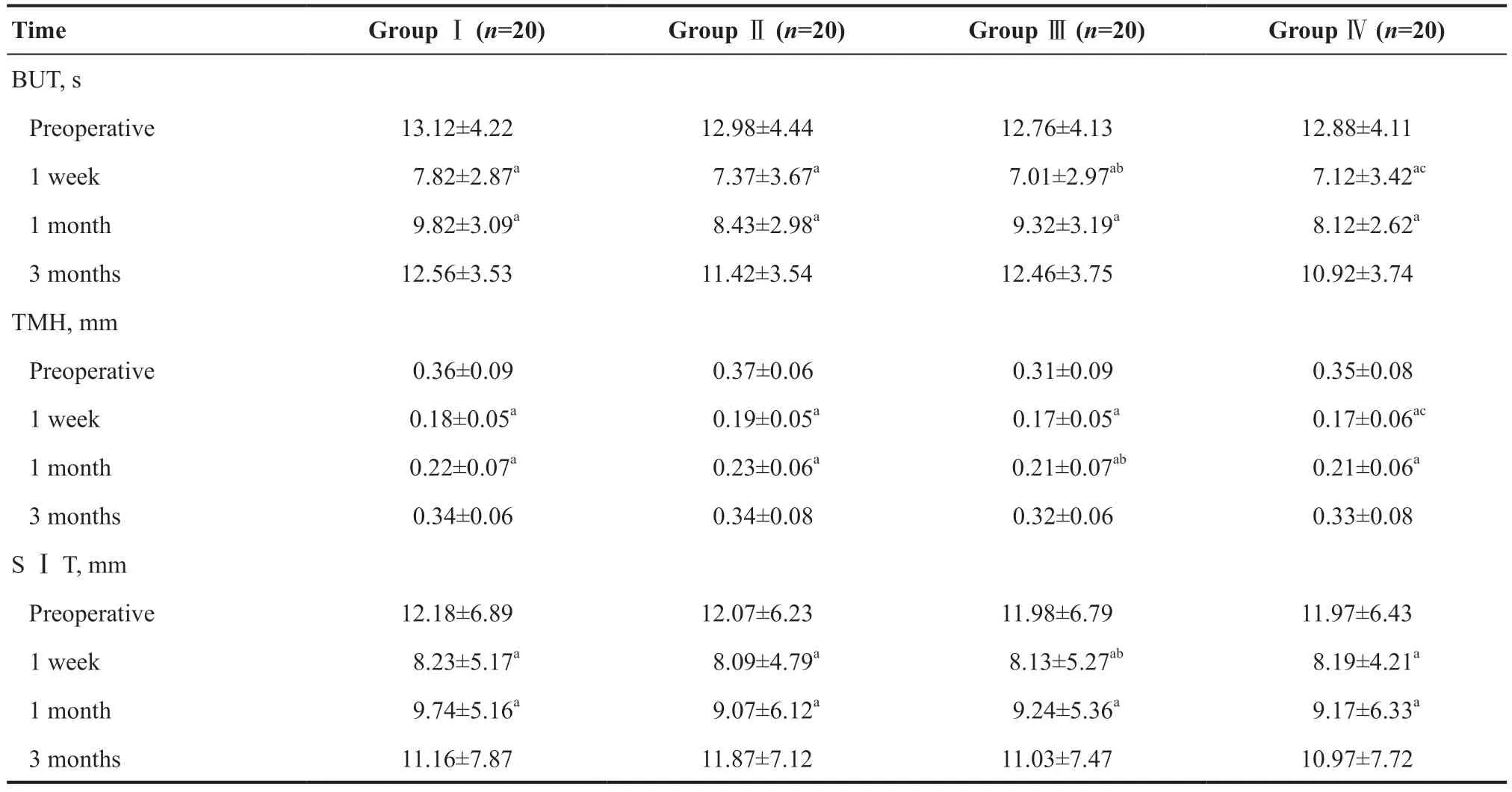
表1.白内障患者手术前后泪膜情况评定Table 1.Evaluation of tear film in patients with cataract before and after operation
2.2 AS-OCT检查
ARC患者和DC患者术后1 周角膜切口均未完全愈合,可见角膜切口内口哆开,部分患者伴有角膜切口处局部后弹力层脱离,部分患者伴有角膜切口处基质水肿;术后1 个月角膜切口基本愈合,内皮和后弹力层处仅留一浅缝隙,部分患者伴有角膜切口处内皮错位,角膜切口处局部后弹力层脱离患者脱离范围较前明显减少,角膜切口处内层局部水肿患者水肿消退;术后3 个月角膜切口全部愈合,仅可见一线状装高信号,角膜切口处局部后弹力层脱离患者脱离范围较前明显减少,但未能完全愈合。见图1。
2.3 CCM检查
术后1个月,所有患者均能检测到角膜神经纤维,但完整的长神经纤维很少,几乎没有神经纤维束连接。其中部分DC患者局部为短神经纤维,神经纤维呈节段状,部分DC患者角膜上皮下神经纤维紊乱,呈网状。术后3个月,4组角膜切口均出现树枝状或细小神经纤维束连接,呈清晰的、反射均一的线状结构。见图2。

图2.白内障术后患者角膜神经纤维图 (×800)A、B:Ⅰ组患者术后1、3个月;C、D:Ⅱ组患者术后1、3个月;E、F:Ⅲ组患者术后1、3个月,可见角膜神经纤维疏松,走行弯曲;G、H:Ⅳ组患者术后1、3个月,角膜上皮下神经纤维紊乱,呈网状。红色箭头为神经纤维束连接;黄色箭头为朗格汉斯细胞Figure 2.Corneal confocal results after cataract surgery (×800)A,B: 1 and 3 months after operation in group Ⅰ;C,D: 1 and 3 months after operation in group Ⅱ;E,F: 1 and 3 months after operation in group Ⅲ,showed that the corneal nerve fiber was loose and curved;G,H: 1 and 3 months after operation in group Ⅳ,showed that the under corneal epithelium nerve fibers were disordered and reticular.The red arrow indicates the connection of nerve fiber bundle;the yellow arrow shows Langerhans cells.
与术后1 个月相比,术后3 个月4 组患者中CNFL、CNFD、CNBD均升高(均P<0.05),CNFW差异无统计学意义(均P>0.05)。术后1、3个月,Ⅰ组与Ⅱ组的CNFL、CNFD、CNBD差异均无统计学意义(均P>0.05);术后1 个月Ⅳ组与Ⅲ组相比,CNFL、CNFD、CNBD较低(均P<0.05),术后3个月时,此差异消失(均P>0.05)。无论术后1 个月还是术后3 个月,Ⅰ组与Ⅲ组、Ⅱ组与Ⅳ组相比,CNFL、CNFD、CNBD均较高,差异均有统计学意义(均P<0.05)。见表2。

表2.白内障患者术后角膜神经纤维各项指标Table 2.Indexes of corneal nerve fibers after cataract surgery
3 讨论
孙一宁和陈蔚[12]研究发现白内障术后会加重干眼情况。本研究显示,透明切口的白内障超声乳化手术会破坏眼表,即使在术后1个月,仍然无法恢复到术前的眼表状态,而这种变化与切口方向无关。有研究表明白内障术后干眼还与术中光照时间、有效超乳时间等有关[13],而本研究尚未对该2种因素做统计与分析。后续研究可对术中相关参数做进一步分析。
在白内障术后评价角膜切口方面,传统观察只能靠裂隙灯显微镜检查是否渗漏,但无法了解角膜横截面的形态。AS-OCT是现代最佳的检查手段,其有直观、高分辨率、动态、无创、非接触性、避免感染等优点。本研究采用AS-OCT观察了角膜切口处的形态,其中有1 例后弹力层局部脱离3 个月未能完全愈合,可能和后弹力层局部卷缩有关。
CCM是一种新型光学显微镜,非侵入性的方式观察眼表组织在细胞水平的损伤,快速获取高分辨率图像和微观结构,被广泛运用于眼表疾病的诊断及眼表组织结构特征与变化的研究。角膜是眼球的重要组成部分,其中角膜神经的作用尤为重要。角膜由三叉神经第一支的眼神经支配,其主要分支在角膜缘互相吻合,形成角膜缘神经纤维丛,随后进入角膜基质浅层,呈放射状穿过角膜基质的中1/3。然后在前弹力层下互相重叠形成致密的角膜上皮下神经丛,继而穿过前弹力层,其终末部分到达角膜上皮[7,14]。
目前白内障手术多采用颞侧透明角膜切口的超声乳化手术,研究发现白内障术中采用颞侧角膜切口,术后眼内散射小,视觉质量高[15]。但有研究表明白内障手术颞侧透明角膜切口造成的神经损伤,不仅使切口部位角膜知觉明显减退,同时中央区及其他部位的角膜知觉均受累,还会导致角膜疼痛,可能是颞侧透明角膜切口造成的周围神经纤维神经递质的运输障碍较大[16-17]。本研究发现ARC患者行白内障手术时上方切口与颞侧切口造成的角膜神经损伤无明显差异。DC患者行白内障手术时上方切口较颞侧切口可减轻角膜切口神经损伤。本研究还发现同样方向的切口,DC患者相比ARC患者愈合较慢。有研究结果表明,糖尿病患者CNFL、CNFD、CNFB均较健康人群减少,NT增加[17]。但本研究术前未对所有患者进行CCM检查,不排除术前DC患者就已经存在角膜神经受损的情况。另外,本研究中发现DC患者角膜上皮下可见较多的朗格汉斯细胞(Langerhans cell,LC),LC属髓源性树突状细胞,是眼表免疫系统中的专职抗原提呈细胞。韩治华等[18]研究显示糖尿病患者角膜中央和周边上皮下的LC密度比正常人要高,本研究中也发现部分DC患者可见LC细胞,但尚不能证明与手术有关系,仍需要进一步加大样本量分析。
有研究表明,鼻侧和颞侧角膜切口破坏角膜神经较大,而上方切口则可减少神经损伤,增加患者术后的舒适度[16],但该研究未对角膜神经进行量化分析。本研究发现DC患者白内障手术颞侧透明角膜切口造成的神经损伤较上方切口修复更慢,因此建议DC患者角膜无特殊散光的情况下行白内障手术时尽量选择上方切口。
综上所述,本研究通过对白内障患者不同方向角膜切口进行随访观察,检测干眼指标以及角膜神经愈合情况,发现白内障超声乳化手术会破坏眼表,但与切口方向无关;而DC白内障手术颞侧透明角膜切口造成的神经损伤较上方切口更慢修复,具有一定的临床指导意义。
利益冲突申明无任何利益冲突
作者贡献声明邹茜:收集数据,参与选题、设计及资料的分析和解释;撰写论文。张骏、江一:对编辑部的修改意见进行修改。邓国华:参与选题、设计和修改论文的结果、结论。刘志南、周栋:参与选题、设计、资料的分析和解释,修改论文中关键性结果、结论,根据编辑部的修改意见进行核修

