内生真菌简青霉CEF-818 对棉花黄萎病的防治效果及机理
蒲丹丹,张亚林,白红燕,魏峰,冯鸿杰,赵丽红,顾爱星,朱荷琴,彭军,*,冯自力*
(1. 中国农业科学院棉花研究所/ 棉花生物学国家重点实验室,河南 安阳 455000;2. 新疆农业大学农学院/ 教育部棉花工程研究中心,乌鲁木齐 830052)
由大丽轮枝菌(Verticillium dahliae)引起的棉花黄萎病(cotton Verticillium wilt)是世界范围内主要的土传性维管束真菌病害,被称为棉花的“癌症”[1],严重影响棉花产量和纤维品质,是我国棉花优质高产的主要障碍之一[2-3],常年大面积发生[4]。 目前,轮作倒茬、抗病品种选育以及化学防治等是防治棉花黄萎病的主要措施。 但大丽轮枝菌寄主范围广、致病力强、变异快,且其微菌核在土壤中存活时间久,因而抗黄萎病棉花品种不易获得[5]。 虽然化学防治对棉花黄萎病的防治效果强、稳定性高,但严重影响人畜安全和生态可持续发展。 近年来,生物防治(简称为“生防”)以绿色环保、不易产生抗性、发展潜力大等优势被人们关注并且应用于生产实践[5]。 可用于防治植物病害的生防因子很多,包括拮抗微生物、抗生素和植物诱导子等[6]。 内生真菌作为非常丰富的微生物资源,普遍存在于植物组织中,对植物的生长具有积极的影响。 在长期的协同进化过程中,与寄主植物形成了互惠共生的关系[7]。 目前,利用拮抗内生真菌防治植物病害已有较多报道。赵沛等[8]从健康的棉花植株中分离得到内生真菌腐皮镰孢菌(Fusarium solani)菌株CEF-373,对棉花黄萎病有显著的抑制效果。 张海军等[9]研究发现,绿色木霉菌(Trichoderma viride)菌株GY20 可导致棉花枯萎病菌(F. oxysporumf. sp.vasinfectum)菌丝断裂,显著抑制棉花枯萎病。Barra-Bucarei 等[10]研究表明球孢白僵菌(Beauveria bassiana)处理番茄和辣椒的根部,能有效抑制灰霉病菌(Botrytiscinerea)引起的病害。牛毅等[11]自羽茅(Achnatherum sibiricum) 分离的内生真菌Neotyphodium sibiricum、N.gansuensis和Epichloё gansuensis对新月弯孢霉(Curvularia lunata)、根腐离蠕孢(Bipolaris sorokiniana)和枝孢霉(Cladosporiumsp.)等病原真菌都具有一定的抑制作用。
目前,关于简青霉(Penicillium simplicissimum)防治棉花黄萎病已有少量研究,如王玲飞[12]从健康的棉花中分离到的简青霉菌株CEF-818 对棉花黄萎病有防治效果, 但作用机理尚不明确。将利用固体发酵方式制成的简青霉CEF-818 生防菌剂应用到农业病害防治中的研究还未见报道。 因此,本研究以从健康棉花植株中分离得到的CEF-818 为研究对象,进一步研究该菌株代谢产物对大丽轮枝菌菌丝生长的影响,评估制成的生防菌剂对棉花黄萎病的防治效果,检测其诱导棉花植株抗病性的能力,初步揭示该菌株防治棉花黄萎病的作用机理,以期为研制高效防治棉花黄萎病的微生物菌剂奠定基础。
1 材料与方法
1.1 材料
拮抗内生真菌简青霉菌株CEF-818(菌株编号:CGMCC 8320)分离自健康棉花植株,属于青霉属的叉状亚属,可在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上生长,其菌落表面呈淡灰绿色。 病原菌: 大丽轮枝菌强致病力菌株Vd080。 棉花品种:鲁棉研21 号,耐黄萎病[13]。
PDA(平板)培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、水1 L,自然pH;马铃薯葡萄糖水培养基 (potato dextrose broth, 液体, 也称为“PDB 培养液”):除不加琼脂外,其他物质添加同PDA 培养基, 自然pH。 察氏培养基(Czapek’s medium,液体,也称为“察氏培养液”):硝酸钠2 g、氯化钾0.5 g、硫酸亚铁0.02 g、七水硫酸镁0.5 g、蔗糖30 g、磷酸氢二钾1.31 g、蒸馏水1 L,自然pH。
1.2 CEF-818 对大丽轮枝菌抑制效果的检测
采用对峙培养法[14]检测CEF-818 对Vd080菌丝生长的影响。 利用PDA 培养基活化Vd080和CEF-818,在25 ℃恒温箱中暗培养7 d。 然后用灭菌后的打孔器在菌落边缘取直径为6 mm 的菌饼 (下文中的Vd080 和CEF-818 菌饼均按此方法制备), 在PDA 平板培养基底部划直线,在两端分别接Vd080 菌饼和CEF-818 菌饼, 两端间隔40 mm, 以只接Vd080 菌饼的PDA 平板培养基为对照,每个处理设5 次重复。 在25 ℃恒温培养箱中暗培养15 d, 观察并测量菌落半径,计算抑制率(I)。抑制率计算公式:I=(r1-r2)/r1×100%, 式中r1和r2分别为对照和处理中Vd080菌落半径增长量(mm)。
采用对扣培养法[8]检测CEF-818 挥发性代谢产物对Vd080 菌丝生长的影响。 将Vd080 菌饼和CEF-818 菌饼分别接种到PDA 平板培养基中央,对扣密封;以菌株Vd080 和空白PDA 平板培养基对扣培养为对照,每个处理设5 次重复。 在25 ℃恒温培养箱中暗培养15 d,采用十字交叉法测量Vd080 菌落半径,计算抑制率。
采用圆盘滤膜培养法[12]检测CEF-818 非挥发性代谢产物对Vd080 菌丝生长的影响。将灭菌后的玻璃纸单层平铺到PDA 平板培养基中,挑取CEF-818 菌饼,放置到PDA 平板培养基中央,在25 ℃恒温培养箱中暗培养10 d 后, 挑取Vd080 菌饼, 放置到去除玻璃纸的PDA 平板培养基中央, 以空白PDA 平板培养基接种Vd080菌饼为对照,每个处理设5 次重复。 在25 ℃恒温培养箱中暗培养15 d,然后利用十字交叉法测量Vd080 菌落半径,计算抑制率。
1.3 CEF-818 对棉花黄萎病的温室防治效果检测
1.3.1灌根接种法。 挑取CEF-818 菌饼(制备方法同1.2) 放置在PDB 培养液中, 在转速180 r·min-1、25 ℃的摇床中培养7 d, 得到CEF-818 液体菌种。先用4 层无菌纱布过滤CEF-818 液体菌种,再用孔径0.22 μm 的微孔滤膜器过滤,获得CEF-818 滤液,备用。 将蛭石、沙子、营养土按体积比3︰2︰1 混合均匀后装入营养纸钵(高10 cm,直径6 cm,下同)中,装土量为营养纸钵体积的80%。 将棉种在45 ℃水中浸泡10 h,每钵播8 粒种子,以6 个营养纸钵为1 个处理,每个处理设3次重复。 播种后,待棉种全部出苗,每个营养纸钵定苗5 株,置于日光温室中培育,待棉苗第1 片真叶初现时,每钵接种50 mL CEF-818 滤液(原液,未经浓缩)即滤液灌根处理,每钵接种50 mL PDB 培养液即PDB 灌根对照(CK)。 3 d 后接种Vd080 孢子悬浮液 (孢子含量1×107mL-1的察氏培养液),每钵10 mL。
1.3.2基质接种法。 在10 g 麦麸培养物中,按料水质量比1︰0.5 加入清水, 混合均匀后装入200 mL 培养瓶中,121 ℃灭菌30 min,待冷却后,按培养物湿质量的5%接种CEF-818 液体菌种(CEF-818 液体菌种制备方法同1.3.1), 在28 ℃恒温培养箱中暗培养7 d, 然后将培养物自然风干,制成CEF-818 固体菌剂,备用。将蛭石、沙子、营养土(体积比3︰2︰1)混合均匀后,按3%(质量分数,下同)接种CEF-818 固体菌剂,混合均匀后装入营养纸钵作为固体菌剂基质处理组;将上述蛭石、沙子、营养土混合物按3%接种无菌培养基质,混合均匀后装入营养纸钵作为无菌培养基质对照组。 将棉种在45 ℃水中浸泡10 h,每钵播8 粒种子,以6 个营养纸钵为1 个处理,每个处理设3 次重复。 播种后,置于日光温室中培育,待棉苗第1 片真叶初现时接种Vd080 孢子悬浮液(孢子含量1×107mL-1的察氏培养液), 每钵10 mL。
1.3.3棉苗的培育及病害调查和计算方法。 上述处理后的棉苗放置在温度20~32 ℃的日光温室中培育,在接种Vd080 孢子悬浮液后25 d,参照赵丽红等[15]5 级分级标准进行黄萎病发生情况调查,计算病情指数和防治效果。 计算公式:DI=∑(Ni×i)/(N×4)×100,式中DI为病情指数,i为病级数值,Ni为i级病株数,N为调查总株数;E=(DI0-DI1)/DI0×100%, 式中E为防治效果,DI0和DI1分别为对照和处理的病情指数。
1.4 CEF-818 对棉花黄萎病的大田防治效果检测
1.4.1肥料撒施法。 CEF-818 固体菌剂制备方法同1.3.2,在棉花黄萎病病圃中进行田间防治效果检测试验,设计种植小区,2 行为1 个处理,每个处理设3 次重复,每行长2.8 m,行距0.55 m,株距20 cm。 在播种鲁棉研21 号时,在每行种沟中均匀撒施5 g 的CEF-818 菌剂或无菌培养物作为固体菌剂处理和无菌培养基质对照。 播种后60 d 调查棉花黄萎病发生情况。 病情的分级标准、病情指数和防治效果的计算同1.3.3。
1.4.2浸种接种法。 CEF-818 滤液制备方法同1.3.1。 以消毒后的鲁棉研21 号棉种在CEF-818滤液中浸泡10 h 为滤液浸种处理, 以PDB 培养液浸种10 h 为PDB 浸种对照, 将处理后的鲁棉研21 号种子种植在棉花黄萎病病圃中, 种植小区设计同1.4.1, 于播种后60 d 调查棉花黄萎病的发生情况。 病情的分级标准、病情指数和防治效果的计算同1.3.3。
1.5 CEF-818 对棉种出苗和棉苗生长的影响
试验设计及棉花的种植和培育方法同1.3.2,播种后5 d 统计处理组和对照组的出苗数并计算出苗率;出苗后20 d,分别在处理组和对照组随机取15 株棉苗,测量棉苗的株高、根长、地上部鲜物质质量、地下部鲜物质质量。
1.6 叶片活性氧含量的检测
鲁棉研21 号棉苗种植方式同1.3.2, 接种Vd080 孢子悬浮液后2 d, 利用3,3-二氨基联苯胺(Diaminobenzine, DAB)组织染色法检测棉花叶片中活性氧的产生和积累,选长势相近的棉花取6 片真叶用无菌水清洗后放到离心管中,在离心管中加入适量的DAB(1 g·L-1)染液,避光染色8 h,倒掉染液后,加入适量95%(体积分数)乙醇溶液,将其放置在沸水中水浴2 min,去除叶绿素后,继续在离心管中加入无水乙醇放置到沸水中水浴直至叶片绿色完全脱去。 然后将叶片浸泡在70%(体积分数)的甘油中,最后利用体式显微镜(Leica M165FC,德国)观察。
1.7 CEF-818 诱导棉花胼胝质积累的检测
鲁棉研21 号棉苗种植方式同1.3.2, 接种Vd080 孢子悬浮液后2 d,选长势相近的棉花,取6 片真叶用无菌水清洗后放到离心管中, 在离心管中加入适量乙醇- 乙酸(体积比3︰1)固定液固定2~3 h,脱去叶绿素;去除固定液后,将叶片分别浸泡于70%(体积分数,下同)和50%的乙醇中2 h 后,用无菌水浸泡过夜;用无菌水漂洗叶片2~3 次后, 将叶片浸泡于10%(质量分数)的NaOH 溶液中处理1~2 h,使叶片透明;去除NaOH 溶液,将叶片用无菌水漂洗3~4 次后放到0.01%(质量分数)的苯胺蓝染液中避光染色3~4 h,染色结束后,在荧光显微镜(Nikon 80i,日本)下观察胼胝质沉积情况。
1.8 CEF-818 诱导棉花防御相关基因表达的检测
1.8.1棉花叶片中总RNA 的提取。鲁棉研21 号棉苗种植和接种方式等同1.3.1, 在接种Vd080后24 h、48 h、72 h 取棉花叶片进行总RNA 的提取,采用RNAprep Pure Plant Kit(天根生化科技(北京)有限公司,北京)提取棉花叶片中RNA,用NanoDrop 2000 检测RNA 浓度,并将RNA 的质量浓度调到100 mg·L-1备用。
1.8.2cDNA 第1 链的合成。 利 用HiScriptⅢ1st Strand cDNA Synthesis Kit 反转录制备cDNA,具体操作步骤参照说明书, 最后将得到的cDNA稀释8~10 倍,-80 ℃保存。
1.8.3检测基因的表达量。 用SYBR Green 为染料进行实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR),检测棉花叶片中防御相关过氧化物酶(peroxidase,POD)基因POD、苯丙氨酸氨裂合酶(phenylalanine ammonia-lyase,PAL)基因PAL和病程相关蛋白(pathogenesis-related protein, PR protein)基因PR10的表达量, 以棉花中高度保守的基因ubiquitin为内参基因, 所用特异性引物序列如表1[16]。 qRT-PCR反应体系:10 μmol·L-1上下游引物各0.4 μL,2×PerfectStart TM Green qPCR SuperMix 10 μL,cDNA 2 μL, 用 无 核 酸 酶 水(nuclease-free water)补足至20 μL;反应条件:94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火15 s,72 ℃延伸10 s,共45 个循环;72 ℃延伸10 min。每个处理重复3 次,采用2-驻驻Ct法计算基因相对表达量。

表1 防御相关基因的特异性引物Table 1 Specific primers of related resistance genes
1.9 检测棉苗根中Vd080 定植量
鲁棉研21 号棉苗种植和菌株接种方式等同1.3.2,在接种Vd080 孢子悬浮液后4 d 取棉苗根部,提取棉花根部总RNA 后反转录为cDNA(方法同1.8),以棉花中高度保守的基因ubiquitin为内参基因,大丽轮枝菌的β-tubulin基因为检测基因(正向引物序列为AACAACAGTCCGATGGATAATTC,反向引物序列为GTACCGGCTCGAGATCG),qRT-PCR 反应体系和反应条件同1.8.3。 采用2-驻驻Ct法对基因的相对表达量进行分析,确定Vd080 在棉花根部的定植量。
1.10 试验数据统计与分析
利用Microsoft Office Excel 2019 整理处理试验数据, 利用软件IBM SPSS Statistics 26.0 对试验数据进行差异性分析,利用软件Origin 2018制图。
2 结果与分析
2.1 菌株CEF-818 对大丽轮枝菌的抑制效果
对峙培养结果 (图1A、B) 表明: 经菌株CEF-818 处理的试验组,菌株Vd080 菌落半径增加6.7 mm;未经菌株CEF-818 处理的对照组,菌株Vd080 菌落半径增加20.7 mm。 菌株CEF-818对菌株Vd080 的抑制率为67.63%。
对扣培养菌落生长测定结果 (图1C、D)表明: 经菌株CEF-818 挥发性代谢产物处理后,菌株Vd080 菌落半径增加11.9 mm; 对照组菌株Vd080 菌落半径增加28.4 mm。 菌株CEF-818 的挥发性代谢产物对菌株Vd080 的抑制率为58.10%。
圆盘滤膜培养结果(图1E、F)表明:经菌株CEF-818 非挥发性代谢产物处理的试验组,菌株Vd080 菌落半径增加0.00 mm; 对照组菌株Vd080 菌落半径增加33.3 mm。 菌株CEF-818 的非挥发性代谢产物对菌株Vd080 的抑制率为100.00%。
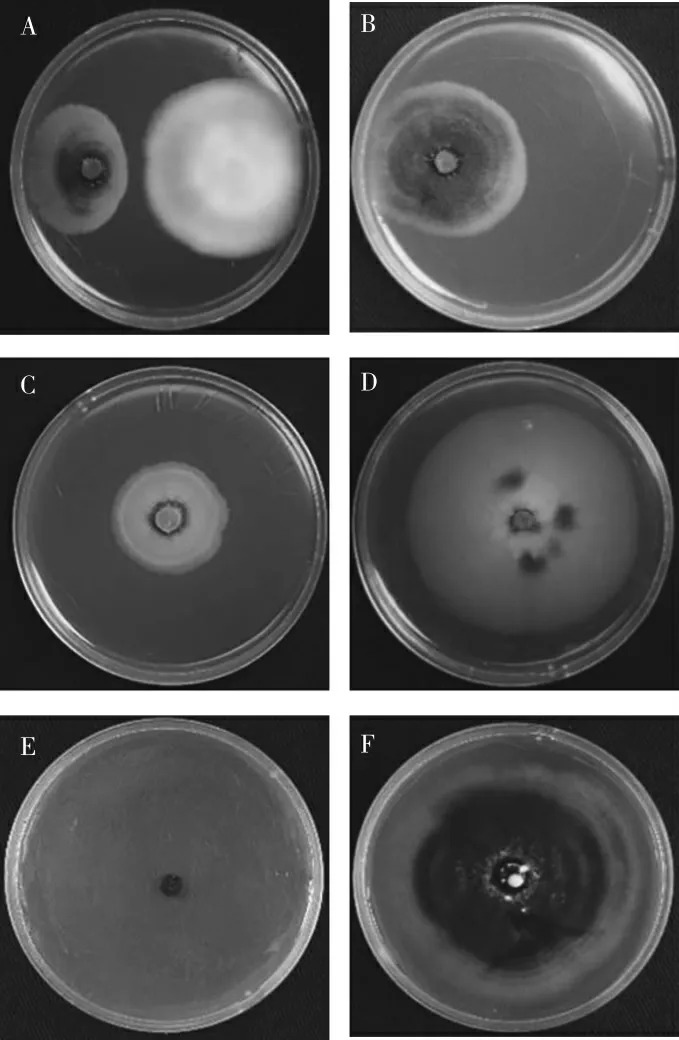
图1 CEF-818 在对峙培养(A、B)、对扣培养(C、D)和圆盘滤膜培养(E、F)下对大丽轮枝菌Vd080 菌落生长的影响Fig. 1 Effects of CEF-818 on colony growth of V.dahliae Vd080 under the confront culture (A, B),plate-to-plate culture (C, D) and exudate filtering culture (E, F)
2.2 菌株CEF-818 对棉花黄萎病的温室防治效果
根据接种Vd080 孢子悬浮液后25 d 的发病情况观察, 在2 种处理方式下,CEF-818 处理的棉花黄萎病的发病程度均较轻,变黄和枯萎的棉花叶片数量较少, 而对照组棉花叶片大量枯萎、凋落(图2)。

图2 棉花内生真菌CEF-818 处理和对照的棉花黄萎病发生情况比较Fig. 2 Comparison of Verticillium wilt occurrence between CEF-818 treatments and relative controls
灌根接种法病情调查结果表明,滤液灌根处理的棉花病株率和病情指数均显著低于PDB 灌根对照,对棉花黄萎病的防治效果为45.84%。 基质接种法病情调查结果表明,固体菌剂基质处理与无菌培养基质对照相比,显著降低了棉花的发病率和病情指数,对棉花黄萎病的温室防治效果为69.77%(表2)。

表2 不同处理下棉花黄萎病发生情况和CEF-818 的温室防治效果Table 2 Cotton Verticillium wilt incidence of different treatments and control effects of CEF-818 in the greenhouse
2.3 菌株CEF-818 对棉花黄萎病的田间防治效果
肥料撒施试验结果表明,固体菌剂基质处理和无菌培养基质对照相比,显著降低棉花发病率和病情指数, 对棉花黄萎病的田间防治效果为63.73%。 浸种接种试验结果表明,CEF-818 滤液浸种处理的棉花病株率和病情指数均显著低于PDB 浸种对照,对棉花黄萎病的田间防治效果为53.96%(表3)。

表3 不同处理下棉花黄萎病发生情况和CEF-818 的田间防治效果Table 3 Cotton Verticillium wilt incidence of different treatments and control effects of CEF-818 in the field
2.4 菌株CEF-818 对棉种出苗和棉苗生长的影响
固体菌剂基质处理和无菌培养基质对照棉种的出苗率分别为91.14%和74.47%(表4),表明菌株CEF-818 对棉种的出苗可起显著促进作用。 结果还表明,CEF-818 对棉苗的株高和地上部鲜物质质量有显著的促进效果,对根长和地下部鲜物质质量的促进效果不显著。
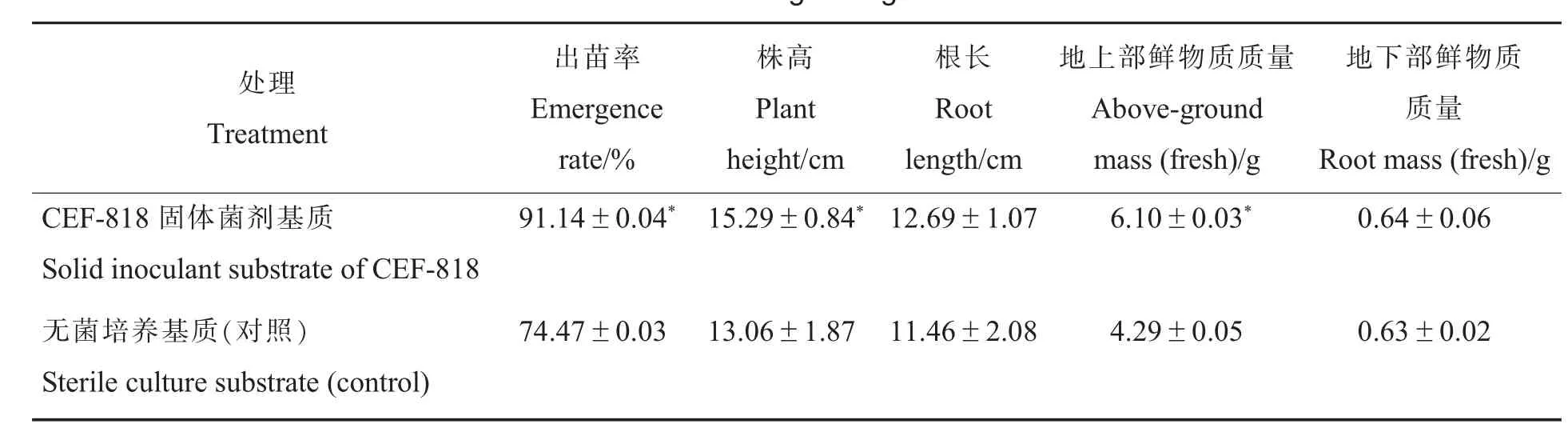
表4 CEF-818 菌剂处理对棉花出苗率和生物量的影响Table 4 Effect of CEF-818 on seedling emergence rate and biomass of cotton
2.5 菌株CEF-818 诱导棉花的活性氧爆发
棉花叶片中活性氧镜检结果 (图3) 显示:CEF-818 固体菌剂处理的棉花叶片中的褐色沉淀较多,而无菌培养基质对照的棉花叶片中褐色沉淀较少。这表明CEF-818 诱导了棉花叶片中的活性氧爆发。
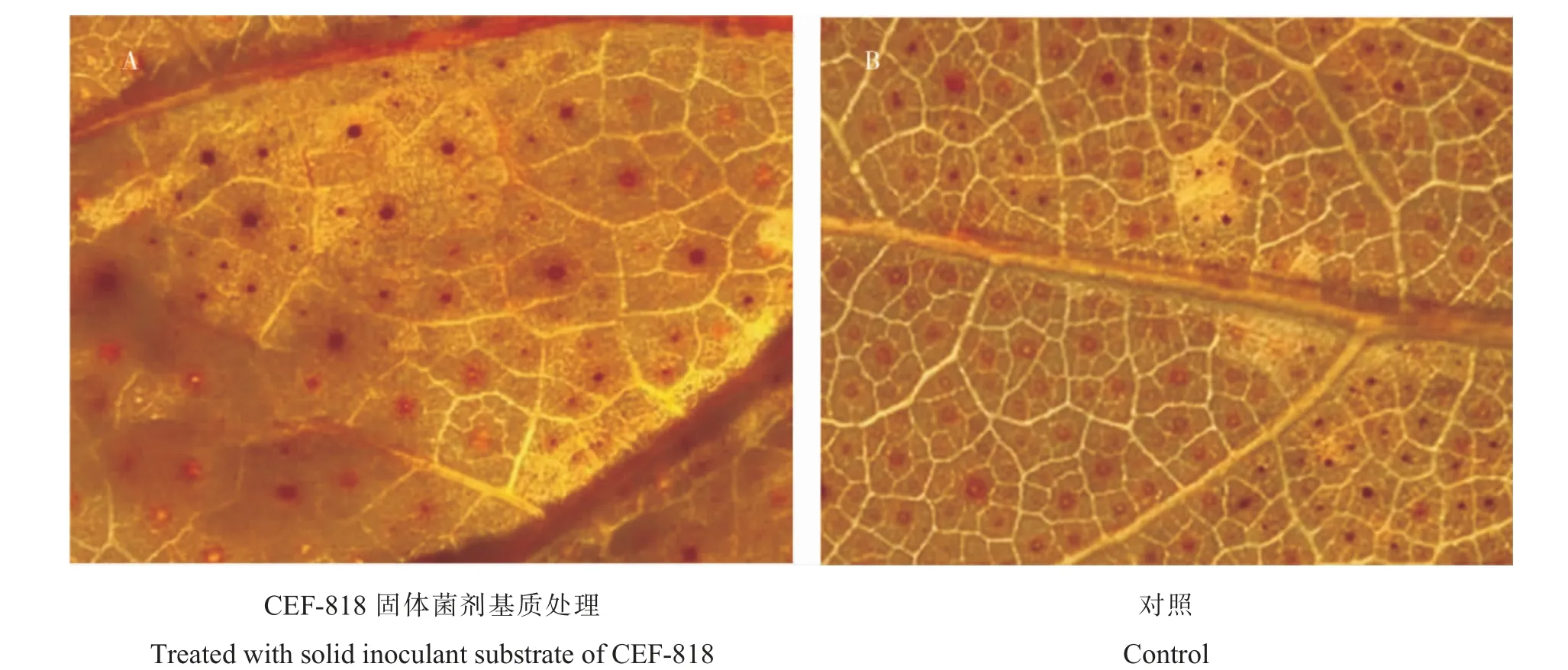
图3 接种Vd080 后2 d CEF-818 诱导棉花叶片中的活性氧爆发Fig. 3 Induction of oxidative burst in cotton leaves by CEF-818 at 2 d after inoculation of Vd080
2.6 菌株CEF-818 诱导棉花胼胝质积累
接种大丽轮枝菌Vd080 孢子悬浮液后2 d,对棉花叶片中胼胝质的镜检结果(图4)显示,经CEF-818 固体菌剂处理的棉花叶片中胼胝质(蓝色荧光)的积累量较多,而无菌培养基质对照棉花叶片中胼胝质的积累量较少。这表明,CEF-818诱导了棉花叶片中胼胝质的积累。

图4 接种Vd080 后2 d CEF-818 诱导棉花叶片中胼胝质积累情况Fig. 4 Induction of callose accumulation in cotton leaves by CEF-818 at 2 d after inoculation of Vd080
2.7 菌株CEF-818 对棉花防御相关基因表达量的影响
棉花叶片中防御相关基因POD、PAL和PR10的表达量检测结果 (图5) 表明, 接种CEF-818 诱导棉花叶片中POD、PAL、PR10显著上调表达。其中:PR10在接种Vd080 孢子悬浮液后48 h 表达量最高, 是对照的1.5 倍;PAL和POD在接种Vd080 孢子悬浮液后24 h 表达量最高,分别是对照的2.09 倍、1.94 倍。

图5 CEF-818 诱导棉花防御相关基因的表达检测结果Fig. 5 Expression detection of defense-related genes induced by CEF-818 inoculation in cotton
2.8 菌株CEF-818 对Vd080 在棉花中定植的影响
棉苗根部的Vd080 定植量检测结果 (图6)显示, 对照组中Vd080 的定植量显著高于处理组,是处理组的3.61 倍,表明CEF-818 能够抑制Vd080 对棉苗的侵染,从而减少Vd080 在棉苗中的定植量。
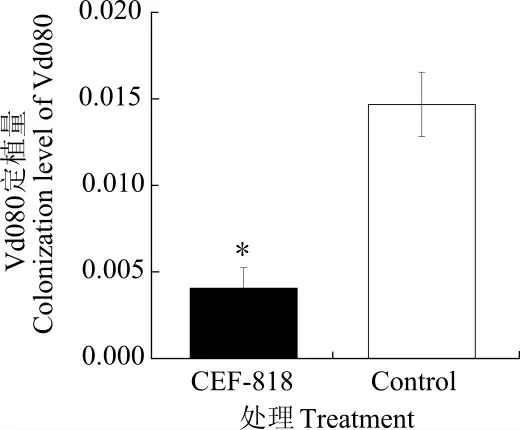
图6 接种后4 d 棉花根部Vd080 的定植量Fig. 6 Colonization level of Vd080 in cotton root at 4 d after its inoculation
3 讨论
利用有益微生物和微生物代谢产物有效地预防和控制植物病害,具有防治成本低、不易产生抗性、资源丰富、环保安全的特点[17]。目前,对棉花黄萎病的拮抗微生物防治研究较多的是芽孢杆菌 (Bacillusspp.)、 假单胞菌(Pseudomonas)和木霉(Trichodermaspp.)等[18],Zabihullah 等[19]在冀棉11 中分离到1 株解淀粉芽孢杆菌(B.amyloliquefaciens)489-2-2 可抑制Vd080 菌 丝的生长, 对棉花黄萎病的温室防治效果可达60.31%;宋晓妍等[20]筛选到木霉菌株SMF5 可分泌细胞壁降解酶, 对棉花黄萎病具有强抑制作用。 本研究以从健康的棉花中分离得到的简青霉CEF-818 为研究对象,分析其对棉花黄萎病的防治效果。 目前,棉花内生真菌简青霉在棉花黄萎病防治应用中的报道较少,Li 等[21]研究发现多种大丽轮枝菌拮抗真菌,其中对棉花黄萎病具有防治效果的生防真菌包括简青霉CEF-818,但其作用机理尚未明确。将简青霉CEF-818 利用固体发酵方式制成微生物菌剂应用到农业生产中还未见有报道,因此,本研究具有现实研究意义。
本研究室内试验发现,CEF-818 非挥发性代谢产物对Vd080 菌丝生长的抑制率为100.00%,挥发性代谢产物对Vd080 菌丝生长的抑制率为58.10%。关于微生物挥发性代谢产物对病原菌的抑制作用已有较多报道,这些挥发性物质可作为抗生素直接抑制病原菌菌丝的生长[22-23];但只有当挥发性物质含量足够高时,才能对病原菌产生拮抗作用,在实际生产应用中很难实现[24]。 因此,在后续的研究中, 需要进一步探明CEF-818 抑菌物质的主要成分, 为该菌株的合理利用提供依据。
在温室和大田环境条件下,CEF-818 固体菌剂基质处理对棉花黄萎病的防治效果分别为69.77%和63.73%。 植物内生真菌在健康植物组织中的存活,受诸多外界环境因子的影响,如温度、雨水、光照等[25]。因此,推测可能是受外界较多的不可控因素影响,将其作为微生物菌剂应用到棉花大田时抑菌活性和入侵植物的能力可能会降低,从而对其田间防治效果造成影响。 这也是CEF-818 作为微生物菌剂在研发应用上需要攻克的难题之一。
生防的机理包括抗生素效应、重寄生、竞争、捕食、交叉保护和诱导抗病性等[15],目前关于CEF-818 对病原菌的作用机理研究较少。 本研究采用的CEF-818 为简青霉真菌, 在PDA 平板培养基中的生长速率比大丽轮枝菌菌株快; 因此,初步推测,在温室和田间预接种CEF-818 固体菌剂后,在大丽轮枝菌侵染棉花植株之前,CEF-818可能会迅速占领棉苗根部的位点,阻碍大丽轮枝菌的入侵,从而降低棉花黄萎病的发病率。 此外,生防菌防治植物病害可诱导植物产生抗病性,从而增强植物对病原菌的抗性;活性氧作为一种信号分子,在诱导植物抗病性检测中具有重要作用[26]。 本研究中,接种CEF-818 固体菌剂可诱导棉花叶片中活性氧爆发和胼胝质积累,还能够诱导棉花植株中防御相关基因POD、PAL和PR10的上调表达。 其中:PAL编码苯丙氨酸代谢途径第一个酶、限速酶,也是第一个被鉴定的植物“防御基因”[27-28];POD基因的编码产物参与木质素的合成, 而木质素是维管组织细胞壁的主要成分,是抵抗病原菌侵入和扩展的重要防卫物质[29];PR10基因编码的植物病程相关蛋白在植物生长发育阶段和应激外界逆境环境时发挥重要作用[30]。综上,CEF-818 能够诱导植物对黄萎病的抗性,但本研究仅初步探索了相关机理,对其更深层次的防御机理及相关的信号转导途径还待进一步研究。
4 结论
棉花内生真菌简青霉CEF-818 的非挥发性代谢产物和挥发性代谢产物均能够有效抑制大丽轮枝菌Vd080 菌丝的生长,CEF-818 固体菌剂对棉花黄萎病的温室和田间防治效果分别为69.77%和63.73%; 此外,CEF-818 可诱导棉花叶片活性氧爆发和胼胝质的积累,还可诱导防御相关基因PAL、POD和PR10的上调表达, 并可抑制大丽轮枝菌在棉苗中的定植。 因此,CEF-818主要通过直接抑制病原菌的生长和诱导植物产生抗性,来达到防治棉花黄萎病的目的。 本研究结果还表明,CEF-818 对棉花黄萎病有显著的防治效果, 具有开发成防治棉花黄萎病菌剂的价值。

