蛇菰多糖对大鼠乙酸型胃溃疡的治疗作用及机制
夏德尧,黄晟哲,赵依如,王江华,牟俊彦,赵方毓,王凤杰,陈显兵
(湖北民族大学1.附属民大医院病理科、2.医学部,湖北 恩施 445000)
胃溃疡(gastric ulcer,GU)是消化系统的常见疾病之一,是一种深达胃黏膜层甚至黏膜肌层的坏死性缺损,临床上以周期性、节律性的上腹部疼痛为主要表现,易反复发作,迁延不愈而成慢性病,严重者可出现便血、胃出血甚至胃穿孔等症状,可能导致死亡[1]。由于人们饮食和生活习惯的改变,GU的发病率逐年上升,且有年轻化趋势。GU发病受到多种因素影响,一般认为,攻击因子与防御因子的失衡是溃疡发生的主要原因,GU的损伤修复同样也是一个涉及多种细胞及细胞因子的复杂过程。研究发现,氧化应激、炎症反应及表皮的分化和再生对GU的发生和发展都起重要作用[2]。因此,通过抑制氧化应激和炎症反应,促进溃疡区域表皮的增生分化,从而减轻胃黏膜损伤,加快GU愈合具有重要意义。
筒鞘蛇菰(BalanophorainvolucrataHook.f.)是土家名贵药材,又名文王一支笔、借母还胎或鸡心七等,具有清热解毒、凉血止血、固肾涩精等功效,湖北恩施民间用以治疗消化性溃疡、肝炎、外伤出血和醉酒等病症。研究发现,筒鞘蛇菰含多糖、黄酮和三萜类等活性成分,具有抗炎镇痛、抗氧化和抗癌等多种药理学作用[3-4]。蛇菰多糖(balanophorapolysaccharide,BPS)是筒鞘蛇菰的有效成分之一,前期研究证实,BPS可通过抗氧化等机制降低糖尿病大鼠血糖,改善脂肪代谢异常[5],但对于GU的疗效观察和作用机制研究未见报道。本研究采用乙酸烧灼法制备GU模型,探究BPS对GU的疗效及可能的作用机制,为GU的临床治疗提供新的思路。
1 材料与方法
1.1 药物、试剂和主要仪器BPS由湖北民族大学中药学实验中心自制。药材全草采自湖北恩施,经湖北民族大学中药学实验中心李厚聪博士鉴定为蛇菰科蛇菰属植物筒鞘蛇菰。新鲜药材洗净后60 ℃烘干,捣成粗粉后称取500 g,以8倍体积的双蒸水浸泡4 h后,加热煮沸2 h,以纱布过滤保存滤液,药渣再加6倍体积水煮沸1 h后留存滤液,合并2次滤液,再加热减压浓缩至1 L,冷却后加入无水乙醇使乙醇体积分数达75%,4 ℃静置过夜;用纱布过滤收集沉淀,并用无水乙醇冲洗3次,于50 ℃烘箱干燥沉淀物,得蛇菰粗多糖。采用苯酚-硫酸法测定其中多糖含量为61.3%。
冰乙酸分析纯(天津市福晨化学试剂厂,批号:20150202),奥美拉唑肠溶片(Omeprazole Enteric-coated Tablets, OME,批号:2004022,青岛双鲸药业股份有限公司),超氧化物歧化酶(superoxide dismutase, SOD,货号:A001-3-2)、丙二醛(malondialdehyde, MDA,货号:A003-1-2)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX,货号:A005-1-2)检测试剂盒(南京建成生物工程研究所),即用型免疫组织化试剂盒(福州迈新生物技术开发有限公司,货号:KIT-9710),肿瘤坏死因子(tumor necrosis factor-α, TNF-α,货号:PT516)和白细胞介素6(interleukin-6, IL-6,货号:PI328)ELISA试剂盒(上海碧云天生物技术有限公司),表皮生生长因子(epidermal growth factor, EGF,货号:A00378-1)单克隆抗体(武汉博士德生物工程有限公司),表皮生长因子受体(epidermal growth factor receptor, EGFR,货号:AF1330)单克隆抗体和β-actin单克隆抗体(货号:AF5003)(上海碧云天生物技术有限公司),生物素标记的山羊抗兔IgG抗体(武汉科瑞生物技术有限公司,货号:137093),其他蛋白免疫印迹相关试剂(上海碧云天生物技术有限公司)。
冰冻切片机(德国Leica Biosystems Nussloch GmbH公司),荧光显微镜(日本Nikon公司),全波长酶标仪(美国Thermo公司),Western blot电泳及转膜系统(美国Bio-Rad公司),Tanon-5200全自动化学发光成像系统(上海天能科技公司)。
1.2 动物、分组和造模60只雄性SD大鼠,8周龄,体质量(200±20) g,购自湖北省实验动物中心,许可证号SCXK(鄂)2015-0018,分笼饲养,自然光照周期,维持室温24 ℃。实验动物操作均符合动物伦理委员会制定的操作标准,接受湖北民族大学动物伦理委员会的监督与检查。
大鼠适应性喂养1周后,随机分为假手术组(Sham)、GU模型组(GU)、OME阳性组(OME)、BPS低、中、高剂量治疗组(BPS-L,BPS-M,BPS-H),每组10只。除Sham组外,各组均采用Okabe[6]的乙酸烧灼法进行胃溃疡模型制备。具体操作:使用10%水合氯醛3.5 mL·kg-1将大鼠麻醉后,在左上腹区域备皮,消毒后纵向做一1.5 cm左右切口,使用无齿镊游离胃体并从切口拉出,使用32 G一次性注射针头将50%乙酸溶液注射至胃浆膜层下,每只0.05 mL,选取相同部位注射,Sham组使用等体积生理盐水注射,确认胃体无出血后,用生理盐水冲洗胃体,用大网膜覆盖注射区,还纳胃体入腹,分层缝合,外涂马应龙麝香痔疮膏,操作全程注意无菌。
1.3 样本采集造模后1 d开始进行灌胃,OME组每日使用OME溶液3.6 mg·kg-1灌胃,BPS-L、BPS-M和BPS-H组每天使用BPS溶液100、200和400 mg·kg-1灌胃,Sham组和GU组使用等体积双蒸水灌胃,连续10 d。末次给药后禁食不禁水24 h,使用10%水合氯醛麻醉大鼠,打开腹腔,将胃体从贲门和幽门离断取出。将胃体延胃大弯剪开,使用生理盐水冲洗内容物,暴露溃疡病灶,带刻度拍照后,以溃疡灶为中心取包括周围0.5 cm的胃组织,将组织分为两部分,一部分使用中性甲醛固定,一部分于-80 ℃冻存备用。
1.4 指标检测
1.4.1各组大鼠溃疡面积和溃疡抑制率计算 根据带刻度拍摄的图片,测量溃疡的最大直径(d1)和最大宽径(d2),按公式进行计算:
溃疡面积/cm2=π× d1/2×d2/2;
溃疡抑制率/%= (1-给药组溃疡面积/模型组溃疡面积)×100% .
1.4.2HE染色观察各组大鼠胃溃疡组织病理形态变化 取中性甲醛固定24 h后的组织样本,进行修块、脱水、透明,石蜡包埋,4 μm切片,60 ℃烤片2 h,全自动染色机进行HE染色,中性树脂封片,扫描图片观察。
1.4.3酶法检测各组大鼠胃组织中SOD活力、MDA含量和GSH-PX活力 取适量冻存的组织样本,加入含苯甲基磺酰氟的细胞裂解液制备组织匀浆,提取总蛋白并测定蛋白浓度。严格按照试剂盒说明书进行操作,测定组织匀浆中各指标情况。
1.4.4ELISA检测各组大鼠胃组织中TNF-α和IL-6蛋白含量 取适量冻存组织样本,同前法提取总蛋白并测定浓度。按照试剂盒说明操作,使用预包被板操作,加样后封板室温孵育2 h,洗板5次,每次30 s;加入生物素化抗体,封板室温孵育1 h,洗板5次,每次30 s;加入辣根过氧化物酶标记Streptavidin,封板室温避光孵育20 min,洗板5次,每次30 s;加入显色剂TMB溶液,封板室温避光孵育20 min;加入终止液,混匀后立即使用酶标仪测量450 nm处吸光度。根据试剂盒所提供的标准品制作标准曲线,计算样本蛋白含量。
1.4.5免疫组化法测定EGF和EGFR蛋白在各组大鼠胃组织中的表达定位 胃组织厚4 μm石蜡切片后,在60 ℃摊片机烤片2 h,二甲苯脱蜡3次,每次3 min;无水乙醇浸泡3次,每次5 min,纯水冲洗1 min,置于EDTA修复液于高压锅高压修复2 min,流水冷却后用PBS溶液冲洗3次,除去PBS,按照免疫组化试剂盒说明,滴加内源性过氧化物酶阻断剂,反应10 min;PBS溶液冲洗3次,滴加非特异染色阻断剂,反应10 min;除去残余试剂,滴加稀释好的EGF(1 ∶200)和EGFR(1 ∶100)抗体,孵育1 h;PBS溶液冲洗3次,除去PBS,滴加生物素标记的山羊抗兔/小鼠IgG聚合物,反应10 min;PBS溶液冲洗3次,除去PBS,滴加辣根过氧化物酶,反应10 min;PBS溶液冲洗3次,除去PBS,滴加DAB显色液避光显色10 min;流水冲洗1 min,置于苏木精染色液1 min,流水冲洗,盐酸酒精分化15 s,流水冲洗,返蓝30 s,流水冲洗,无水乙醇浸3 s,冷风风干水痕,中性树脂封片,扫描图片观察。
1.4.6Western blot检测各组大鼠胃组织中EGF和EGFR蛋白的相对表达量 取冻存组织适量,提取总蛋白,测定蛋白浓度,根据样本中最低浓度标准,使用凝胶电泳上样缓冲液将蛋白样品稀释至同一浓度。经SDS-PAGE电泳后转膜,5%脱脂奶粉室温封闭2 h,EGF(1 ∶2 000)和EGFR(1 ∶2 000)一抗4 ℃孵育过夜,TBST洗涤3次,每次10 min;生物素标记的山羊抗兔IgG二抗(1 ∶5 000)室温孵育2 h,TBST洗涤3次,每次10 min,ECL发光检测,凝胶成像系统显影并分析,β-actin作为内参蛋白。
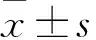
2 结果
2.1 BPS减轻了GU大鼠胃黏膜组织病理损伤Fig 1结果显示,Sham组大鼠胃黏膜无明显缺损,皱襞清晰,GU组、OME组和BPS各治疗组大鼠胃黏膜均出现不同程度缺损,形成椭圆或近似圆形溃疡病灶,溃疡区及周围皱襞消失。经过测量计算发现,与GU组比较,BPS-L、BPS-M、BPS-H和OME组溃疡面积均明显减小(P<0.01),溃疡抑制率分别达45.45%、65.15%、57.58%、56.06%(Tab 1),BPS-M和BPS-H组溃疡抑制率比OME组高,但差异无统计学意义。为进一步观察胃黏膜损伤情况,我们对胃黏膜组织进行了HE染色,结果如Fig 1B所示,Sham组大鼠胃黏膜无明显缺损,细胞排列整齐,无炎性细胞浸润;GU组大鼠胃黏膜缺失明显,结构破坏严重,溃疡损伤深达肌层,淋巴细胞浸润明显;BPS-L组大鼠胃黏膜缺失,结构破坏明显,可见大量淋巴细胞浸润,BPS-M和BPS-H组大鼠溃疡周围胃黏膜形态结构趋于正常,溃疡面黏膜缺损,损伤部位见新生肉芽组织,仍可见少量淋巴细胞浸润,OME组大鼠溃疡周围黏膜形态趋于正常,见少量淋巴细胞浸润。以上结果表明,BPS可以减轻大鼠胃黏膜损伤,对乙酸所致大鼠GU具有较好的治疗作用。

Fig 1 Effect of Balanophora polysaccharide(BPS) on gastric tissue pathological morphology in rats with gastric ulcer (GU)(HE×400)
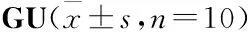
Tab 1 Effect of BPS on ulcer area and ulcer inhibition rate in rats with
2.2 BPS增加了GU大鼠胃组织中SOD和GSH-PX活力,降低了MDA含量氧化应激损伤是胃黏膜损伤的重要因素,SOD、MDA和GSH-PX能较全面的反映氧化应激水平。结果如Tab 2所示,与Sham组比较,GU组大鼠胃组织中SOD和GSH-PX活力明显降低(P<0.01或P<0.05),MDA含量增加(P<0.01);经药物干预后,各指标均有不同程度逆转,与GU组比较,BPS-L、BPS-M和BPS-H组SOD活力分别增加50.51%、71.19%、79.49%(均P<0.01),MDA含量分别减少8.33%、15.28%、11.11%,但均无统计学差异,BPS-H组GSH-PX活力增加27.66%(P<0.05),OME组SOD活力增加113.29%(P<0.01),MDA含量减少38.89%(P<0.01),GSH-PX活力增加25.36%(P<0.05),BPS-H组GSH-PX活力增加率高于OME组,但无统计学差异。以上结果表明,BPS治疗大鼠乙酸型胃溃疡的作用机制可能与抑制氧化应激相关。
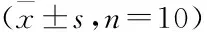
Tab 2 Effect of BPS on SOD activity, MDA content and GSH-PX activity in gastric tissues of rats with GU
2.3 BPS降低了GU大鼠胃组织中TNF-α和IL-6蛋白含量氧自由基不仅能引起氧化应激损伤,而且与炎性损伤也密切相关,炎症反应是GU病理过程中的重要环节。Fig 2结果显示,与Sham组比较,GU组大鼠胃组织内TNF-α和IL-6蛋白含量明显增加(均P<0.01);药物干预后的各组大鼠胃组织中TNF-α和IL-6蛋白含量明显降低,与GU组比较,BPS-L、BPS-M和OME组TNF-α蛋白含量分别降低41.23%、59.92%、71.27%(P<0.05或P<0.01),BPS-L、BPS-M、BPS-H和OME组IL-6含量分别降低47.69%、63.72%、63.53%、77.01%(均P<0.01)。以上结果表明,BPS治疗大鼠乙酸型胃溃疡的作用机制可能与降低TNF-α和IL-6蛋白含量,减轻炎症损伤有关。

Fig 2 Effect of BPS on content of TNF-α and IL-6 protein in gastric tissues of rats with
2.4 BPS上调了GU大鼠胃组织中EGF和EGFR蛋白表达水平EGF和EGFR是重要的胃黏膜防御因子,在胃黏膜的修复过程中起着重要的作用。为了解EGF和EGFR在胃黏膜中的表达部位,我们进行了免疫组化染色,结果如Fig 3A所示,EGF主要在细胞质表达,阳性表达为棕色,在胃黏膜和溃疡基底部均呈弱阳性表达;EGFR在细胞膜和细胞质中均有表达,阳性表达呈棕色,在胃黏膜、溃疡基底部以及溃疡渗出物中均呈强阳性表达。为进一步评估EGF和EGFR的表达水平,我们进行了蛋白免疫印迹检测,结果如Fig 3B、C、D所示,与Sham组比较,GU组大鼠胃组织中EGF和EGFR蛋白表达水平有所升高,分别增加7.36%、66.98%,但无统计学差异;经BPS治疗后,各组EGF和EGFR蛋白表达水平进一步升高,与GU组比较,BPS-L、BPS-M、BPS-H和OME组EGF表达分别升高124.47%、99.50%、103.32%、105.75%(P<0.05或P<0.01),BPS-H组EGFR表达升高91.37%(P<0.05),BPS-L、BPS-M和OME组EGFR表达分别升高35.73%、61.20%、53.74%,差异均无统计学意义;BPS-L组EGF表达高于OME组,BPS-M和BPS-H组EGFR表达高于OME组,但差异均无统计学意义。以上结果表明,BPS治疗大鼠乙酸型胃溃疡的作用机制可能与增加胃黏膜中EGF和EGFR蛋白表达,促进黏膜修复有关。
3 讨论
GU是消化系统常见疾病之一,以胃黏膜坏死性缺损为主要病理表现,而胃黏膜的损伤修复是一个非常复杂的过程,受到多种细胞因子的影响。研究发现,胃黏膜氧化应激、炎症刺激、表皮细胞再生和血管再生等,都会影响GU的发生、发展和愈合[7]。本研究通过对GU大鼠胃组织的病理观察、氧化和炎症损伤相关指标检测以及EGF及其受体EGFR的检测,对BPS治疗大鼠GU的作用机制进行了分析探讨。
在GU的发生发展过程中,氧化应激和炎症反应都是重要的攻击因素。在乙酸刺激下,胃黏膜氧化和抗氧化水平失衡,产生氧化应激反应,氧化应激产生的活性氧(ROS)可以直接或间接地损伤细胞功能,导致胃黏膜屏障被破坏,胃黏膜修复障碍,导致GU的发生[8]。MDA是一种脂质过氧化产物,具有细胞毒性,其含量反映了胃黏膜氧化损伤程度,而SOD和GSH-PX属于抗氧化酶系统,可以反映ROS的清除力,保护细胞不受过氧化物损害,体现胃黏膜的抗氧化水平。炎症反应是GU的特征之一,TNF-α是炎症过程中巨噬细胞分泌的主要促炎因子,可以促进其他促炎因子如IL-1β、IL-6等的释放,诱导中性粒细胞聚集,造成局部炎症反应,破坏胃内保护屏障而导致溃疡形成或加剧[9]。TNF-α和ROS也有着复杂的联系,TNF-α可以诱导ROS的产生,加剧氧化应激反应,而ROS又可以进一步增强TNF-α的水平,加重炎症反应,加剧胃黏膜损伤程度[10]。本研究结果显示,GU大鼠胃组织溃疡损伤明显,抗氧化因子SOD和GSH-PX的活力降低,而攻击因子MDA、TNF-α和IL-6的含量升高,提示GU大鼠胃组织出现氧化损伤和炎症反应;经BPS治疗干预后,SOD和GSH-PX的活力明显升高,MDA、TNF-α和IL-6含量降低,提示BPS可以提高胃黏膜抗氧化水平,减少促炎因子的异常释放,减轻氧化损伤和炎症刺激,从而减轻胃黏膜损伤。

Fig 3 Effect of BPS on expression of EGF and EGFR proteins in gastric tissues of GU rats
EGF是一种重要的生物活性肽,是胃防御因子的重要成员之一,该因子能够抑制胃酸和胃蛋白分泌,改善胃黏膜血流,保护胃黏膜免受损伤,加速溃疡的愈合[11]。研究表明,EGF在正常胃黏膜中少量表达,而当GU发生时,EGF表达降低,但随着溃疡的愈合呈不断升高趋势。EGF的生物活性需与其受体EGFR结合后发挥作用,EGFR是一种跨膜糖蛋白,EGF与之结合后可以形成二聚体,促进黏膜的修复,并减少胃酸分泌,对胃溃疡的愈合有着非常重要的意义。本研究结果显示,EGF和EGFR生理情况下主要在胃黏膜中表达,当GU发生时,EGF和EGFR在受损的胃黏膜和溃疡基底部有明显表达;相对定量结果显示,GU大鼠胃组织中EGF和EGFR表达增加,而BPS治疗后,EGF和EGFR表达进一步增加,表明在GU发生发展的过程中,胃防御因子启动自我修复机制,EGF和EGFR分泌增加,促进溃疡修复,而经BPS治疗后,EGF和EGFR蛋白分泌水平进一步增加,增强了胃黏膜的修复水平,加速溃疡的愈合。
本研究选用OME作为阳性对照药物,实验结果可以发现,BPS-M和BPS-H组对GU大鼠的溃疡抑制率比OME组高,但在作用机制上,BPS在抑制氧化应激和炎症损伤方面作用不及OME,在调控生长因子促进胃黏膜修复方面也与OME没有明显差异,BPS与OME在溃疡抑制率方面的比较并无统计学意义,因此推测是样本量较小,统计误差造成上述矛盾现象。BPS与OME的疗效及作用机制比较,还需要进一步的大样本研究才能得以确定。另外,从结果中可以看出,BPS的调节作用无明显剂量依赖性,尤其在对炎症因子TNF-α的调节方面,BPS-H组的作用不及BPS-L和BPS-M组,对IL-6的影响也不及BPS-M组,推测高剂量的BPS并不能更加有效的抑制炎症损伤,甚至会减弱抑炎作用,不同浓度的BPS在GU的治疗过程中所带来的不同影响,还需要进行更加严谨的药理学实验加以验证。
综上述,BPS对大鼠GU具有较好的治疗作用,可以促进溃疡的愈合,其作用机制可能与抑制氧化应激,抑制炎症刺激,促进胃黏膜再生修复有关,为BPS治疗GU的临床应用提供了一定的理论依据。

