微小RNA-646对胶质母细胞瘤细胞系U251增殖和转移的影响
张传政,常欣辛,张晓东,费帆
胶质母细胞瘤是常见的颅内肿瘤,较高的侵袭力、恶性程度和复发率使其病人预后不佳[1]。微小RNA(miRNAs,miR)参与包括胶质母细胞瘤在内的多种肿瘤的发生发展[2-4]。miR-646是miR-15∕107基因群成员,最初在人大脑白质和灰质中发现,近年来被证实在肺腺癌、结直肠癌和胃癌等多种肿瘤中异常低表达,与肿瘤大小、淋巴结转移和分期等有关,在肿瘤进展中miR-646充当抑癌基因[5-7]。有学者通过癌症基因组图谱筛选563例胶质母细胞瘤病人的miRNA表达谱,发现miR-646的低表达与胶质母细胞瘤病人的不良预后相关[8],然而miR-646在胶质母细胞瘤中的表达及作用并不明了。因此,本研究假设miR-646同样充当抑癌因子参与胶质母细胞瘤的进展。本研究以人胶质母细胞瘤细胞系U251为研究对象,旨在探讨miR-646对U251细胞恶性行为的影响及机制。
1 材料与方法
1.1 材料2018年5月至2019年5月,正常星形胶质细胞HNAs、人胶质母细胞瘤细胞系SHG44、A172和U251(中科院上海细胞库),胎牛血清(杭州四季青),青链霉素混合液(北京索莱宝),1640培养基、胰蛋白酶、Trizol试剂、脂质体2000和MTT试剂(美国Invitrogen),二甲基亚砜(上海博光生物),miR-646模拟物、miR-646抑制剂及其相应对照(广州锐博生物)。上皮钙黏素(E-cadherin)、神经钙黏素(N-cadherin)、波形蛋白(vimentin)和β-肌动蛋白(βactin)抗体(美国CST),叉头框K1(forkhead box K1,FOXK1)抗体(上海钰博生物),辣根过氧化酶标记的二抗(北京中杉金桥)。Bradford法蛋白检测试剂盒(联科生物),双荧光Luciferase检测试剂盒(美国Promega),反转录试剂盒(日本Takara)。实时荧光定量PCR仪和二氧化碳培养箱(哈尔滨东联电子),倒置显微镜(英国BioPulverizer),PCR扩增仪和凝胶成像分析仪(美国Bio-Rad)。
2014年1月至2016年1月,从成都市第六人民医院采集了14对神经胶质瘤样本和相邻的非肿瘤样本,然后在液氮中速冻并保存在-80℃用于RNA的提取和检测。根据WHO对中枢神经系统肿瘤的分类,对所有参与本研究的病人进行了组织学诊断。所有病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1 细胞培养将U251细胞接种至1640培养基(含10%胎牛血清和1%青链霉素)上,常规培养。待生长至80%融合时,以1∶3比例进行传代,第3代细胞用于实验。
1.2.2 分组与转染将U251细胞接种在6孔板(100 000个∕孔)中,培养至80%汇合度时进行转染,分为六组:①模拟物对照组:模拟物阴性对照转染细胞;②miR-646模拟物组:miR-646模拟物转染细胞;③抑制剂对照组:转染miR-646抑制剂对照;④miR-646抑制剂组:转染miR-646抑制剂;⑤miR-646模拟物+pcDNA-FOXK1组:共转染miR-646模拟物和FOXK1过表达质粒pcDNA-FOXK1;⑥miR-646模拟物+pcDNA组:共转染miR-646模拟物和过表达空载质粒pcDNA。转染4 h后,更换培养基。再培养48 h后,收集各组细胞进行指标检测。每组3个重复。
1.2.3 实时荧光定量PCR检测miR-646表达Trizol法提取组织∕细胞总RNA,将RNA逆转录互补DNA(cDNA)进行扩增。PCR反应体系:1 μL cDNA、10 μL SYB Green、正反向引物各0.5 μL,加去离子水补至20 μL。反应过程为95℃预变性1 min后,进入40个循环过程:95℃、10s,60℃、40s,72℃、30s。2-ΔΔCt法计算miR-646的相对表达量,U6为内参。引物序列如下:miR-646正向5'-ACACTCCAGCTGGGAAGCAGCTGCCTC-3',反向5'-CTCAACTGTGCTGCATTAGTTAGCTCAGA-3';U6正向5’-CTCGCTTCGGCAGCACA-3',反 向5'-AACGCTTCACGAATTTGCGT-3'。
1.2.4 MTT法检测细胞增殖将对数生长期U251细胞根据“1.2.2”中的分组转染48 h后,胰酶消化收集各组细胞,并接种至96孔板上(5 000个细胞∕孔),培养24 h、48 h和72 h后,加入MTT溶液(5 g∕L,每孔20 μL),孵育4 h后,加入二甲基亚砜(每孔150 μL)溶解甲瓒晶体,检测各孔吸光度值。
1.2.5 克隆形成实验将对数生长期U251细胞根据“1.2.2”中的分组转染后,胰酶消化收集各组细胞,以每孔800个细胞接种至6孔板中,并保持14 d以上。当细胞克隆可见时,用0.1%结晶紫溶液染色,于显微镜下计数克隆形成数(大于50个细胞)。
1.2.6 Transwell实验检测细胞侵袭、迁移将各组U251细胞用无血清培养基重悬并调整为1 000 000个细胞∕毫升。侵袭实验时前,使用50 mg∕L的Matrigel基质胶铺于Transwell小室底部膜上,并在4℃下风干。迁移实验则直接使用无基质胶包被的小室。将小室放入24孔板内,取200 μL细胞悬液加入上室,600 μL培养基(含胎牛血清)加入到下室。培养24 h后,取出小室,将上室膜表面内细胞擦去,膜下表面细胞用乙醇固定30 min后,用0.5%结晶紫染色15 min。于显微镜下计数穿膜细胞数。
1.2.7 划痕实验检测细胞迁移胰酶消化收集各组细胞,以每孔2 000个细胞接种于6孔板中,并将细胞保持在37℃,5%二氧化碳中直至细胞长满培养板。然后,将200 μL微量移液器在培养板中垂直划直线,创建伤口区域。分别于划痕后即刻和48 h计算划痕愈合率[9],评估细胞的迁移能力。
1.2.8 蛋白质印迹法检测细胞中FOXK1和上皮间质转化相关蛋白表达向U251细胞中加入细胞裂解液裂解提取总蛋白,测定总蛋白浓度后,SDSPAGE分离蛋白样品(50 μg),并转膜。将膜用5%脱脂奶粉封闭2 h后,与一抗工作液(E-cadherin 1∶200、N-cadherin 1∶500、Vimentin 1∶1 000和FOXK1 1∶1 000)在4℃下孵育24 h,再与二抗(1∶5 000)在室温下孵育2 h。化学发光剂显影后,采用凝胶成像系统扫描并分析蛋白条带的灰度值,β-actin为内参。
1.2.9 双萤光素酶报告基因实验检测miR-646和FOXK1的靶向关系将FOXK1的3'UTR片段克隆并重组至pGL3-basic萤光素酶报告基因载体上,将其作为FOXK1野生型载体;另外,将miR-646与突变后的FOXK1 3’UTR克隆重组至pGL3-basic萤光素酶报告基因载体上构建FOXK1突变型载体。将构建的FOXK1野生型和FOXK1突变型载体参照脂质体2000说明书分别与miR-646模拟物、模拟物对照或miR-646抑制剂、抑制剂对照共转染至U251细胞中,转染48 h后,收集细胞检测萤光素酶活性。
1.3 统计学方法每组3个复孔,实验重复3次。结果以±s表示,SPSS 22.0软件用于统计学分析,采用独立样本t检验用于两组间比较,单因素方差分析和SNK-q检验用于三组及以上的组间两两比较。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-646在胶质瘤组织中的表达胶质瘤组织中miR-646表达水平0.36±0.03明显低于正常脑组织1.00±0.06(t=16.53,P<0.001)。
2.2 miR-646在胶质瘤细胞和正常星形胶质细胞中的表达与HNAs细胞(1.00±0.08)相比,胶质瘤细 胞SHG44、A172和U251(0.54±0.04、0.63±0.06、0.38±0.04)中miR-646表达水平显著降低(P<0.05),其中U251细胞差异最显著。
2.3 转染后各组U251细胞中miR-646表达与模拟物对照组(1.00±0.11)相比,miR-646模拟物组(5.28±0.53)miR-646水平升高(P<0.05);与抑制剂对照组(1.00±0.10)相比,miR-646抑制剂组(0.24±0.03)miR-646水平降低(P<0.05)。
2.4 miR-646对U251细胞增殖的影响与各自非特异性对照相比,miR-646模拟物组细胞在24 h、48 h和72 h的增殖活力明显降低,细胞克隆形成数明显减少,而miR-646抑制剂组细胞的增殖活力明显增强,细胞克隆形成数显著增加(P<0.05)。见表1,图1。
表1 miR-646对U251细胞增殖的影响
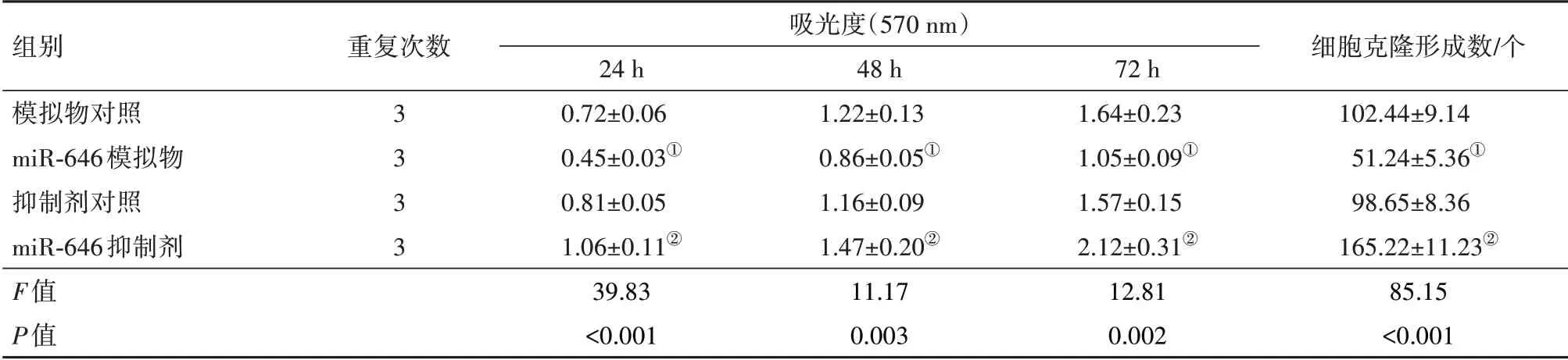
表1 miR-646对U251细胞增殖的影响
注:①与模拟物对照组相比,P<0.05。②与抑制剂对照组相比,P<0.05。
组别模拟物对照miR-646模拟物抑制剂对照miR-646抑制剂F值P值重复次数3 3 3 3吸光度(570 nm)24 h 0.72±0.06 0.45±0.03①0.81±0.05 1.06±0.11②39.83<0.001 48 h 1.22±0.13 0.86±0.05①1.16±0.09 1.47±0.20②11.17 0.003 72 h 1.64±0.23 1.05±0.09①1.57±0.15 2.12±0.31②12.81 0.002细胞克隆形成数∕个102.44±9.14 51.24±5.36①98.65±8.36 165.22±11.23②85.15<0.001
2.5 miR-646对U251细胞侵袭的影响与各自非特异性对照(75.36±6.62)相比,转染miR-646模拟物可使U251细胞侵袭能力明显减弱(75.36±6.62比46.55±3.16),而转染miR-646抑制剂后U251细胞侵袭 能 力明显增 强(68.82±7.05比101.25±9.95,P<0.05)。见图2。
2.6 miR-646对U251细胞迁移的影响与各自非特异性对照相比,转染miR-646模拟物可使U251细胞迁移能力明显减弱,划痕愈合率显著降低,而转染miR-646抑制剂后U251细胞迁移能力明显增强,划痕愈合率显著升高(P<0.05)。见表2,图3。
表2 各组中迁移细胞数的比较
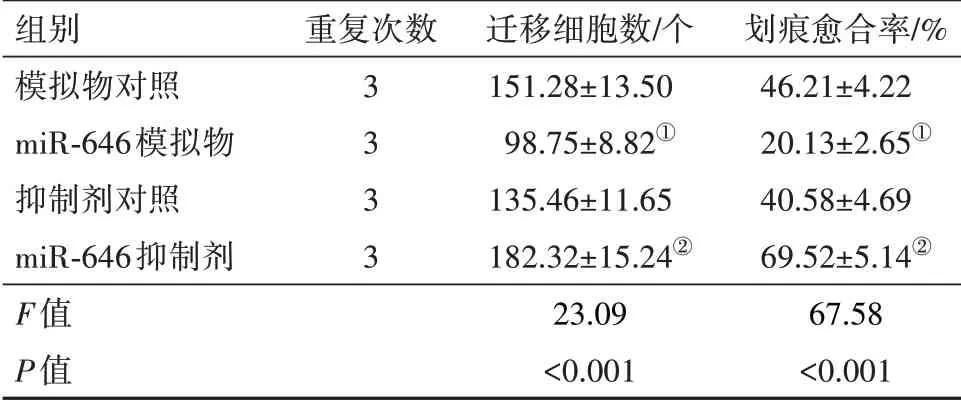
表2 各组中迁移细胞数的比较
注:①与模拟物对照组相比,P<0.05。②与抑制剂对照组相比,P<0.05。
组别模拟物对照miR-646模拟物抑制剂对照miR-646抑制剂F值P值重复次数3 3 3 3迁移细胞数∕个151.28±13.50 98.75±8.82①135.46±11.65 182.32±15.24②23.09<0.001划痕愈合率∕%46.21±4.22 20.13±2.65①40.58±4.69 69.52±5.14②67.58<0.001
2.7 miR-646对U251细胞上皮间质转化的影响与各自非特异性对照相比,miR-646模拟物可明显促进U251细胞中上皮标志物E-cadherin蛋白表达,且显著抑制间质标志物N-cadherin和Vimentin蛋白的表达(P<0.05);而miR-646抑制剂作用结果恰好与miR-646模拟物结果相反,可明显抑制E-cadherin并 促 进N-cadherin和Vimentin蛋 白 的 表 达(P<0.05)。见表3,图4。
表3 各组细胞中E-cadherin、N-cadherin和Vimentin蛋白表达的比较s
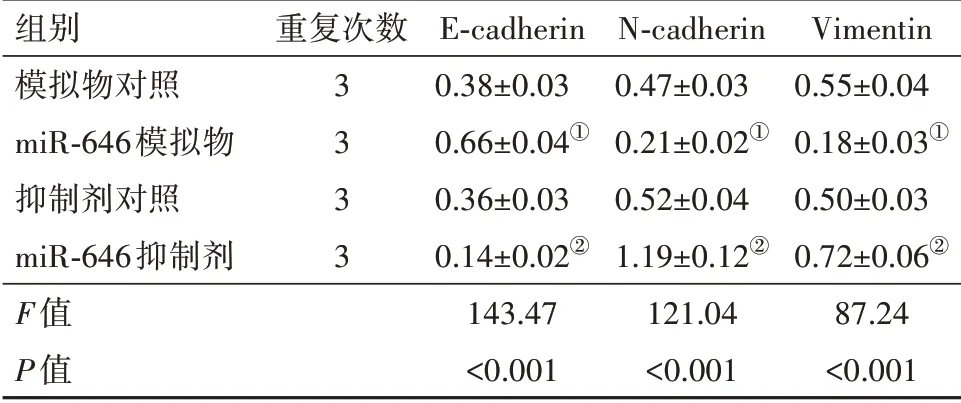
表3 各组细胞中E-cadherin、N-cadherin和Vimentin蛋白表达的比较s
注:E-cadherin为上皮钙黏素,N-cadherin为神经钙黏素,Vimentin为波形蛋白。①与模拟物对照组相比,P<0.05。②与抑制剂对照组相比,P<0.05。
组别模拟物对照miR-646模拟物抑制剂对照miR-646抑制剂F值P值重复次数3 3 3 3 E-cadherin 0.38±0.03 0.66±0.04①0.36±0.03 0.14±0.02②143.47<0.001 N-cadherin 0.47±0.03 0.21±0.02①0.52±0.04 1.19±0.12②121.04<0.001 Vimentin 0.55±0.04 0.18±0.03①0.50±0.03 0.72±0.06②87.24<0.001

图4 蛋白质印迹法检测E-cadherin、N-cadherin和Vimentin蛋白表达
2.8 FOXK1是miR-646的 靶 基 因Targetscan数据库预测到FOXK1的3'UTR区域存在miR-646的结合位点。双萤光素酶实验发现,与各自非特异性对照相比,miR-646模拟物可使转染FOXK1 3'UTR野生型质粒的U251细胞萤光素酶活性降低(P<0.05),而miR-646抑制剂处理则得到相反的结果,可升高细胞的萤光素酶活性(P<0.05);但是,miR-646模拟物或抑制剂与FOXK1 3'UTR突变型质粒共转染的U251细胞萤光素酶活性无明显变化(P>0.05)。与各自非特异性对照相比,miR-646模拟物可明显抑制U251细胞中FOXK1蛋白表达(P<0.05);而miR-646抑制剂作用结果恰好与miR-646模拟物结果相反,可明显促进FOXK1蛋白的表达(P<0.05)。见表4,图5。
表4 各组细胞萤光素酶活性和FOXK1蛋白水平比较s
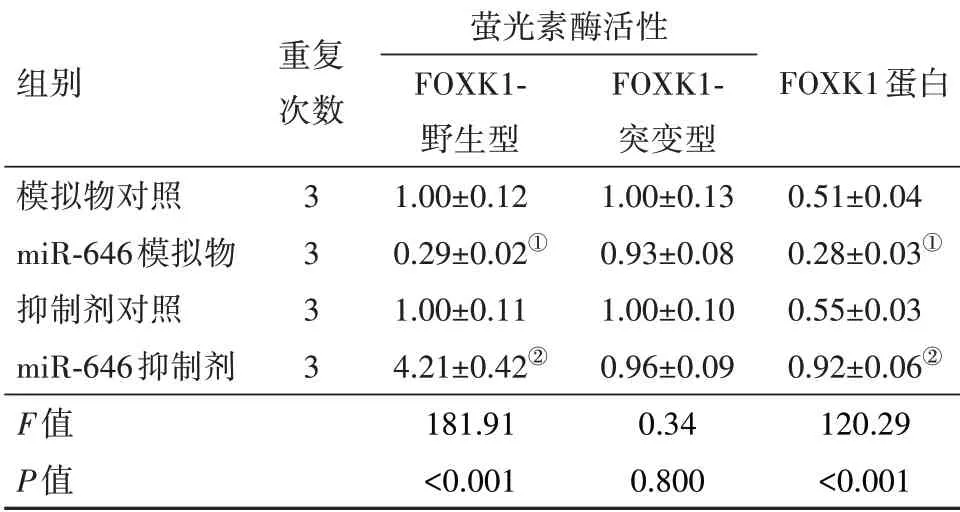
表4 各组细胞萤光素酶活性和FOXK1蛋白水平比较s
注:FOXK1为叉头框K1。①与模拟物对照组相比,P<0.05。②与抑制剂对照组相比,P<0.05。
组别模拟物对照miR-646模拟物抑制剂对照miR-646抑制剂F值P值重复次数3 3 3 3萤光素酶活性FOXK1-野生型1.00±0.12 0.29±0.02①1.00±0.11 4.21±0.42②181.91<0.001 FOXK1-突变型1.00±0.13 0.93±0.08 1.00±0.10 0.96±0.09 0.34 0.800 FOXK1蛋白0.51±0.04 0.28±0.03①0.55±0.03 0.92±0.06②120.29<0.001
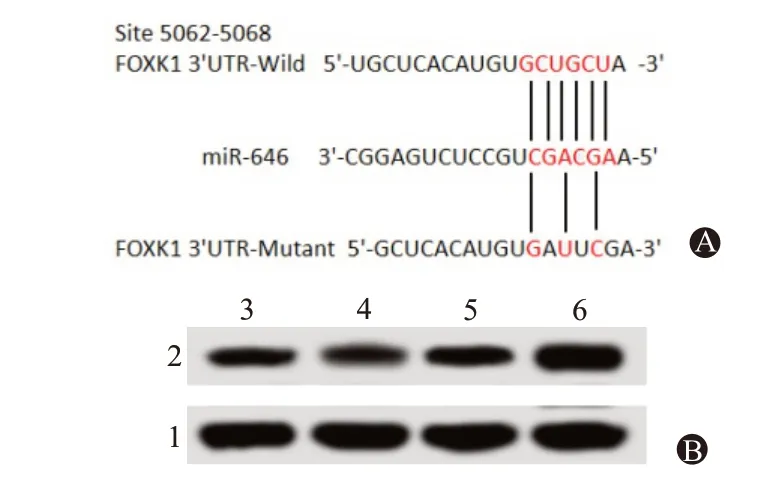
图5 miR-646靶向调节FOXK1表达:A为Targetscan数据库预测的FOXK1与miR-646的结合位点;B为FOXK1蛋白表达
2.9 FOXK1过表达逆转了miR-646过表达对U251细胞增殖和转移的作用与miR-646模拟物+pcDNA相 比,miR-646模 拟 物+pcDNA-FOXK1组可明显提高U251细胞24 h、48 h和72 h的增殖活力、细胞克隆形成数,明显增强细胞的侵袭、迁移能力,明显增加划痕愈合率(P<0.05)。见表5,图6。
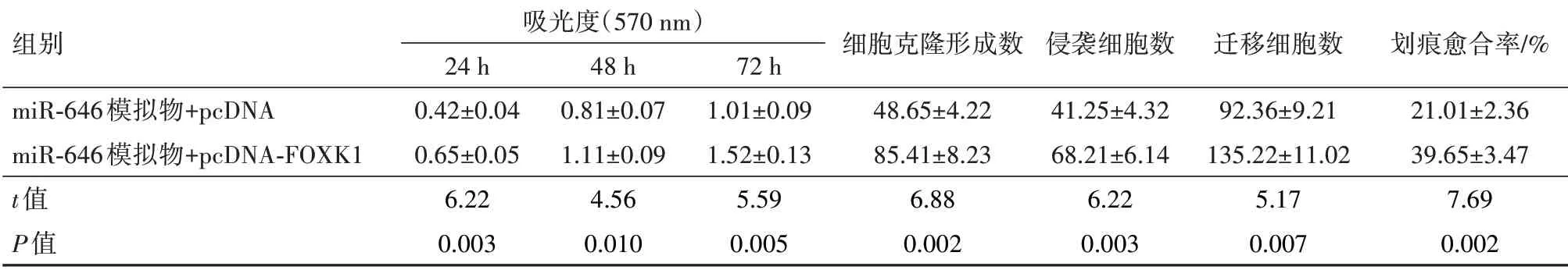
表5 FOXK1过表达逆转了miR-646过表达对U251细胞增殖和转移的作用∕xˉ±s
3 讨论
目前,胶质母细胞瘤的治疗仍以手术切除和放化疗为主,但由于肿瘤内和肿瘤间异质性的存在,使其治疗易产生药物抗性和复发;鉴于中枢神经系统的复杂性和肿瘤细胞的高侵袭性,有效的治疗方案是一直是胶质母细胞瘤临床治疗的重要需求[10]。miRNAs是内源性非编码RNA,影响多数生物学过程,如细胞增殖、转移等,与胶质母细胞瘤发生发展密切相关[11-12],而寻找和确认能够改善胶质母细胞瘤恶性进展的miRNA对其治疗具有重要意义。
miR-646是miRNAs中重要一员,被证实与肿瘤的发生发展密切相关。胃癌组织中miR-646的表达与邻近的正常组织相比明显下调,且低表达的miR-646与胃癌的恶性程度密切相关;上调其表达不仅可抑制肿瘤细胞的生长和迁移,还可抑制TGF-β1诱导的上皮间质转化[7]。在骨肉瘤发病机制的研究中发现,miR-646可通过靶向调控表皮生长因子受体抑制U2OS细胞增殖和迁移[13]。另外,miR-646高表达可还调控EGFR∕Akt通路抑制肺癌A549细胞增殖扩散[14]。之后,miR-646还在肝癌[15]和子宫内膜癌[16]等肿瘤中有报道。目前,关于miR-646是否参与胶质母细胞瘤的发病机制并不清楚。本研究体外细胞实验结果显示,上调miR-646表达减弱胶质母细胞瘤U251细胞增殖、克隆形成、侵袭、迁移能力并延缓上皮间质转化进程;而下调miR-646表达则表现出相反作用。提示,miR-646可抑制U251细胞的恶性行为,在胶质母细胞瘤发生发展过程中发挥着重要的抑癌作用。
Fox基因家族是细胞内重要的转录因子,在肿瘤发生发展过程中发挥着重要作用[17-18]。FOXK1是FOX家族成员,在多种肿瘤中异常高表达,参与细胞增殖、上皮间质转化、浸润和转移,如胃癌、食管癌和肝癌[19-21]。已有研究证实,FOXK1在胶质母细胞瘤组织和细胞中异常高表达,且可通过增强S期细胞群促进细胞增殖,激活Snail转录加快细胞上皮间充质转化和转移[22]。另外,有研究指出在胃癌中miR-646可通过靶向调控FOXK1抑制癌细胞增殖和转移[23]。由此可见,FOXK1在胶质瘤等肿瘤中充当癌基因,促进癌症进展。在本研究中,FOXK1被预测是miR-646的潜在靶基因,双萤光素酶实验证实miR-646与FOXK1 3’UTR存在靶向调控关系;蛋白质印迹法结果显示,miR-646过表达可降低FOXK1蛋白水平,而敲低miR-646则有相反作用,进一步证实了FOXK1是miR-646靶基因。为了进一步探索靶向FOXK1是否是miR-646调控胶质瘤发生发展的重要途径,本研究在胶质瘤U251细胞中同时转染miR-646模拟物和FOXK1过表达质粒pcDNAFOXK1,结果显示,FOXK1过表达可明显减弱miR-646过表达对U251细胞恶性进展的影响。这些结果提示,miR-646可能通过靶向调控FOXK1表达介导细胞增殖和转移。
综上所述,miR-646过表达可能通过靶向负调控FOXK1表达抑制U251细胞增殖和转移。本研究仅从单种胶质母细胞瘤细胞系和细胞水平上初步阐述了miR-646的作用,还需在多种肿瘤细胞系和动物水平上进一步验证;同时miR-646抑制胶质母细胞瘤发生发展的分子机制十分复杂,还有待进一步深入研究。
(本文图1~3,6见插图1-6)
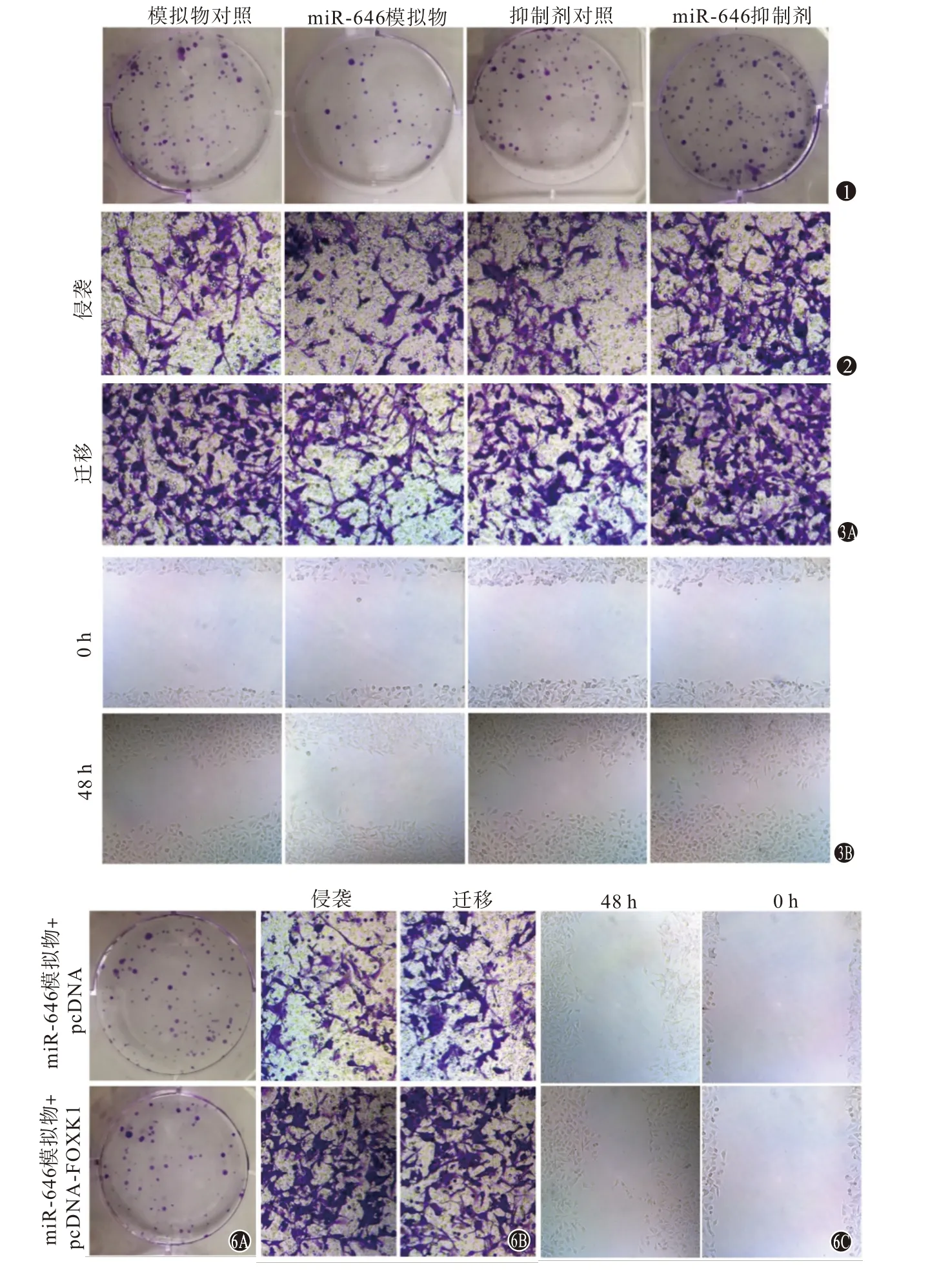
图1 各组细胞的克隆形成(结晶紫染色×10) 图2 各组U251细胞的侵袭(结晶紫染色×200) 图3 各组U251细胞的迁移:3A为Transwell小室实验(结晶紫染色×200);3B为划痕实验(×100)图6 FOXK1过表达逆转了miR-646过表达对U251细胞增殖和转移的作用:6A为细胞克隆形成实验(结晶紫染色×10);6B为Transwell小室实验(结晶紫染色×200);6C为划痕实验(×100)

