孕妇外周血微小RNA异常表达谱的鉴定及对妊娠期糖尿病的诊断价值研究
钟新丽,何秋,朱红霞
在过去的20年里,妊娠期糖尿病(gestational diabetes mellitus,GDM)在中国人口中的发病率已经上升至17.5%~18.9%,成为一个重要的公共卫生问题[1]。GDM会对胎儿及其母亲造成长期的健康损伤[2],据报道,患有GDM的孕妇易患先兆子痫,高达70%的GDM妇女会在分娩后发生2型糖尿病和心血管疾病[3]。GDM的发病机制复杂且未完全阐明[4]。最近的研究表明,孕妇外周血中miRNAs的异常表达与GDM的发生有关,但关于特异性miRNAs种类尚未达成一致[5]。miRNAs既存在于细胞质中,也存在于细胞外基质中[6]。虽然外周血miRNAs的确切效应尚不清楚,但有研究者发现,胎盘分泌miRNAs前体进入外周血液,由于miRNAs在体液中高度稳定,因此,外周血miRNAs可作为多种疾病的候选生物标志物[7]。目前,GDM的诊断依赖于口服葡萄糖耐量试验(OGTT),但此项检查流程较多,需要禁食和多次抽血,恶心和呕吐等不良反应也会导致病人依从性下降[8]。因此,寻找新的GDM生物标志物,可能为GDM的早期诊断和辅助诊断提供线索[9]。在本研究中,我们鉴定了GDM病人外周血中差异表达的miRNAs,评估验证了miRNAs的靶基因与代谢途径和生物学过程之间的相关性。
1 资料与方法
1.1 一般资料选择2018年1月至2020年2月成都市双流区第一人民医院收治的62例妊娠晚期(妊娠26~40周)糖尿病病人为研究对象(GDM组)。纳入标准:(1)年龄范围24~40岁。(2)单胎妊娠。(3)均经OGTT试验确诊为GDM。(4)首次妊娠。(5)孕妇及其近亲属对本研究知情同意。排除标准:(1)孕前糖尿病、高血压病人。(2)多胎妊娠。(3)合并先兆早产、早产、胎儿生长受限、前置胎盘和其他妊娠相关并发症。(4)临床资料不完全。同时,选择同期我院收治的年龄匹配、糖耐量正常的62例孕妇为糖耐量正常(NGT)组。GDM组给予饮食和运动疗法,血糖高于目标值者,皮下注射胰岛素,直至血糖恢复正常,血糖控制目标为空腹血糖<5.3 mmol∕L,餐后1 h血糖<7.8 mmol∕L,餐后2 h血糖<6.7 mmol∕L。所有孕妇均抽取静脉血5 mL,轻轻将全血滴入洁净的EP管,4℃下静置4 h。在4 000 g、4℃条件下离心10 min,上层为淡黄色血清,吸出上清后再在1 500 g、4℃条件下离心10 min,以最大程度保证血清质量,分装血清,冻存于-80℃冰箱。所有收获的血液样品均在-80℃下超低温保存。本研究使用的临床资料来自门诊和住院病历。本研究符合《世界医学协会赫尔辛基宣言》相关要求,病人或近亲属对研究方案签署知情同意书。
1.2 最新高通量测序检测使用NanoPhotometer®分光光度计、Qubit®2.0荧光光度计和Agilent 2100 RNA Nano 6000分析试剂盒从 等GDM组 和NGT组孕妇外周血中提取总RNA。使用NextSeq测序平台上的SE50测序程序对合格的DNA文库进行测序,以获得高质量的序列读数。通过Bowtie对数据进行清理并与参考基因组进行比对,并使用miRDeep2软件鉴定miRNAs。DESeq分析得到差异表达的miRNAs,筛选标准为Q<0.05,|log2foldYchange|>1。
1.3 RNA提取及RT-PCR检测根据制造商的说明,提取总外周血RNA。互补脱氧核糖核酸是用MMul V逆 转 录 酶 在 凸 环miRNA-144∕125b∕543∕15b∕451∕U6 miRNA RT引物(中国广东广州RiboBio)的作用下合成的。定量聚合酶链反应(QPCR)使用SYBR试剂在CFX96实时PCR检测系统上进行,PCR反应重复三次。PCR反应条件为95℃变性20 s,然后95℃变性10 s,60℃变性20 s,70℃变性10 s,共40个循环。用U6对qPCR数据进行归一化处理。
1.4 统计学方法使用SPSS 22.0软件包和Weka 3.6数据挖掘软件包进行统计分析。计量资料采用单样本Kolmogorov-Smirnov法检验数据是否符合正态性,正态分布的数据用±s表示,采用t检验。计数资料用例数表示,采用χ2检验。采用逐步logistic回归多因素分析筛选孕期血糖水平升高的因素。P<0.05认为差异有统计学意义。
2 结果
2.1 妊娠期糖尿病病人外周血中miRNAs的差异表达与NGT组相比,GDM组孕妇外周血共检测到157个差异表达的miRNAs,其中114个上调,43个下调(图1a)。层级聚类(图1b)显示GDM组与NGT组的miRNA图谱明显不同,其中8个miRNAs显著上调,6个miRNAs下调(P<0.05)。
2.2 妊娠期糖尿病和非妊娠期糖尿病病人外周血中差异表达miRNAs的验证利用qPCR验证在外周血中高表达且最可能与能量代谢相关的差异表达的miRNAs。选取5个miRNAs,即miRNA125b、miRNA-543、miRNA-144、miRNA-15b和miRNA-451在GDM组和NGT组孕妇外周血组织中进行qPCR验证。qPCR结果显 示,NGT组、GDM组miRNA-125b的相对表达水平分别为5.83±1.31、1.34±0.30(t=26.31,P<0.001),miRNA-543的相对表达水平分别为0.93±0.21、0.22±0.06(t=25.60,P<0.001),miRNA-144的相对表达水平分别为0.42±0.19、1.32±0.28(t=20.94,P<0.001),miRNA-125b、miRNA-543和miRNA-144的表达水平与最新高通量测序结果一致(P<0.05)。两组间miRNA-15b和miRNA-451的表达水平差异无统计学意义。
2.3 miRNA-125b和miRNA-144在外周血中的表达应用qPCR技术检测GDM组和NGT组孕妇血浆中miRNA-144和miRNA-125b的表达水平。糖化血红蛋白(HbA1c)和血糖水平,在所有三个时间点,GDM组均显著高于NGT组(P=0.499)。与NGT组相比,GDM组孕前体质量明显增加,体质量指数(BMI)、分娩前舒张压、血小板水平明显升高。与非妊娠期糖尿病孕妇相比,妊娠期糖尿病孕妇外周血中miRNA-125b表达下调(P<0.001),miRNA-144表达上调(P<0.001)。表1。
表1 两组孕妇临床特征比较
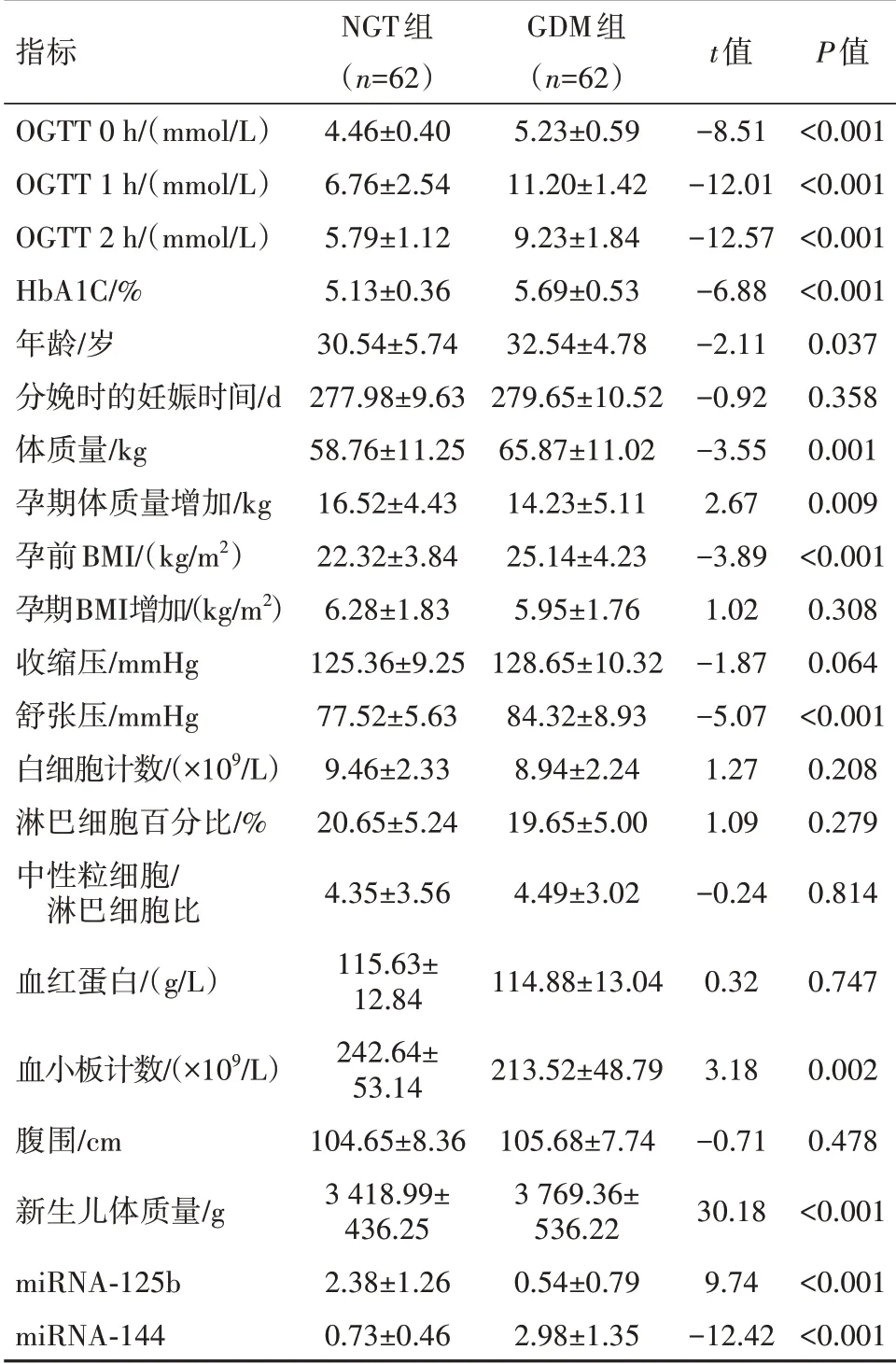
表1 两组孕妇临床特征比较
注:OGTT为口服葡萄糖耐量试验,HbA1c为糖化血红蛋白,BMI为体质量指数。
指标OGTT 0 h∕(mmol∕L)OGTT 1 h∕(mmol∕L)OGTT 2 h∕(mmol∕L)HbA1C∕%年龄∕岁分娩时的妊娠时间∕d体质量∕kg孕期体质量增加∕kg孕前BMI∕(kg∕m2)孕期BMI增加∕(kg∕m2)收缩压∕mmHg舒张压∕mmHg白细胞计数∕(×109∕L)淋巴细胞百分比∕%中性粒细胞∕淋巴细胞比血红蛋白∕(g∕L)血小板计数∕(×109∕L)腹围∕cm新生儿体质量∕g miRNA-125b miRNA-144 NGT组(n=62)4.46±0.40 6.76±2.54 5.79±1.12 5.13±0.36 30.54±5.74 277.98±9.63 58.76±11.25 16.52±4.43 22.32±3.84 6.28±1.83 125.36±9.25 77.52±5.63 9.46±2.33 20.65±5.24 4.35±3.56 115.63±12.84 242.64±53.14 104.65±8.36 3 418.99±436.25 2.38±1.26 0.73±0.46 GDM组(n=62)5.23±0.59 11.20±1.42 9.23±1.84 5.69±0.53 32.54±4.78 279.65±10.52 65.87±11.02 14.23±5.11 25.14±4.23 5.95±1.76 128.65±10.32 84.32±8.93 8.94±2.24 19.65±5.00 4.49±3.02 114.88±13.04 213.52±48.79 105.68±7.74 3 769.36±536.22 0.54±0.79 2.98±1.35 t值-8.51-12.01-12.57-6.88-2.11-0.92-3.55 2.67-3.89 1.02-1.87-5.07 1.27 1.09-0.24 0.32 3.18-0.71 30.18 9.74-12.42 P值<0.001<0.001<0.001<0.001 0.037 0.358 0.001 0.009<0.001 0.308 0.064<0.001 0.208 0.279 0.814 0.747 0.002 0.478<0.001<0.001<0.001
2.4 miRNA-144、miRNA-125b与临床参数的相关性在妊娠期间(r=-0.33,P=0.018)和分娩前(r=-0.29,P=0.039),miRNA144的表达与BMI呈负相关,而与血小板数量(r=0.31,P=0.028)和餐后1 h血糖水平呈正相关(r=0.28、P=0.044)。miRNA-125b与妊娠期糖尿病呈负相关(r=-0.91,P<0.001),而miRNA-144和孕前BMI与妊娠期糖尿病呈正相关(r=0.89、0.30,P<0.001,P=0.033)。图2。
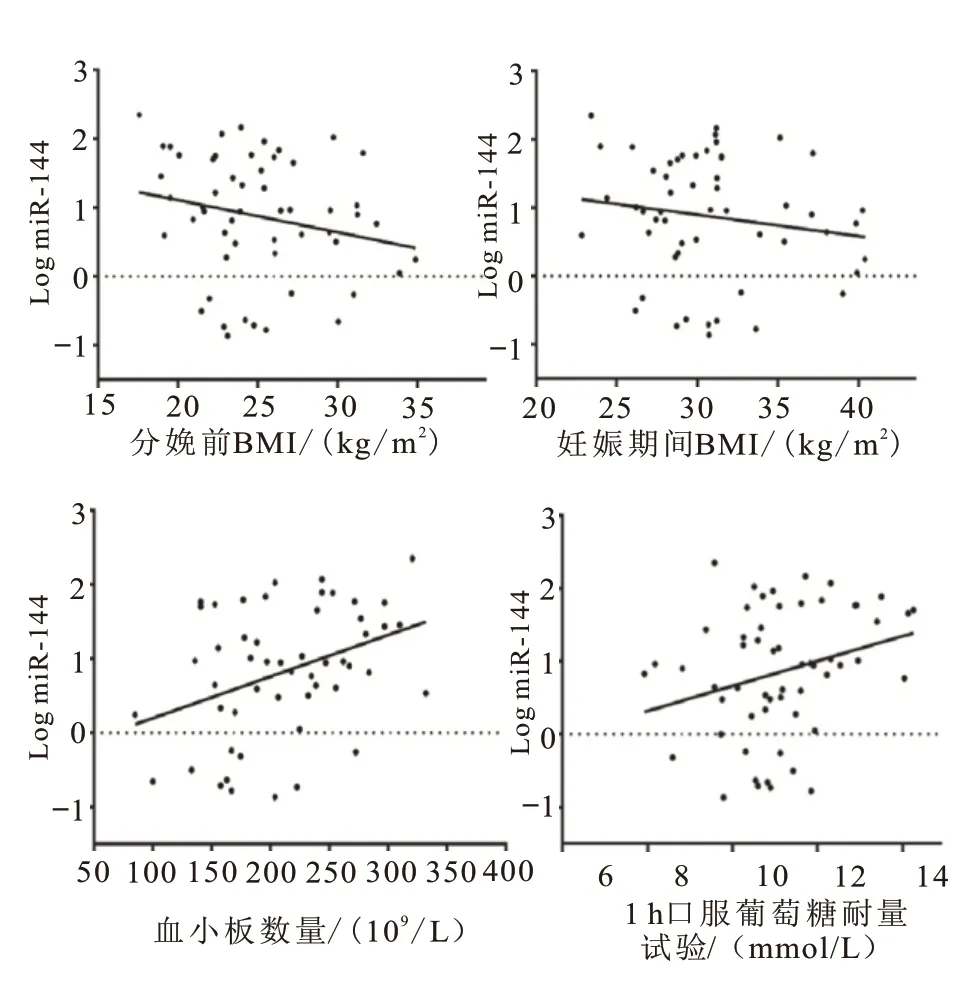
图2 miRNA-144、miRNA-125b与妊娠期糖尿病临床参数的相关性
2.5 影响GDM发病的危险因素分析多因素分析结果显示,miRNA-125b、miRNA-144和孕前BMI是影 响GDM发 病 的 独 立 性 危 险 因 素(P<0.05)。见表2。
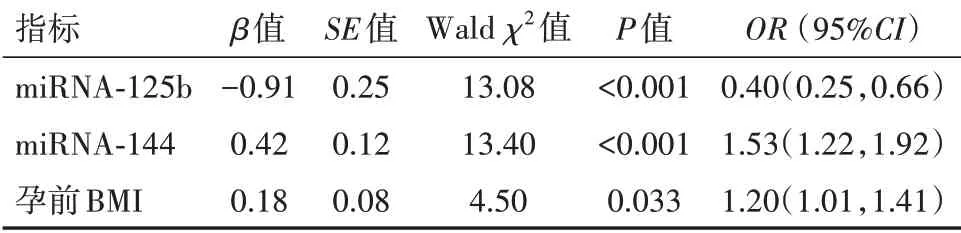
表2 影响妊娠期糖尿病发生的危险因素分析
3 讨论
在本研究中,我们发现miRNA-125b和miRNA-144在外周血大量表达,且二者是影响GDM发病的独立性危险因素。GDM孕妇外周血中miRNA-125b和miRNA-144明显改变,可作为妊娠期糖尿病的潜在生物标志物。此外,与研究报告一致的是,BMI高的肥胖女性患妊娠期糖尿病的风险明显更高,孕前BMI是一个容易测量的临床因素,与妊娠期糖尿病的发病率呈正相关[10]。
miRNA-125b是miRNA-125家族的成员。miRNA-125不是孕妇外周血特异性miRNA,胰腺和中枢神经细胞中的β细胞也分泌miRNA-125[11]。有研究表明,妊娠期miRNA-125水平明显升高。在本研究中,我们还发现miRNA-125b在外周血中高表达。然而,研究发现妊娠晚期GDM病人血清miRNA-125水平无明显差异,这与本研究结果不一致。这可能是由于病人特征、实验方法和组织的不同造成的。有研究者发现,与健康人相比,2型糖尿病病人和肥胖男性病人外周血中miRNA-125b的水平显著降低,这与本研究的结果一致,其中,我们发现miRNA-125b的表达下降与GDM发病显著相关[12]。最近的研究表明,miRNA-125b的低表达可能通过增加c-maf转录本的表达而促进高血糖[13],并抑制人去乙酰化酶Sirtuin-7的表达。研究结果提示,miRNA-125b的低水平表达与糖代谢异常有关。本研究的靶基因功能富集分析结果表明,miRNA-125b可能通过能量代谢途径影响血糖代谢。
以往的研究发现,miRNA-144在糖尿病病人血液中表达上调,并且在1型、2型糖尿病和妊娠期糖尿病病人中表达失调[14]。我们的研究还表明,在妊娠晚期,妊娠期糖尿病病人血浆外切体中miRNA-144的表达显著增加。miRNA-144直接靶向胰岛素受体底物1(insulin receptor substrate,IRS1)和葡萄糖转运体(glucose Transporters,GLUT)[15]。IRS1高度参与胰岛素信号转导通路,GLUT也可能调节葡萄糖代谢[16]。然而,基于同一队列的两项研究表明miRNA-144与血糖水平呈负相关。有研究者发现妊娠期糖尿病病人胎盘绒毛分泌的外体miRNA-144表达降低[17]。此外,尽管妊娠期糖尿病组孕妇在怀孕前和分娩前表现出更高的miRNA-144和BMI水平,但在本研究中,这两个参数与妊娠期糖尿病的发病率呈显著负相关。miRNA-144的异常表达与糖脂代谢密切相关,但从现有文献中得出的结论是相互矛盾的,可能是由于种族、性别、实验方法和样本量的差异[18]。能量代谢与年龄、性别、BMI和不同的身体组织有关,因此其作用机制往往非常复杂[19]。miRNA-144在妊娠期糖尿病发病机制中的作用机制尚需进一步研究。
综上所述,本研究发现了新的妊娠期糖尿病生物标志物,为妊娠期糖尿病的诊断方法和发病机制的研究提供了新的思路。但也存在一定的缺陷:(1)缺少随访研究来证实miRNA-125b和miRNA-144对妊娠早期和中期妊娠期糖尿病发病率的预测价值;(2)本研究采用病例对照研究方法,但由于妊娠期糖尿病的影响,两组孕妇在体质量、BMI等基线资料方面不可避免地存在一定的差异;(3)样本量较少,且来自于单中心,可能存在一定的样本偏倚。
(本文图1见插图1-4)

