微小RNA-K1-5p调控G1/S期相关基因的表达影响内皮细胞周期
张静,彭靖淇
卡波西肉瘤(Kaposi's sarcoma,KS)是由KS相 关疱疹病毒(KSHV)感染内皮细胞发生的梭形细胞肿瘤[1]。多见于人类免疫缺陷病毒相关的免疫缺陷综合征(HIV-AIDS)或免疫缺陷病人[2-4]。近年来,miRNA在医学领域引起关注[5-8],通过与mRNA的3'-非翻译区(3'UTR)结合,降解或沉默靶基因的表达[9-12],并通过复杂机制在各种细胞过程中发挥重要作用[13-17]。之前的研究显示KSHV编码的13个miRNA,在KS中都显著上调,其中与细胞周期密切相关的miR-K1-5p上调最为明显[18-19]。G1∕S关卡是细胞周期最重要的检查点,细胞周期素依赖性激酶抑制剂4(CDKN4)、细胞周期蛋白A∕细胞周期素依赖性激酶2(Cyclin A∕CDK2)、细胞周期蛋白D2∕细胞周期素依赖性激酶4(Cyclin D2∕CDK4)均是G1∕S期调控的主要基因。自从KS细胞株(SLK)被证实为肾癌细胞来源后,便缺乏了可信赖的细胞株[20],但是对于KSHV致瘤作用的研究,目前公认的模型是将KSHV的基因组或miRNA转染人脐静脉内皮细胞(HUVECs)后进行基因表型检测[21-24]。本研究将miR-K1-5p转 染HUVECs,探 讨miR-K1-5p对CDKN4、Cyclin A∕CDK2和Cyclin D2∕CDK4的调控作用及其对内皮细胞周期的影响。本研究进行于2020年1—12月。
1 材料与方法
1.1 细胞株和主要试剂人脐静脉内皮细胞(HUVECs,美国ScienCell生物公司);RIPA裂解液(上海碧云天生物技术有限公司);293T细胞(上海玉博生物科技有限公司);Lipofectamine 2000(美国Invitrogen公司);miR-K1-5p模拟物(mimics)、mimics阴性对照∕NC(武汉艾斯莱德生物科技有限公司);双萤光素酶报告系统(上海碧云天生物技术有限公司);Trizol(美国Ambion公司);miScriptSYBR Green PCR Kit试剂盒(美国VAZYME公司);细胞周期分析试剂盒(南京凯基生物科技有限公司);CDKN4、Cyclin A∕CDK2和Cyclin D2∕CDK4(美国BOSTER公司);GAPDH(杭州贤至生物有限公司)。
1.2 细胞培养与转染使用密度为80%,对数生长期的HUVECs(此细胞株广泛用于KS的研究[21-24]),以每孔1×105个细胞接种于6孔培养板中,培养24 h。设立两组:miR-K1-5p mimics组和mimics NC组,使用Lipofectamine 2000将它们分别转染到HUVECs中,转染时间为48 h。
1.3 miR-K1-5p靶基因预测使用TargetScanHuman Custom 5.2和miRDB的生物信息学软件预测miR-K1-5p的靶基因及靶基因3'UTR中的结合位点。
1.4 双萤光素酶试验将野生型(WT)和突变型(MUT)CDKN4 3'UTR构建到双萤光素酶报告载体(pYr-miRTarget)质粒上,将质粒(1 μg)和miR-K1-5p mimics、mimics NC(50 nmol∕L)共转染到293T细胞5×104,Lipofectamine 2000转染24 h后,使用双萤光素酶报告系统分析。
1.5 蛋白质印迹法检测转染48 h后,使用RIPA裂解液从细胞中提取总蛋白。根据蛋白质含量绘制标准曲线。制备5%层浓缩胶和12%分离凝胶。进行电泳,结束后将蛋白质转移到膜上,用5%脱脂奶粉封闭膜2 h,一抗CDKN4、Cyclin D2、CDK2、CDK4均稀释(1∶1 000)、Cyclin A稀释(1∶500)、GAPDH稀释(1∶1 000)在4℃下孵育过夜,HRP二抗稀释(1∶10 000)在37℃下孵育2 h;而后增强化学发光成像;灰度值分析。
1.6 q-PCR检测转染48 h后,从细胞中提取总RNA(需1mL Trizol)。使 用miScriptSYBR Green PCR Kit试剂盒定量mRNA和miRNA表达水平。PCR反应条件为:在95℃下预变性10 min,在95℃下15 s,在60℃下60 s进行40个周期。采用2-ΔΔCt相对定量法进行数据分析。其中U6为miRNA内参引物;GADPH为mRNA内参引物,引物序列见表1。
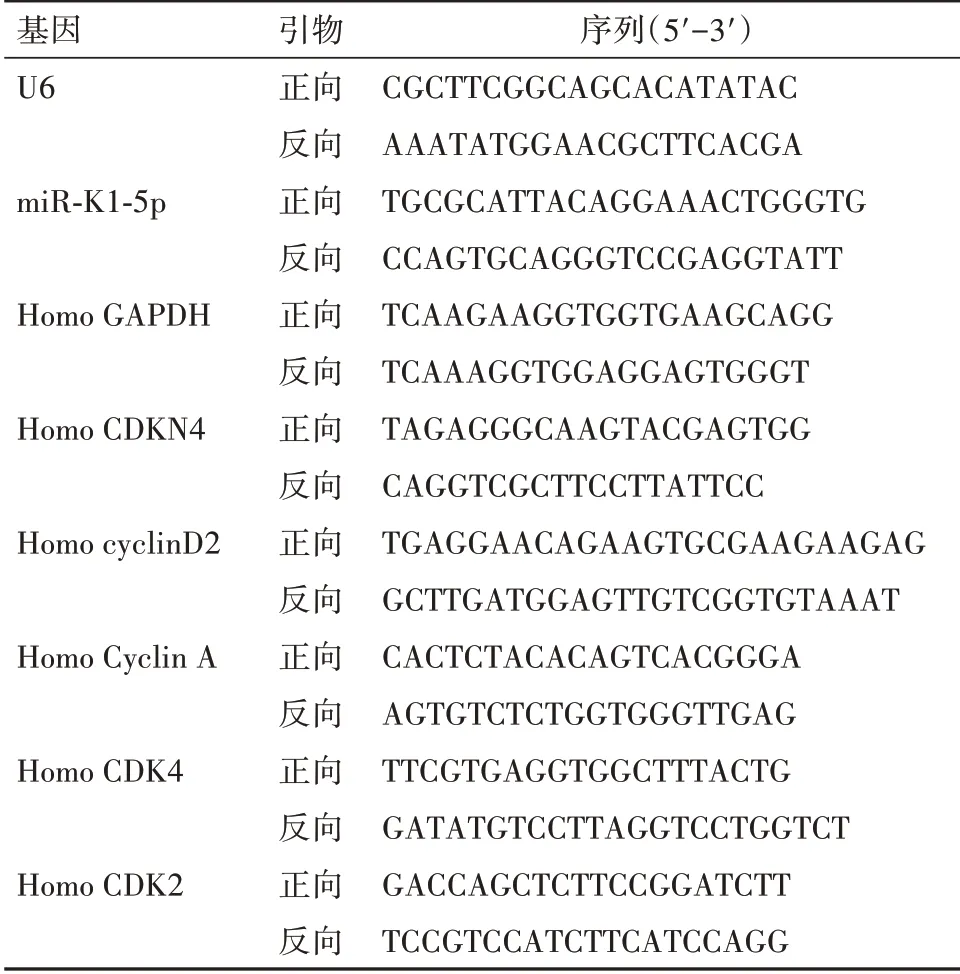
表1 引物序列
1.7 细胞周期分析miR-K1-5p mimics、mimics NC分别转染HUVECs细胞中,48 h后收获1×105细胞,用200 μL细胞液离心5 min,用PBS洗涤细胞2次,使用细胞周期分析试剂盒检测:向细胞中添加RNase A溶液(20 μL),使用PI染料溶液(400 μL),最后使用流式细胞仪进行分析。
1.8 统计学方法SPSS 20.0软件用于统计分析,数据经过正态性检验及方差齐性检验。正态分布的计量数据以±s表示。t检验用于单变量两组资料之间的比较。P<0.05认为差异有统计学意义。
2 结果
2.1 miR-K1-5p的表达水平miR-K1-5p mimics和mimics NC转染HUVECs细胞。48 h后,q-PCR结果显示miR-K1-5p mimics组表达水平0.91±0.08明显高于mimics NC组表达水平0.00±0.00(t=19.54,P<0.001),40个循环未检测出∕低于检测下限。
2.2 miR-K1-5p靶基因的预测靶基因的预测结果:TargetScan Human Custom显示有637个靶基因,miRDB显示有1 102个靶基因,取交集显示有354个靶基因。miR-K1-5p靶基因的功能主要富集在细胞周期、调节转录、表达调控等。其中靶基因CDKN4与细胞周期的调控密切相关。图1示CDKN4 3'UTR与miR-K1-5p的结合位点。
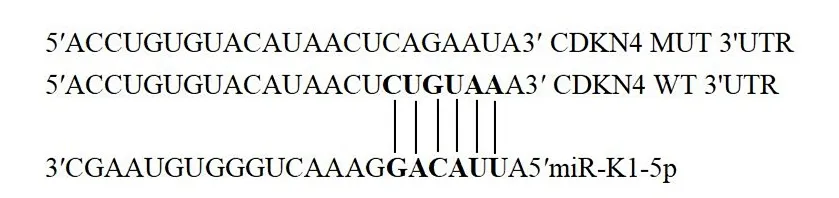
图1 CDKN4 3'UTR与miR-K1-5p的结合位点
2.3 miR-K1-5p靶向CDKN4基因将miR-K1-5p mimics+CDKN4-WT、mimics NC+CDKN4-WT、miRK1-5p mimics+CDKN4-MUT和mimics NC+CDKN4-MUT分别转染293T细胞。24 h后测定各组萤光素酶活性,miR-K1-5p mimics+CDKN4-WT组明显低于其余组的萤光素酶活性(P<0.01);转染miR-K1-5p mimics后,CDKN4蛋 白∕mRNA表 达 水 平 均 低 于mimics NC组(P<0.01)。因此,CDKN4是miR-K1-5p直接作用的靶基因。miR-K1-5p可以负性调控CDKN4的表达。见表2。
表2 相对萤光素酶活性、CDKN4蛋白及mRNA相对表达比较±s
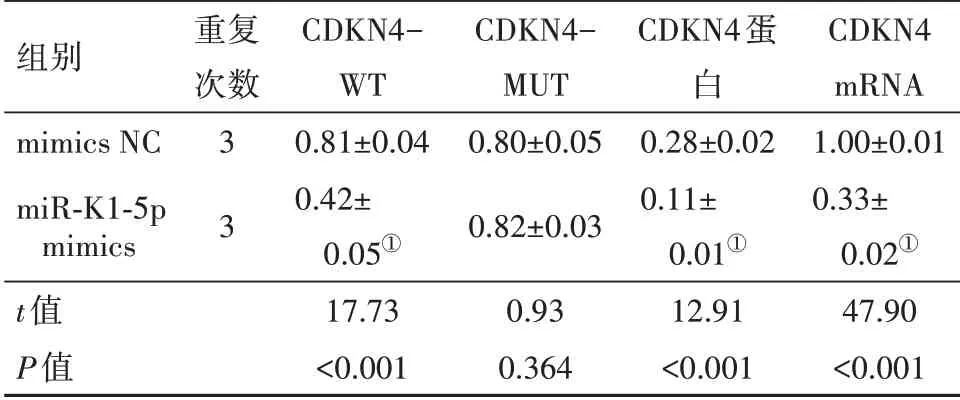
表2 相对萤光素酶活性、CDKN4蛋白及mRNA相对表达比较±s
注:miR-K1-5p mimics为miR-K1-5p模拟物,mimics NC为模拟物阴性对照,CDKN4-WT为细胞周期素依赖性激酶抑制剂4野生型萤光素酶载体,CDKN4-MUT为细胞周期素依赖性激酶抑制剂4突变型萤光素酶载体。①与mimics NC组相比,P<0.01。
组别mimics NC miR-K1-5p mimics t值P值重复次数3 3 CDKN4-WT 0.81±0.04 0.42±0.05①17.73<0.001 CDKN4-MUT 0.80±0.05 0.82±0.03 0.93 0.364 CDKN4蛋白0.28±0.02 0.11±0.01①12.91<0.001 CDKN4 mRNA 1.00±0.01 0.33±0.02①47.90<0.001
2.4 转染后Cyclin A/CDK2蛋白及mRNA的相对表达量转染48 h后结果显示:与mimics NC组相比,miR-K1-5p过表达显著增加Cyclin A∕CDK2蛋白和mRNA的表达水平(P<0.01)。因此,miR-K1-5p可以正性调控Cyclin A∕CDK2的表达。见表3。
实验二的词汇测试结束后,要求两组学生如实填写查阅了哪些单词,用以确定各组查阅目标词的人次,结果表明,两组学生不同程度地查阅了目标词的用法。统计结果如下:
表3 Cyclin A/CDK2蛋白及mRNA相对表达量比较

表3 Cyclin A/CDK2蛋白及mRNA相对表达量比较
注:mimics为模拟物,mimics NC为模拟物阴性对照,Cyclin A为细胞周期蛋白A,CDK2为细胞周期素依赖性激酶2。①与mimics NC组,P<0.01。
组别mimics NC mimics t值P值重复次数3 3 Cyclin A蛋白0.05±0.01 0.13±0.01①10.61<0.001 CDK2蛋白0.21±0.02 0.65±0.04①16.50<0.001 Cyclin A mRNA 0.99±0.08 2.94±0.13①22.66<0.001 CDK2 mRNA 1.02±0.09 1.96±0.3①5.02 0.007
2.5 转染后Cyclin D2/CKD4蛋白及mRNA的相对表达量转染48 h后,行蛋白质印迹法和q-PCR检测Cyclin D2∕CDK4蛋白和mRNA的表达水平。结果显示,与mimics NC相比,miR-K1-5p mimics显著增加了Cyclin D2∕CDK4蛋白和mRNA表达水平(P<0.05)。因此,miR-K1-5p可以正性调控Cyclin D2∕CDK4的表达。见表4。
表4 Cyclin D2/CDK4蛋白及mRNA相对表达量比较
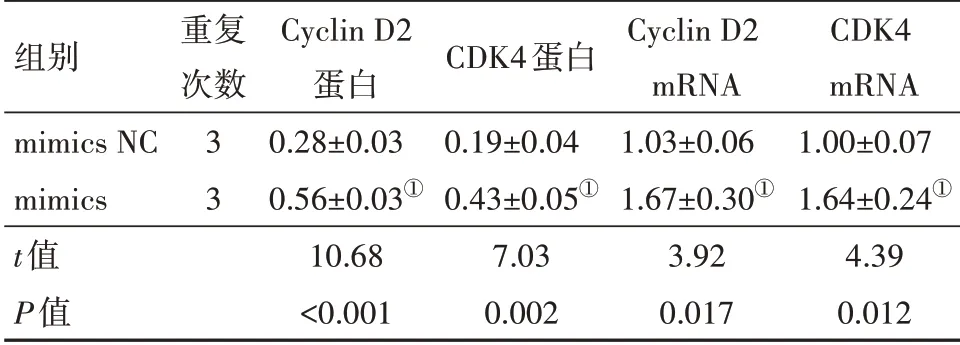
表4 Cyclin D2/CDK4蛋白及mRNA相对表达量比较
注:mimics为模拟物,mimics NC为模拟物阴性对照,Cyclin D2为细胞周期蛋白D2,CDK4为细胞周期素依赖性激酶4。①与mimics NC组,P<0.01。
组别mimics NC mimics t值P值重复次数3 3 Cyclin D2蛋白0.28±0.03 0.56±0.03①10.68<0.001 CDK4蛋白0.19±0.04 0.43±0.05①7.03 0.002 Cyclin D2 mRNA 1.03±0.06 1.67±0.30①3.92 0.017 CDK4 mRNA 1.00±0.07 1.64±0.24①4.39 0.012
2.6 CDKN4、Cyclin A、Cyclin D2、CDK、CDK4的western blotting电泳图蛋白质印迹法检测结果示:mimics组CDKN4的蛋白表达水平低于mimics NC组;mimics组Cyclin A、Cyclin D2、CDK、CDK4的蛋白表达水平高于mimics NC组。见图2。

图2 CDKN4∕Cyclin A∕CDK2∕Cyclin D2∕CDK4蛋白质印迹电泳图
2.7 miR-K1-5p对细胞周期的影响转染后显示mimics组的PI值(PI=S+G2期∕G1+S+G2期;PI为增殖活性指数,PI值越大,细胞周期变短、增殖变快)及S期、G2期比值均高于mimics NC组(P<0.05);mimics组的G1期比值低于mimics NC组(P<0.01),见表5;细胞周期流式图见图3,因此,miR-K1-5p可以使细胞周期进展加速,促进细胞增殖和G1∕S期转换。
表5 转染后对HUVECs细胞周期影响比较/(%
表5 转染后对HUVECs细胞周期影响比较/(%
注:HUVECs为人脐静脉内皮细胞,mimics为模拟物,mimics NC为模拟物阴性对照。
组别mimics mimics NC 3 t值p值重复次数3 S+G2期∕G1+S+G2期23.37±0.29 15.00±0.75 18.03<0.001 G1期76.63±0.28 85.00±0.76 17.96<0.001 S期15.34±0.36 8.45±0.20 28.86<0.001 G2期8.02±0.17 6.55±0.80 3.11 0.04
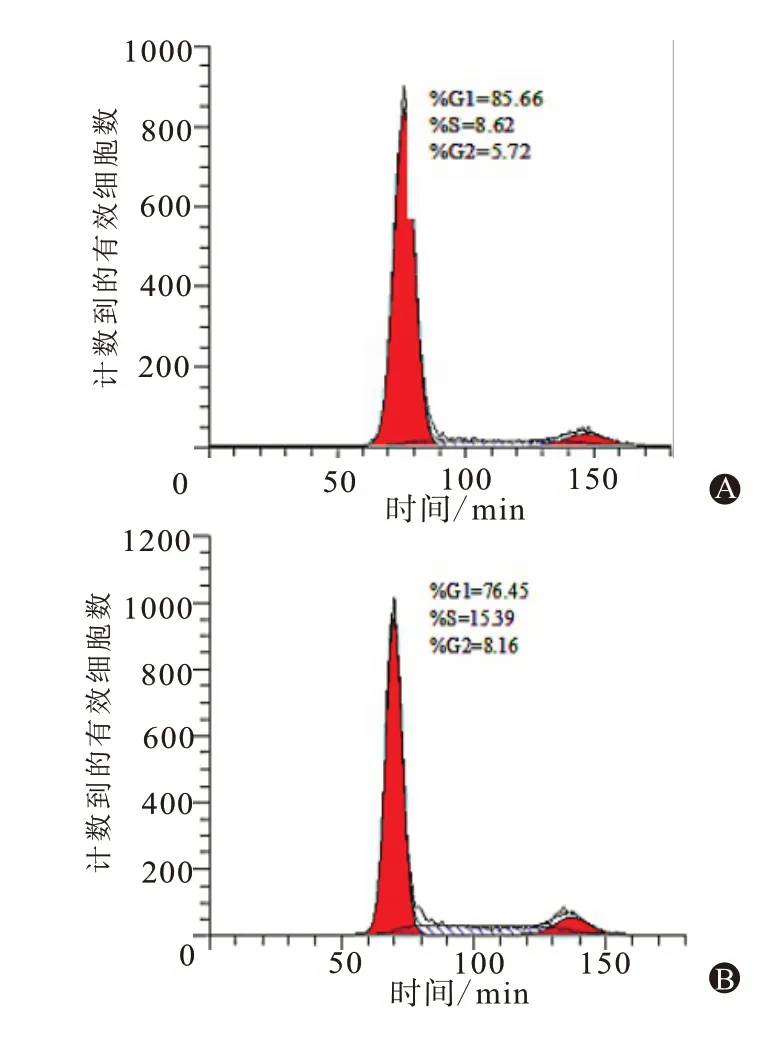
图3 转染后人脐静脉内皮细胞(HUVECs)细胞周期流式图:A为mimics NC组;B为mimics组
3 讨论
KS是一种起源于内皮细胞的血管肉瘤[25]。KSHV是7种可导致人类恶性肿瘤的病毒之一,是KS的重要致病因子[2-3]。KSHV主要通过编码miRNA对KS产生影响,KSHV miRNAs可以调节宿主细胞的分化,影响其细胞周期,最终诱导癌变发生[26-28]。研究miRNAs在KS和癌旁组织中的差异表达,结果显示69个miRNAs的表达上调;101个miRNA表达下调,特别是KSHV编码的miR-K1-5p表达上调最为显著[18]。因此高表达的miR-K1-5p可能在KS中发挥重要作用。GO和KEGG信号通路分析表明:miR-K1-5p主要参与细胞周期信号通路,通过它的靶基因介导信号通路发挥作用。CDKN4(miRK1-5p的靶基因)、Cyclin A∕CDK2、Cyclin D2∕CDK4是该通路中G1∕S期的关键基因,G1∕S关卡是细胞周期中最主要的调控点,因此研究miR-K1-5p对CDKN4、Cyclin A∕CDK2、Cyclin D2∕CDK4的调控作用具有重要意义。
细胞周期依赖于精准调控。调控体系中细胞周期蛋白依赖性激酶抑制因子CKI、细胞周期蛋白依赖性激酶CDK、细胞周期蛋白Cyclin均发挥重要作用;CDK结合Cyclin使细胞不断增殖、分裂;而CKI与Cyclin竞争结合CDK或优先结合Cyclin∕CDK复合物,发挥抑制作用。它们共同参与细胞周期的正常循环。当CKI丢失、Cyclin∕CDK表达异常、检测点发生变化,可能导致细胞周期紊乱,细胞增殖失控,肿瘤形成。CDKN4作为一种CKI因子,抑制G1期进程,负性调控Cyclin∕CDK,避免DNA错误复制。其表达减少促进瘤细胞G1∕S期转化,使大量瘤细胞进入S期,加速瘤细胞的恶性转化。Cyclin A在G1晚期表达,近年来,在许多人类肿瘤中发现Cyclin A过表达,抑制其表达,可使肿瘤细胞周期运转受阻,引起肿瘤细胞死亡,具有靶向治疗的良好前景。Cyclin D2既往研究较少,它由CCND2基因编码,由5个外显子及4个内含子构成,G1早期表达,能促进细胞增殖,在结肠癌、胃癌、乳腺癌等肿瘤中可见Cyclin D2的异常表达[29]。CDK自身不与底物反应,形成CDK∕Cyclin复合物时才能表现出活性,参与细胞周期的调控,不同细胞周期时相产生不同的Cyclin∕CDK复合物,促进时相之间的转换,CDK2和CDK4是G1-S转换的主要限速因子,形成CyclinA∕CDK2和Cyclin D2∕CDK4复合物促进G1-S转换。
本研究通过双萤光素酶试验证实CDKN4是miR-K1-5p的靶基因;miR-K1-5p对CDKN4、Cyclin A∕CDK2、Cyclin D2∕CDK4具 有 明 显 的 调 控 作 用。miR-K1-5p mimics转染HUVECs细胞后,CDKN4蛋白和mRNA表达水平均显著下调;Cyclin A∕CDK2、Cyclin D2∕CDK4蛋 白 及其mRNA表 达 水 平显 著 上调。推测miR-K1-5p作为一种KSHV miRNA,在转录后通过抑制靶基因CDKN4的表达。发挥其调控细胞周期的功能。CDKN4作为G1∕S期重要监控因子,扮演交通红灯的作用,miR-K1-5p减少CDKN4表达,使其原始功能丧失,解除或减弱了对Cyclin A∕CDK2和Cyclin D2∕CDK4的抑制,细胞增殖失控,细胞周期信号通路异常激活,从而导致肿瘤的发生。此外,本研究采用PI法研究miR-K1-5p对HUVECs细胞周期的影响。如数据所示,miR-K1-5p过表达后,G1期时长减短,S期和G2期细胞数量显著增加。因此,miR-K1-5p促进了G1∕S期转变,抑制HUVECs细胞凋亡,促进HUVECs细胞增殖。
综上,研究证实了上调miR-K1-5p的表达,减少了CDKN4表达,增加了Cyclin A和Cyclin D2的表达,提高了CDK2和CDK4的活性,使肿瘤细胞无限增殖;反之即可抑制肿瘤性的增殖。鉴于miR-K1-5p作为促癌基因对细胞周期具有显著的调控作用,它很可能成为KS的一个新的治疗靶点。

