萝卜硫素对心肌缺血再灌注损伤大鼠心肌保护作用及色氨酸-犬尿氨酸通路的影响
王帅,朱超男,邬鹏宇,崔志成,赵长全
心肌缺血再灌注损伤是心血管疾病在缺血发生后,血流恢复所引起的心肌损伤,是心血管疾病中常见的病理现象,长时间缺血后恢复血液供应时,局部炎症增加,导致继发性损伤[1-2]。长期缺血再灌注损伤引起的细胞损伤可能导致细胞凋亡、自噬、坏死。因此,研究再灌注损伤诱导的细胞死亡的具体机制,可以对其临床治疗提供新的治疗靶点。萝卜硫素(sulforaphane,SFN)又称莱菔硫素,不仅有良好的抗癌活性,对缺血再灌注诱导的心肌细胞损伤也具有保护作用,但其具体作用机制尚不完全清楚[3-4]。色氨酸(tryptophan,TRP)是一种必需氨基酸,是神经递质和其他关键的生物合成中间体,在机体代谢功能中起着至关重要的作用[5]。犬尿氨酸(kynurenine,KYN)途径是哺乳动物TRP代谢的主要途径[6],研究显示,炎性或应激因子诱导吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)可以激活TRP转化为KYN,参与心血管疾病发生过程[7],研究报道,TRP∕KYN在心肌梗死病人的自身免疫炎症反应有关,抑制TRP∕KYN表达可有效缓解心肌损伤[8]。然而关于TRP∕KYN在心肌缺血再灌注损伤中的作用研究报道较少,本研究于2019年7月至2020年6月,通过观察SFN对心肌缺血再灌注损伤大鼠心肌损伤的影响,初步探讨其可能作用机制。
1 材料与方法
1.1 实验动物SPF级雄性SD大鼠购自北京生命科学研究所动物实验中心,8周龄,体质量250 g左右,合格证号为SYXK(京)2015-0002,适应性饲养1周后,进行后续实验。本研究符合一般动物实验伦理学原则。
1.2 试剂及仪器苏木-伊红染液(上海舜百生物科技有限公司,货号SBT10001);SFN(成都格纯生物医药有限公司,货号4478-93-7)、白细胞介素(IL)-1β ELISA试剂盒(货号ml028514)、IL-6 ELISA试剂盒(货号ml102828)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试 剂 盒(货 号ml002095)均购自上海酶联生物科技公司;TUNEL试剂盒(碧云天生物技术研究所,货号C1086);兔源单克隆B细胞淋巴瘤-2相关X蛋白(Bax)抗体(货号ab32503)、兔源单克隆B细胞淋巴瘤-2(Bcl-2)抗体(货号ab692)、兔源多克隆活化胱天蛋白酶3(cleaved-capase3)抗体(货号ab214430)、兔源单克隆IDO抗体(货号ab235902)均购自abcam公司;生物显微镜(日本尼康公司,型号e200);凝胶成像系统(美国伯乐公司,型号1708280)。
1.3 实验方法
1.3.1 心肌缺血再灌注损伤大鼠模型构建及实验分组将SD雄性大鼠随机分为四组,假手术(Control)组、模型(I∕R)组、SFN低(I∕R+L SFN)、高(I∕R+H SFN)剂量组,每组10只。I∕R+L SFN、I∕R+H SFN组术前2 h自尾静脉分别注射SFN 5 mg∕kg、10 mg∕kg,Control、I∕R组注射等量生理盐水[4,9]。除Control外,其他大鼠参考文献[10]制备心肌缺血再灌注损伤模型,用10%水合氯醛溶液(4 mL∕kg)腹腔注射麻醉,大鼠四肢皮下连接心电图电极,实验全程记录Ⅱ导联心电图。打开大鼠胸腔,用0号缝合针线在冠动脉左前降支下结扎,当结扎部位以下心肌颜色变暗且心电图ST段升高,则表明心肌缺血成功,结扎30 min后,剪开缝合线再灌注2 h,缺血区域的心肌颜色变红,T波波幅开始回落、ST段下降1∕2以上,则再灌注成功。Control大鼠手术中只在左侧冠状动脉的前降支下穿线,不结扎。
1.3.2 标本采集术后24 h后,采集各组大鼠尾静脉血5 mL,1 800 r∕min离心10 min取血清,储存于-80℃冰箱待测;腹腔注射10%水合氯醛麻醉,处死大鼠,分离心肌组织,剪取约1.0 g用于提取组织蛋白,储存在-80℃冰箱中备用,剩余心肌组织用4%多聚甲醛溶液固定,做常规石蜡切片,备用。
1.3.3 各组大鼠血清中炎性因子检测取“1.3.2”中血清,用ELISA试剂盒分别检测IL-1β、IL-6、TNF-α含量,具体操作步骤参考其说明书。
1.3.4 HE染色观察各组大鼠心肌组织病理变化将“1.3.2”中常规石蜡切片,脱蜡至水化,行HE染色,每张切片选取5个视野,光学显微镜下观察心肌组织病理学改变。
1.3.5 原位末端标记技术(TUNEL)检测各组大鼠心肌细胞凋亡情况将“1.3.2”中常规石蜡切片,脱蜡至水化,PBS漂洗3次,血清封闭30 min,加TUNEL工作液,避光孵育1 h,具体操作步骤参考TUNEL试剂盒说明书进行,凋亡细胞为阳性其细胞核呈棕黄色或褐色,在荧光显微镜下观察细胞凋亡数目,用Image Pro Plus软件进行分析,每张切片选取5个视野,根据公式凋亡指数=凋亡细胞∕总细胞数×100%,记录各组大鼠心肌细胞凋亡情况。
1.3.6 检测各组大鼠心肌组织中TRP、KYN浓度取“1.3.2”中各组大鼠心肌组织0.5 g冰浴进行研磨匀浆,离心取上清液置于透析带内,加透析液,于4℃摇床透析36 h,取透析液100 μL于离心管中,离心14 000 r∕min,10 min,取上清液用0.22 μm滤膜过滤后,用高效液相色谱仪进行分析,色谱柱为Agilent TC-C18(250 mm×5 mm,5 μm),乙腈为流动相,流速1.0 mL∕min,在紫外波长为280 nm检测TRP色谱,紫外波长为360 nm检测KYN色谱,根据TRP、KYN标准曲线,计算TRP、KYN浓度及KYN∕TRP比值。
1.3.7 各组大鼠心肌组织Bax、Bcl-2、cleaved-capase3、IDO蛋白表达情况取“1.3.2”中各组大鼠心肌组织0.5 g提取蛋白,用BCA试剂盒检测蛋白浓度,取50 μg蛋白变性,进行SDS-PAGE电泳、转膜、封闭、孵育一抗(抗Bax、Bcl-2、cleaved-capase3、IDO、GAPDH抗体,1∶1 000)4℃过夜,次日加二抗(1∶5 000),室温孵育2 h,加ECL化学发光剂进行显色,用GAPDH作内参,Image J软件进行灰度分析。
1.4 统计学方法用SPSS 22.0软件进行分析,数据用±s表示,多组数据间比较采用单因素方差分析,进一步两两比较行SNK-q检验。P<0.05差异有统计学意义。
2 结果
2.1 SFN减少血清中炎性因子IL-1β、IL-6、TNF-α的生成I∕R组较Control IL-1β、IL-6、TNF-α水平显著升高(均P<0.05);I∕R+L SFN、I∕R+H SFN组较I∕R组IL-1β、IL-6、TNF-α水平显著降低,且呈剂量依赖(P<0.05)。见表1。
表1 SFN对大鼠血清中炎性因子白细胞介素(IL)-1β、IL-6、肿瘤坏死因子α(TNF-α)的影响∕(μg∕Ls)

表1 SFN对大鼠血清中炎性因子白细胞介素(IL)-1β、IL-6、肿瘤坏死因子α(TNF-α)的影响∕(μg∕Ls)
注:Control为假手术组,I∕R为模型组,I∕R+L SFN为萝卜硫素低剂量组,I∕R+H SFN为萝卜硫素高剂量组。①与Control组相比,P<0.05。②与I∕R组相比,P<0.05。③与I∕R+L SFN组相比,P<0.05。
组别Control I∕R I∕R+L SFN I∕R+H SFN F值P值鼠数10 10 10 10 IL-1β 116.84±10.05 297.32±13.12①235.13±14.24①②208.76±16.56①②③299.59<0.001 IL-6 398.76±20.31 657.34±25.17①595.16±30.02①②482.34±30.55①②③184.74<0.001 TNF-α 210.04±12.56 483.16±20.31①376.42±28.23①②287.39±27.05①②③263.48<0.001
2.2 SFN减轻对大鼠心肌组织病理症状Control大鼠心肌细胞形态结构完整,排列整齐,纤维结构排列规则;与Control相比,I∕R组大鼠心肌细胞破碎、坏死,细胞排列不规则,心肌纤维断裂,伴有炎性细胞浸润;与I∕R组相比,I∕R+L SFN、I∕R+H SFN组大鼠心肌细胞上述病理症状明显减轻。见图1。
2.3 SFN减少大鼠心肌细胞凋亡与Control相比,I∕R组大鼠心肌细胞凋亡指数显著升高(P<0.05),心肌组织Bax、IDO、cleaved-capase3蛋白水平显著升高(P<0.05),Bcl-2蛋白水平显著降低(P<0.05;图4);与I∕R组相比,I∕R+L SFN、I∕R+H SFN组大鼠心肌细胞凋亡指数依次降低(P<0.05),心肌组织Bax、cleaved-capase3、IDO蛋白水平显著降低(P<0.05),Bcl-2蛋白水平显著升高(P<0.05),见图2,3,表2。
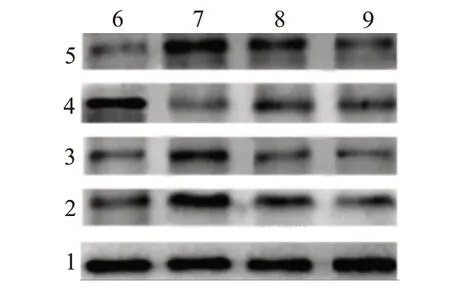
图3 各组大鼠心肌组织Bax、Bcl-2、cleaved-capase3、IDO蛋白表达
表2 SFN对大鼠心肌组织Bax、Bcl2、capase3、IDO蛋白表达的影响
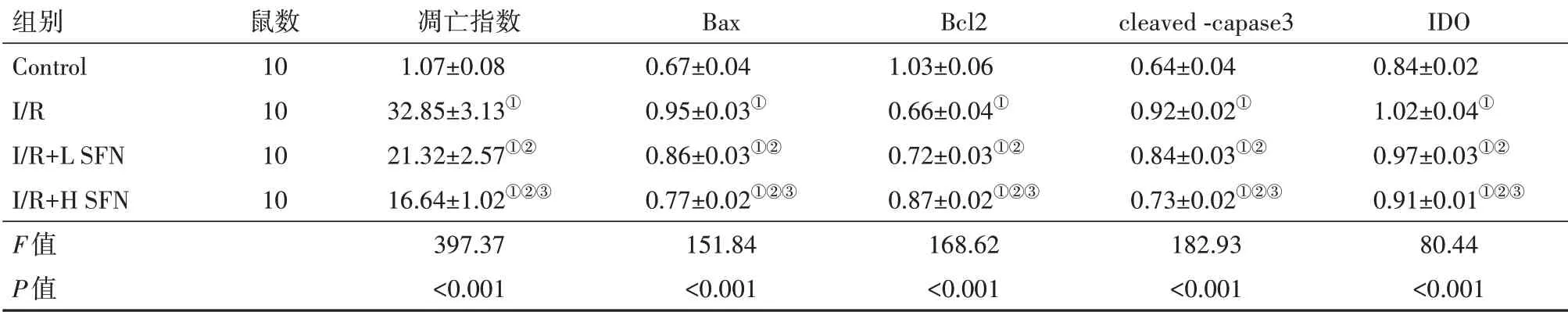
表2 SFN对大鼠心肌组织Bax、Bcl2、capase3、IDO蛋白表达的影响
注:Control为假手术组,I∕R为模型组,I∕R+L SFN为萝卜硫素低剂量组,I∕R+H SFN为萝卜硫素高剂量组,Bax为B细胞淋巴瘤-2相关X蛋白,Bcl-2为B细胞淋巴瘤-2,cleaved-capase3为活化胱天蛋白酶3,IDO为吲哚胺2,3-双加氧酶。①与Control组相比,P<0.05。②与I∕R组相比,P<0.05。③与I∕R+L SFN组相比,P<0.05。
组别Control I∕R I∕R+L SFN I∕R+H SFN F值P值鼠数10 10 10 10凋亡指数1.07±0.08 32.85±3.13①21.32±2.57①②16.64±1.02①②③397.37<0.001 Bax 0.67±0.04 0.95±0.03①0.86±0.03①②0.77±0.02①②③151.84<0.001 Bcl2 1.03±0.06 0.66±0.04①0.72±0.03①②0.87±0.02①②③168.62<0.001 cleaved-capase3 0.64±0.04 0.92±0.02①0.84±0.03①②0.73±0.02①②③182.93<0.001 IDO 0.84±0.02 1.02±0.04①0.97±0.03①②0.91±0.01①②③80.44<0.001
2.4 SFN降低大鼠心肌组织TRP、KYN表达水平与Control相比,I∕R组大鼠心肌组织TRP、KYN浓度、KYN∕TRP比值显著升高(P<0.05);与I∕R组相比,I∕R+L SFN、I∕R+H SFN组大鼠心肌组织TRP、KYN浓 度、KYN∕TRP比 值 依 次 降 低(P<0.05)。见表3。
表3 SFN对大鼠心肌组织TRP、KYN的影响
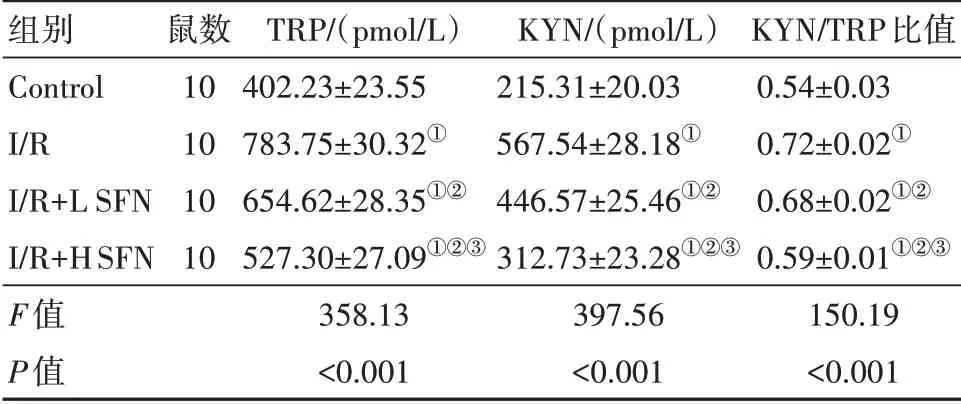
表3 SFN对大鼠心肌组织TRP、KYN的影响
注:Control为假手术组,I∕R为模型组,I∕R+L SFN为萝卜硫素低剂量组,I∕R+H SFN为萝卜硫素高剂量组,TRP为色氨酸,KYN为犬尿氨酸。①与Control组相比,P<0.05。②与I∕R组相比,P<0.05。③与I∕R+L SFN组相比,P<0.05。
组别Control I∕R I∕R+L SFN I∕R+H SFN F值P值鼠数10 10 10 10 TRP∕(pmol∕L)402.23±23.55 783.75±30.32①654.62±28.35①②527.30±27.09①②③358.13<0.001 KYN∕(pmol∕L)215.31±20.03 567.54±28.18①446.57±25.46①②312.73±23.28①②③397.56<0.001 KYN∕TRP比值0.54±0.03 0.72±0.02①0.68±0.02①②0.59±0.01①②③150.19<0.001
3 讨论
再灌注是治疗缺血性心脏病的主要方法,但再灌注会引起组织的持续损伤,心肌细胞的凋亡和炎症反应是心肌缺血再灌注损伤的关键过程[11]。心肌缺血再灌注损伤发病机制较为复杂,研究显示,再灌注损伤是由于炎症细胞因子表达增加引起的,IL-1β、IL-6是促进炎性因子,TNF-α是一种细胞信号转导蛋白,可促进炎症介质的表达,共同调控机体炎症反应[12]。本研究发现,I∕R组较Control大鼠心肌细胞破碎、坏死,细胞排列不规则,心肌纤维断裂,伴有炎性细胞浸润,血清中炎性因子IL-1β、IL-6、TNF-α含量显著升高,与申震等[13]研究结果一致,提示心肌缺血再灌注引起心肌组织发生炎症反应和损伤。因此,改善心肌缺血再灌注损在缺血性心脏病的治疗中具有重要意义。SFN是一种异硫氰酸酯,具有抗氧化活性,对心血管疾病有治疗作用。Bonetto等[14]研究显示,SFN能够减轻炎症反应,调节局部缺血后心室功能。本研究发现,SFN治疗后较I∕R组大鼠心肌细胞上述病理症状明显减轻,血清中炎性因子IL-1β、IL-6、TNF-α含量依次降低,提示SFN可以抑制炎性因子分泌,缓解心肌组织炎症反应和心肌损伤。
细胞凋亡是促炎性程序性细胞死亡,抑制细胞凋亡可以减轻再灌注损伤[15]。Bcl-2是抑制细胞凋亡因子,Bax通过激活cleaved-capase3引起细胞凋亡,在细胞凋亡过程中起着重要作用[16]。Peng等[17]研究显示,SFN可以抑制细胞凋亡,对心肌具有保护作用。本研究发现,与I∕R组相比,SFN治疗后较I∕R组大鼠心肌细胞凋亡指数、促凋亡相关蛋白Bax、cleaved-capase3表达显著降低,抑凋亡蛋白Bcl-2表达显著升高,提示SFN通过调控凋亡相关蛋白表达,抑制心肌缺血再灌注损伤大鼠心肌细胞凋亡。
TRP-KYN是机体色氨酸分解代谢的主要途径,参与免疫性疾病、神经精神性疾病、心血管疾病等疾病的发生[18-19]。IDO是KYN途径催化TRP降解的限速酶,由促炎性刺激和T辅助细胞相关细胞因子TNF-α、IL-6等诱导参与细胞凋亡[20]。研究显示,TRP-KYN通过调控巨噬细胞、T细胞、B细胞等免疫细胞介导炎症、免疫激活等反应在心肌缺血再灌注损伤等心血管疾病中发挥重要作用[21]。杨梦等[22]研究发现,通过调节大鼠体内氨基酸代谢、能量代谢及氧化应激反应,可以有效缓解高血压心力衰竭大鼠尿液代谢的异常。Baumgartner等[23]研究显示,通过TRP-KYN介导的信号传导是参与调节血管炎症的重要机制。本研究发现,I∕R组较Control大鼠心肌组织TRP、KYN浓度、KYN∕TRP比值、IDO蛋白表达显著升高,SFN治疗后较I∕R组大鼠心肌组织TRP、KYN浓度、KYN∕TRP比值、IDO蛋白表达依次降低,提示TRP、KYN浓度、KYN∕TRP比值和IDO蛋白表达与心肌缺血再灌注损伤有关,SFN可以抑制IDO、TRP、KYN、KYN∕TRP表达,推测SFN可能通过抑制TRP-KYN信号通路,减少心肌细胞凋亡,缓解机体炎症反应,对心肌损伤有保护作用。
综上所述,SFN可能通过抑制TRP-KYN信号通路,缓解机体炎症反应,减少心肌细胞凋亡,对心肌损伤有保护作用,但其具体作用机制仍需进一步研究,补充SFN对心肌梗死损伤等多方面进行补充验证。
(本文图1,2见插图1-3)
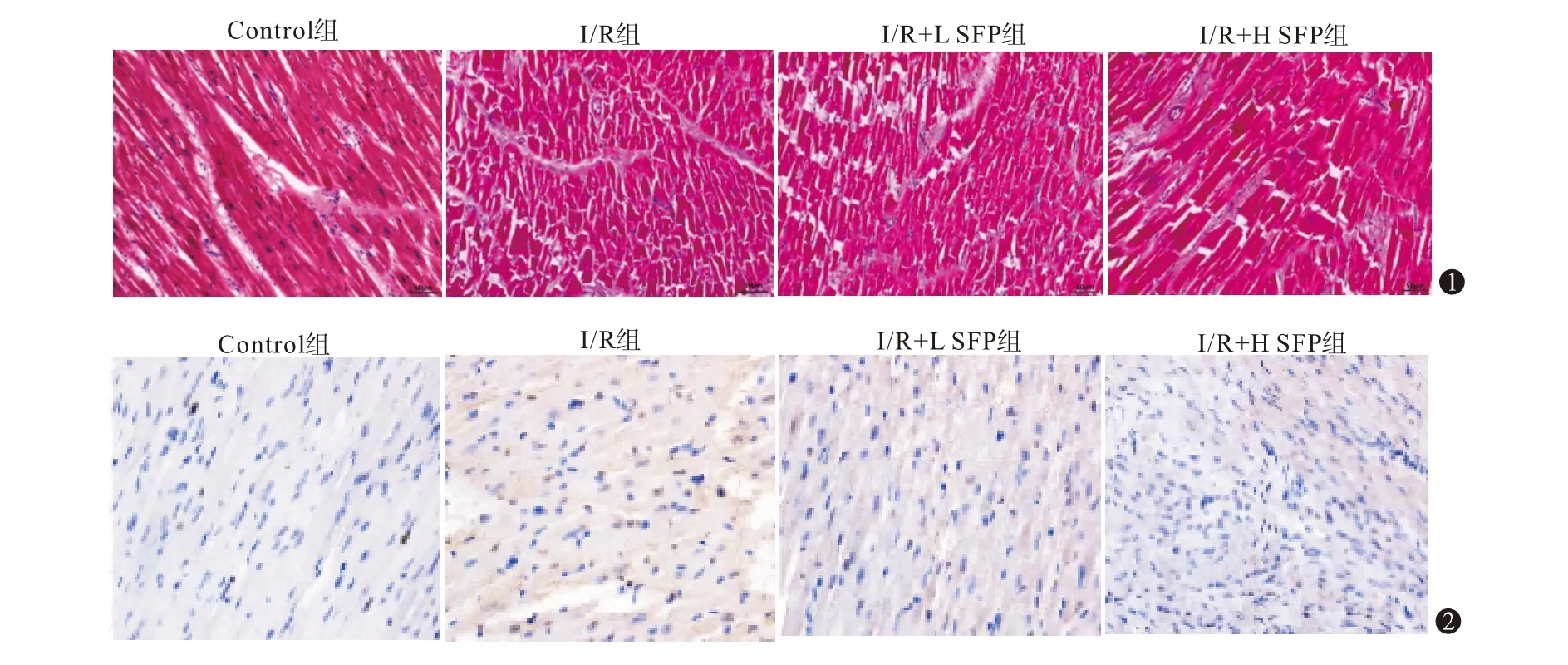
图1 各组大鼠心肌组织的病理变化(HE染色×200) 图2 各组大鼠心肌细胞的凋亡检测(TUNEL染色×200)

