阿帕替尼联合放疗治疗局部晚期胃癌的临床效果
彭卫卫 王 侠 郭小青 邓江华 陈元平 聂启鸿 钟丽婷 梅彩玲
早期胃癌患者缺乏典型症状,65%~70%患者发现时已处于中晚期,错失手术根治的机会。目前,针对局部晚期胃癌患者主要采用综合治疗模式,并以放化疗等姑息性治疗为主,以延缓患者病情进展。近年来,分子靶向治疗已成为临床研究的热点,为胃癌患者的治疗提供了新的思路[1]。阿帕替尼属于血管内皮生长因子(VEGF)拮抗剂,可结合该受体胞内酪氨酸激酶ATP 结合位点,阻断VEGF 信号传导,抑制其磷酸化,抑制血管生成,已被用于肺癌、肝癌及乳腺癌等多种实体瘤治疗中[2-3]。鉴于此,本研究就阿帕替尼联合放疗治疗局部晚期胃癌的临床效果进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年1—12 月于赣州市人民医院及南昌大学二附院治疗的60 例局部晚期胃癌患者作为研究对象,按随机数字表法分为观察组与对照组,各30 例。观察组男16 例,女14 例;年龄42~78 岁,平均(58.95±3.47)岁;病理分化程度:高分化、中分化及低分化各2 例、10 例、18 例。对照组男18 例,女12 例;年龄44~79 岁,平均(59.13±3.50)岁;病理分化程度:高分化、中分化及低分化各2 例、12 例、16 例。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。
1.2 纳入与排除标准
纳入标准:1)签署了知情同意书;2)均为初治患者,经病理活检确诊,影像学分期为局部晚期;3)患者不愿手术治疗或无法切除;4)至少有一处可测量的肿瘤病灶;5)能够耐受调强适形放疗(IMRT)、阿帕替尼治疗;6)预期生存≥3 个月。排除标准:1)ECOG 评分>2 分;2)合并严重感染;3)合并消化道大出血;4)合并其他恶性肿瘤;5)具有肠梗阻、恶心呕吐及无法吞咽等影响口服药物吸收的多种因素;6)精神行为异常,治疗依从性较低;7)出现中枢系统转移。
1.3 治疗方法
对照组进行IMRT 治疗,采用热塑体膜固定体位,采用6MV X 线完成IMRT 计划的设计,勾画肿瘤靶区(GTV)、临床靶区(CTV)及计划靶区(PTV),GTV:增强CT 所见胃部肿块及胃周转移淋巴结;GTV 上下外放1.0 cm、前后左右外放0.5 cm 为CTV;CTV 外放0.5 cm 为PTV。95%等剂量曲线包绕靶区边缘,放射总剂量50 Gy,2.0 Gy/次,1 次/d,共照射25 次,1~5 d/周,3 周为1 个疗程,连续治疗3 个疗程。观察组采用阿帕替尼(江苏恒瑞医药股份有限公司,国药准字H20140103)与IMRT 联合治疗,IMRT 方法同对照组,阿帕替尼:500 mg/次,1 次/d,餐后30 min 服用,直至病情进展或出现不可耐受毒性反应或患者自愿退出。
1.4 观察指标
1)疗效判定标准:肿瘤病灶完全消失为完全缓解(CR);肿瘤病灶体积缩小>50%为部分缓解(PR);肿瘤病灶体积缩小25%~50%为稳定(SD);肿瘤病灶体积增加>25%为进展(PD)。疾病控制率(DCR)=(CR 例数+PR 例数+SD 例数)/总例数×100%。2)统计两组无进展生存期(PFS)和总生存时间(OS)。3)不良反应:治疗后每周进行一次毒性反应评估,按照NCI-CTCAE 评分标准进行评估。
1.5 统计学分析
采用SPSS 22.0 统计软件进行数据分析,计数资料以百分率表示,组间比较采用χ2检验,计量资料以表示,组间比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效
观察组的DCR 高于对照组,差异有统计学意义(P<0.05)。见表1。
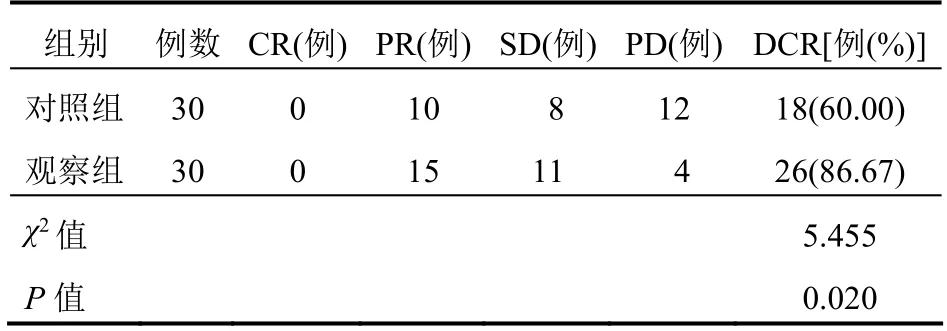
表1 两组患者临床疗效比较
2.2 PFS 及OS
观察组PFS 及OS 长于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者PFS 及OS 比较(个月,)

表2 两组患者PFS 及OS 比较(个月,)
2.3 不良反应
两组出现的不良反应多为Ⅰ~Ⅱ度,经处理后可控,患者耐受性较好;观察组血细胞减少发生率高于对照组,差异有统计学意义(P<0.05);两组其他不良反应发生率比较,差异无统计学意义(P>0.05)。见表3。
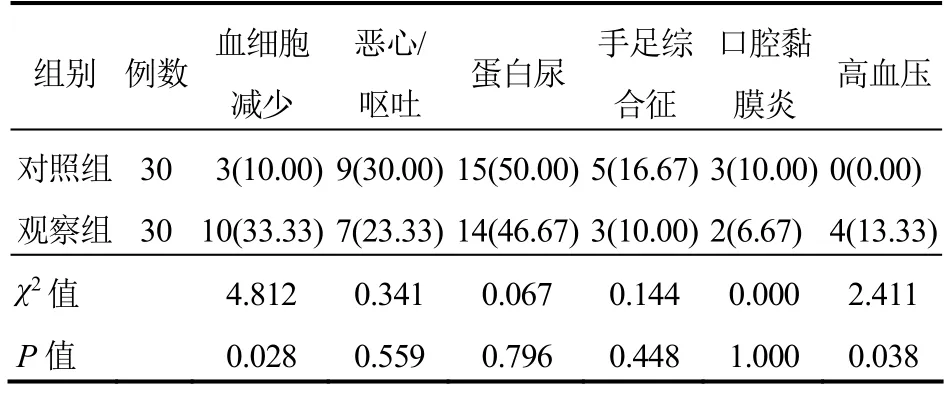
表3 两组患者不良反应比较[例(%)]
3 讨论
胃癌的发病机制仍未完全明晰,但幽门螺杆菌感染、饮食结构改变及工作压力增大等因素与胃癌发生具有密切联系[4]。目前,针对局部晚期胃癌患者尚无标准治疗方案,治疗手段主要有放射治疗、化学治疗及靶向治疗等。IMRT 是一种精确的放射治疗技术,能够提高靶区放疗剂量及肿瘤局部控制率,降低周围组织及器官的损伤[5]。同步放化疗为治疗胃癌的重要手段,有利于延长患者生存期,但不良反应较重,少数患者由于无法耐受不良反应而终止治疗[6]。
1971 年,Folkman[7]首次提出新生血管形成参与了肿瘤的生长及转移,通过对新生血管形成进行抑制,可达到治疗的目的。阿帕替尼抗肿瘤活性较强,是我国自主研发的VEGF 拮抗剂,于2014 年批准上市,类似于伐他拉尼,但阿帕替尼的亲和力较伐他拉尼及索拉非尼强10 倍[8-9]。阿帕替尼为选择性靶向VEGFR-2 的酪氨酸激酶抑制剂,可阻断VEGF 信号传导,抑制其磷酸化,阻碍其下游传导途径,抑制血管生成,达到治疗的目的[10]。本研究结果显示,观察组的DCR 高于对照组,PFS 及OS 长于对照组。黄志荣等[11]的研究证实,阿帕替尼与化疗联合治疗晚期胃癌的效果优于单独化疗,有利于延长患者生存期,临床应用安全性高,与本研究结果相似。提示阿帕替尼与IMRT 联合治疗局部晚期胃癌更有利于控制患者病情,提高DCR,延长PFS 及OS,可作为治疗局部晚期胃癌较为有效方法。阿帕替尼治疗的主要靶点是肿瘤血管,IMRT 治疗的主要靶点是肿瘤细胞,将阿帕替尼与IMRT 联合应用能够发挥协同效应,促进肿瘤血管正常化,提高肿瘤氧合,促使肿瘤细胞的放射敏感性得以增强[12]。实际临床工作中发现,越来越多的患者在注重疗效外,还加强了对不良反应的关注,不良反应的发生会影响患者治疗依从性,甚至导致患者终止治疗,阿帕替尼的主要不良反应包括血液学毒性及非血液学毒性,且大部分不良反应可通过下调剂量、暂停给药、对症处理得到缓解。本研究结果显示,两组出现的不良反应多为Ⅰ~Ⅱ度,经处理后可控,患者耐受性好;观察组血细胞减少发生率高于对照组;两组其他不良反应发生率比较差异无统计学意义。提示采用阿帕替尼与IMRT 联合治疗会增加血细胞减少发生率,需要引起临床重视,但不良反应经处理后可控。阿帕替尼虽为局部晚期胃癌的治疗提供了新思路,但本研究仅纳入60 例患者,样本量小,还有待临床开展大样本量、随机对照研究,以进一步证实阿帕替尼治疗局部晚期胃癌的临床疗效与安全性,以为局部晚期胃癌患者的治疗提供更为科学的指导。
综上所述,阿帕替尼与IMRT 联合治疗局部晚期胃癌可提高DCR,延缓疾病进展,延长患者的PFS及OS,治疗过程中会增加血细胞减少发生率,但经处理后可控,患者耐受性好。

